

кислота + Н2О ↔ анион кислоты + Н3О+ (ион гидроксония)
Концентрация воды постоянна, и произведение К×[Н2О] называют константой кислотности и обозначают Ка. Чем больше величина Ка тем сильнее кислота. Например, для уксусной кислоты Ка = 1,75 × 10-5. Такие малые величины неудобны в практике и поэтому для количественной оценки кислотности введено использование отрицательного десятичного логарифма константы кислотности или рКа. Например, для уксусной кислоты рКа = 4,75. Следовательно, чем меньше величина рКа, тем сильнее кислота.
Сравнительный анализ силы органических кислот можно проводить, сопоставляя стабильность анионов, образующихся из этих кислот. Чем стабильнее анион, тем сильнее кислота.
Стабильность аниона зависит:
1)от делокализации отрицательного заряда на поверхности аниона – чем больше делокализация отрицательного заряда, тем стабильнее анион и, следовательно, сильнее кислота.
2)от наличия сопряжения – чем больше участок сопряжения, тем сильнее кислота.
3)от влияния заместителей на кислотный центр – электроноакцепторные заместители увеличивают силу кислоты, способствуя делокализации отрицательного заряда, а электронодонорные уменьшают силу кислоты.
4)от электроотрицательности атома в кислотном центре – чем больше электроотрицательность, тем сильнее кислота.
Взависимости от строения кислотного центра органические кислоты делятся на 4 типа:
1. О–Н кислоты; 2. S–Н кислоты; 3. N–Н кислоты; 4. С–Н кислоты. Кислотность различных классов органических соединений с одинаковыми
заместителями возрастает в следующей последовательности:
алканы ( - СН) → амины (- NН) → спирты (- ОН) → тиолы (-SН) → фенолы → карбоновые кислоты.
Органические основания для образования ковалентной связи с протоном должны содержать или электроны π-связи или свободную электронную пару, в

качестве которой чаще всего используют π-электроны гетероатомов - O, N, S, галогенов и др. элементов.
Все факторы, которые усиливали кислотность, уменьшают способность органического соединения быть основанием и, наоборот, всё, что уменьшало кислотные свойства соединений, способствует усилению их свойств как оснований.
2.4. Реакции окисления и обратные им реакции
восстановления.
Реакции окисления типичны для первичных и вторичных спиртов, фенолов, тиоспиртов, альдегидов. Признаком окисления является увеличение процентного содержания кислорода в окисляемой молекуле. Реакции окисления могут протекать двумя путями: 1) в результате включения кислорода в молекулу; 2) в результате дегидрирования
Примеры: |
Н |
СН3 – СН2 – ОН + О2 --→ СН3 – С=О + Н2О |
|
|
Уксусный |
|
альдегид |
СН3 – СН – СН3 + [О] → СН3 – С – СН3 + Н2О
│ |
║ |
ОН |
О |
вторичный |
кетон (ацетон) |
спирт |
|
Третичные спирты устойчивы к окислению.
гидрохинон хинон
- 2 Н |
|
|
2 СН3 – SН --------------- |
→ |
СН3 – S – S – СН3 |
тиоспирт |
дисульфидные производные |
|
НАД-зависимая алкоголь-ДГ |
||
СН3 – СН2 – ОН + НАД + |
|
СН3 – С =О + НАДН + Н+ |
(никотинамид |
│ |
|
адениндинуклеотид)

Блок обучающих заданий:
Задание 1. Напишите реакцию хлорирования изобутана. Опишите механизм.
Ответ: |
|
|
|
СI |
|
|
СН3 – СН – СН3 |
hν |
|
│ |
|
|
|
│ |
+ Сl2 |
→ CН3 – С – СН3 + НСl |
||||
СН3 |
|
|
|
│ |
|
|
|
|
|
|
СН3 |
|
|
|
Механизм радикального замещения: |
|
|
|||
Инициирование: |
Сl2 → 2Сl• |
|
|
|
|
|
Рост цепи: |
|
|
|
• |
|
|
СН3 – СН – СН3 |
|
|
CН3 – С – СН3 |
|
|
|
|
│ |
+ Сl• → |
│ |
+ |
НСl |
|
|
СН3 |
|
|
СН3 |
|
|
|
|
|
|
Cl |
|
|
|
• |
|
|
│ |
|
|
СН3 – С – СН3 |
+ Сl2 |
→ CН3 – С – СН3 |
+ Сl• |
|||
|
│ |
|
|
│ |
|
|
|
CН3 |
|
|
СН3 |
и т.д. |
|
Задание 2. Напишите реакцию бромирования толуола (метилбензола), укажите механизм, покажите ориентирующее действие метильной группы.
толуол 2,4,6 – трибромтолуол
Метильная группа (+I) ориентирует в орто- и параположения. Механизм – электрофильное замещение.
Задание 3. Напишите реакцию гидратации 2-метилпропена. Какое соединение легче вступает в эту реакцию: 2-метилпропен или этилен? Почему?
Ответ: |
|
ОН |
|
Н2SО4 |
│ |
СН3 – С = СН2 |
+ НОН --------- → |
Н3С – С – СН3 |
│ |
|
│ |
СН3 |
|
СН3 |
2-метилпропен |
2-метилпропанол-2 |
|
Вследствие положительного индуктивного эффекта двух метильных групп электронная плотность двойной связи 2-метилпропена повышена по сравнению с этиленом и 2-метилпропен легче вступает в реакцию.
Задание 4. Напишите реакцию н-пропилхлорида с водным раствором КОН. По какому механизму она протекает?
Ответ:
водный р-р
СН3 – СН2 – СН2 – Сl + КОН ------ |
→ СН3 – СН2 – СН2 – ОН + КСl |
Реакция нуклеофильного замещения. |
Хлорид ион – Сl- замещается на |
нуклеофил – гидроксид-ион – ОН-. |
|
Задание 5. Какое соединение является более сильной кислотой – этиловый спирт или этилмеркаптан?
Ответ: кислотность определяется стабильностью соответствующих анионов. Чем стабильнее анион, тем сильнее кислота.
СН3 – СН2 –О- |
< |
СН3 – СН2 – S– |
менее стабильный анион, |
более стабильный анион, т.к. |
|
отрицательный заряд |
|
атом серы имеет большие размеры, |
локализован на атоме |
чем атом кислорода. |
|
кислорода. |
|
|
Задание 6. Какая кислота более сильная: трихлоруксусная или уксусная. Ответ: более сильная кислота – трихлоруксусная, т.к. отрицательный заряд распределен по всему аниону и, следовательно, этот анион более стабилен.
|
|
|
Сl δ- |
|
|
δ+ |
|
δ- |
δ- ↑ |
δ- |
|
СН3 → С = О |
Сl ← С – С = О |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О- δ- |
Сl |
О δ- |
||
|
|
|
δ- |
|
|
менее стабильный анион |
более стабильный анион |
||||
Задание 7. Чем объясняется наличие основных свойств у аминов? Расположите в ряд по уменьшению основности метиламин, диметиламин, трифторметиламин.
Ответ: основность аминов определяется наличием неподеленной пары электронов у атома азота, которую он может предоставить для связи с протоном кислоты. Электронодонорные заместители (метильные группы, +I эффект) увеличивают основность. Электроноакцепторные (СF-3, -I эффект) – уменьшают.

|
основность уменьшается: |
|
|
|
|
|
F |
|
F |
|
|
↑ |
|
↑ |
СН3 →N←CH3 |
> H – N ← CH3 |
> F←C – N –C→ F |
||
│ |
│ |
↓ |
↓ |
↓ |
Н |
Н |
F |
C |
F |
|
|
|
↓ |
|
|
|
F |
F F |
|
Лабораторно-практические работы.
Опыт 1. Окисление этилового спирта хромовой смесью.
Этиловый спирт можно окислить хромовой смесью. Для этого в пробирку добавляют:
2 капли этилового спирта + 1 капли 2 н. Н2SО4 + 2 капли 0,5н К2Сr2О7 Полученный оранжевый раствор нагрейте над пламенем спиртовки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится сине-зеленым. Одновременно ощущается характерный запах уксусного альдегида, напоминающий запах яблок.
К2Сr2О7 + Н2SО4 → Н2Сr2О7 + К2SО4 Н2Сr2О7 → Н2О + 2СrО3
2СrО3 → Сr2О3 + 3О (идет на окисление)
СН3 – СН2 – ОН + О → Н2О + СН3 – С = О
│
Н
Одновременно происходит образование сульфата хрома сине-зеленого цвета.
Сr2О3 + 3 Н2SО4 → Сr2(SO4)3 + 3 H2O
Опыт 2. Окисление этилового спирта марганцовокислым калием.
Поместите в пробирку: 2 кап. этилового спирта + 2 кап. 0,1н раствора КМnО4 + 3 кап. 2н раствора серной кислоты.
Слегка нагрейте пробирку над пламенем спиртовки. Сразу же наблюдается обесцвечивание розового раствора. Выпадают хлопья окислов марганца. При некотором избытке серной кислоты они растворяются, давая бесцветный раствор сернокислого марганца. Ощущается характерный запах уксусного альдегида.
КМnO4 |
+ H2SO4 → KHSO4 + HMnO4 |
2 HMnO4 → Mn2O7 + H2O |
|
Mn2O7 |
→ 2 MnO + 5O (идет на окисление спирта) |

Реакция окисления этанола протекает аналогично вышеописанной. Одномоментно идет растворение оксида марганца в серной кислоте.
МnO + H2SO4 → MnSO4 + H2O.
Опыт 3. Реакция на многоатомные спирты.
Поместите в пробирку: 3 кап. 0,2н раствора CuSO4 + 3 кап. 2н раствора NaOH, взболтать. Появляется голубой студенистый осадок гидроксида меди (II):
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
При нагревании в щелочной среде до кипения полученный гидрат меди разлагается. Это видно по выделению черного осадка окисда меди (II)
Сu(OH)2 → H2O + CuO
Повторите опыт, но перед кипячением гидрата окиси меди добавьте 1 кап. глицерина. При взбалтывании осадок растворяется. Появляется темно-синее окрашивание от образовавшегося глицерата меди. Нагрейте до кипения полученный раствор, убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Здесь образуется хелатное соединение меди.
СН2 |
- ОН |
НО – СН2 |
СН2 – ОН |
О – СН2 |
│ |
|
│ |
│ |
│ |
СН – ОН +НО – Сu – ОН + НО– СН → |
СН – О -- Сu -- |
О – СН + 2Н2О |
||
│ |
|
│ |
│ |
│ |
СН2 |
– ОН |
НО – СН2 |
СН2 - О |
НО - СН2 |
Растворение наблюдается только в щелочной среде. Щелочной раствор глицерата меди под названием реактива Гайнеса применяется в клинических лабораториях для открытия глюкозы в моче.
Опыт 4. Доказательство кислотного характера фенола.
К фенольной воде добавьте ёще одну каплю фенола и взболтайте. К полученной мутной эмульсии фенола в воде добавьте одну каплю 2н раствора NaOH. Моментально образуется прозрачный раствор фенолята натрия, так как он
хорошо растворяется в воде. |
|
|
|
|
ОН |
ОNa |
|||
│ |
│ |
|||
|
+ NaOH → |
|
|
+ Н2О |
|
|
|||
|
|
|
|
|

Опыт 5. Доказательство основных свойств анилина.
Поместите в пробирку одну каплю анилина. Добавьте 3 капли воды и взболтайте. Образуется мутная жидкость – эмульсия анилина в воде. Это указывает на то, что сам анилин плохо растворяется в воде. Добавьте в пробирку одну каплю 2н раствора НСl. Анилин превращается в солянокислую соль, хорошо растворимую в воде.
NH2 |
|
NН3 + |
|
|
||
|
|
|
||||
│ |
|
│ |
|
|||
|
+ HCl → |
|
|
|
|
Сl- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II часть
Спирты
Соединения, содержащие одну или несколько гидроксогрупп, называются спиртами.
Если молекула содержит одну гидроксогруппу, то спирт называется одноатомным, если две – двухатомным, три – трехатомным и т.д.
Для одноатомных спиртов общая формула: R-OH, где R- углеводородный алифатический радикал.
У ароматических спиртов – гидроксильная группа связана с бензольным кольцом через -СН2- группу:
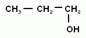
Кроме того, различают первичные, вторичные и третичные спирты, в зависимости от того с каким атомом углерода соединена группа –ОН.

1) 
2) 
3)
Номенклатура и изомерия предельных одноатомных спиртов. Наличие гидроксогруппы обозначается в названии вещества суффиксом –ол. Положение гидроксогруппы в молекуле спирта указывается цифрой после суффикса. Нумерацию цепи начинают с того конца, ближе к которому находится гидроксильная группа. Для спиртов возможна структурная изомерия и изомерия положения функциональной группы. Возможна и межклассовая изомерия с простыми эфирами. Число структурных изомеров быстро возрастает с увеличением числа углеродов. Для С4 существует четыре изомера, для С5 их восемь и т.д.
Изомеры бутанола:
1) бутанол-2
2) бутанол-1
3)2-метилпропанол-2
4)2-метилпропанол-1
Физические свойства. Вследствие образования водородных связей между гидроксогруппами спиртов, они имеют аномально высокие температуры кипения. Например, этиловый спирт - это жидкость с характерным запахом и жгучим вкусом, перегоняется при 78,15о (такой спирт содержит 95,5% спирта (по массе) и называется ректификатом). При н.у. низшие спирты являются жидкостями, бесцветными и прозрачными, с характерным запахом.
Спирты могут растворяться в воде. Первые три члена гомологического ряда (метанол, этанол, пропанол) неограниченно растворимы в воде. С увеличением углеводородного радикала растворимость спиртов падает.
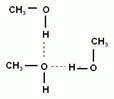
Высшие спирты не растворимы в воде. Сами спирты являются хорошими растворителями для органических и для неорганических веществ.
Физиологическое действие спиртов. В растворах спиртов денатурирует белок. Метанол (метиловый или древесный спирт) СН3ОН – сильный яд, в пищеварительном тракте образует формальдегид и муравьиную кислоту. Попадание в организм даже небольших (5-10 г) количеств метанола вызывает слепоту, а дозы от 30 г приводят к смертельному исходу. Этанол (виноградный или медицинский спирт) С2H5OH обладает наркотическим (затормаживаются реакции, нарушается координация, появляется эффект привыкания) и обезболивающим действием. При систематическом потреблении вызывает глубокие нарушения работы ЖКТ, печени, сердечно-сосудистой системы, разрушение нервной системы. В больших количествах и одноразовый прием - смертельно опасен (около 6—8 г/кг массы тела).
Строение молекулы этанола. С2H5/→O ←H или С2H5→O ←/H
С появлением гидроксогруппы в молекуле спирта появляются две сильно полярные связи. Причем электронная плотность в обоих связях смещена к более электроотрицательному кислороду и на нем находится избыток электронной плотности. А на атоме водорода образуется частичный положительный заряд. Полярные связи рвутся легче, чем неполярные. Здесь у нас есть два варианта. Или образуется нуклеофильная группа гидроксогруппа ОН- и электрофил С2H5. Или образуется нуклеофильная группа -OС2H5 и электрофил -Н+.
Химические свойства.
1). Для спиртов возможна реакция замещения водорода на натрий
(SЕ):
С2H5OH + Na  С2H5ONa + H2
С2H5ONa + H2
В этой реакции проявляются кислотные свойства спиртов, образующиеся вещества называют алкоголятами (этилат натрия). Но спирты нельзя назвать кислотами, потому что растворы спиртов имеют нейтральную реакцию, и со щелочами они не взаимодействуют.
2). Но для спиртов более характерны реакции замещения гидроксогруппы (SN), например, с галогеноводородами или молекулой другого спирта (образование простых эфиров).

С2H5OH + HCl → С2H5Cl + H-OH С2H5OH + С2H5OH ↔С2H5-O-С2H5+ H2O
реакция идет при нагревании до 140 
3). Кроме того для спиртов возможны реакции отщепления
(элиминирования Е).
СН3-СН2ОН → СН2=СН2 + H2O реакция идет при нагревании выше 140  в присутствии конц. Серной кислоты, как водоотнимающего средства. Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
в присутствии конц. Серной кислоты, как водоотнимающего средства. Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
4). Как и все органические вещества спирты легко окисляются при повышенной температуре в присутствии воздуха.
С2H5OH + О2  СO2 + H2O, причем ∆Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
СO2 + H2O, причем ∆Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
При действии более мягких окислителей из спирта образуются альдегиды (из первичного) или кетоны (из вторичного). Например:
СH3-CH2-OH + CuO → СH3-COH + Cu + H2O
Третичный спирт окисляется только при жестких условиях с разрывом связи С-С и образованием нескольких кислот
Метанол подвижная жидкость, запах очень похож на запах этанола, легко воспламеняется. Широко используется как растворитель. В органическом синтезе используют для получения формальдегида, а из него полимеров.
Метанол токсичен для человека при пероральном, ингаляционном и перкутантном путях поступления. В процессе метаболизма он окисляется до ацетальдегида и частично до муравьиной кислоты. Последняя угнетает действие некоторых ферментов и является причиной метаболического ацидоза.
Этанол – в технике, парфюмерии, в пищевой и медицинской промышленности используется как очень хороший растворитель. Этиловый спирт – важное сырье для органического синтеза (каучук, сложные эфиры, синтетические волокна…). Кроме того, спирт в медицине используется как обезболивающее (общая нечувствительность) и дезинфицирующее средство (денатурирует белок).
Систематическое употребление этилового алкоголя приводит к развитию патологических процессов в разных органах и тканях организма. Прямое
