
- •Билет №1. Основные кинематические характеристики криволинейного движения: скорость и ускорение. Нормальное и тангенциальное ускорение.
- •Основные характеристики криволинейного движения:
- •2. УСКОРЕНИЕ
- •4.НОРМАЛЬНОЕ УСКОРЕНИЕ
- •Билет №2. Кинематика вращательного движения: угловая скорость и угловое ускорение, их связь с линейной скоростью и ускорением.
- •Билет №3. Инерциальные системы отсчета и первый закон Ньютона. Второй закон Ньютона. Масса, импульс, сила.
- •Билет №4. Закон сохранения импульса. Упругое и неупругое взаимодействие.
- •Билет №5. Уравнение движения материальной точки. Третий закон Ньютона. Силы трения. Сила упругости.
- •Уравнение движения материальной точки
- •Векторный способ описания движения
- •Координатный способ описания движения
- •Естественный способ описания движения
- •Третий закон Ньютона
- •Силы трения
- •Виды трения:
- •Сила упругости
- •Закон Гука
- •Билет №6. Закон всемирного тяготения. Зависимость ускорения свободного падения от высоты. Первая космическая скорость.
- •Билет №7. Сила, работа и потенциальная энергия. Консервативные и неконсервативные силы. Работа и кинетическая энергия. Закон сохранения полной механической энергии в поле потенциальных сил.
- •Дополнительная информация:
- •Ответ:
- •СИЛА (консервативные и неконсервативные силы)
- •Работа (работа, кинетическая энергия и потенциальная энергия)
- •Закон сохранения полной механической энергии в поле потенциальных сил.
- •Билет №8. Момент импульса материальной точки и механической системы. Момент силы. Уравнение моментов. Закон сохранения момента импульса механической системы.
- •Момент силы
- •Момент импульса материальной точки и механической системы.
- •Уравнение моментов.
- •Закон сохранения момента импульса механической системы.
- •Билет №9. Момент импульса тела. Момент инерции. Основное уравнение динамики вращательного движения твердого тела с закрепленной осью вращения.
- •Билет №10.Теорема Штейнера. Доказательство. Примеры использования.
- •Билет №11. Кинетическая энергия твердого тела при вращении
- •Билет №12. Неинерциальные системы отсчета. Силы инерции. Отличие сил инерции от сил взаимодействия.
- •Билет №13. Кориолисово ускорение. Причина возникновения. Направление.
- •Билет №15. Постулаты специальной теории относительности (СТО) Эйнштейна. Относительность одновременности и преобразования Лоренца.
- •Билет №16. Парадоксы релятивистской кинематики: сокращение длины и замедление времени в движущихся системах отсчета.
- •Билет №17. Релятивистский импульс. Взаимосвязь массы и энергии в СТО.
- •Билет №18. Термодинамическое равновесие и температура. Эмпирическая температурная шкала. Нулевое начало термодинамики.
- •Билет №19. Квазистатические процессы. Уравнение состояния в термодинамике. Обратимые и необратимые процессы.
- •Билет №20. Работа, внутренняя энергия, количество теплоты. Первое начало термодинамики.Теплоемкость. Уравнение Майера.
- •Билет №21. Изохорический, изобарический, изотермический, адиабатический процессы в идеальных газах. Преобразование теплоты в механическую работу.
- •Билет №23. Энтропия. Второе начало термодинамики. Невозможность вечного двигателя второго рода.
- •Билет №24. Давление газа с точки зрения МКТ. Теплоемкость и число степеней свободы молекул газа.
- •Билет №25. Распределение Максвелла для модуля и проекций скорости молекул идеального газа. Экспериментальное обоснование распределения Максвелла.
- •Билет №26. Распределение Больцмана и барометрическая формула
- •Билет №27. Элементы физической кинетики, средняя длина свободного пробега. Явления переноса. Диффузия, теплопроводность, внутреннее трение. Броуновское движение.
- •Билет №28. Учет межмолекулярного взаимодействия в газах. Уравнение Ван-дер-Ваальса.
- •Билет №29. Изотермы реального газа. Двухфазные состояния. Внутренняя энергия реального газа.
Билет №19. Квазистатические процессы. Уравнение состояния в термодинамике. Обратимые и необратимые процессы.
Квазистатический процесс в термодинамике— идеализированный процесс, состоящий из непрерывно следующих друг за другом квазистатических состояний, в которых характеризующие систему термодинамические величины за время наблюдения не изменяются. Если каждое такое квазистатическое состояние системы близко к состоянию равновесия и, следовательно, систему в каждый момент времени можно считать находящейся в термодинамическом равновесии, то такие процессы называют равновесными, или, точнее, квазиравновесными.
Значение квазистатических процессов состоит в том, что они сильно упрощают термодинамические исследования. Это объясняется тем, что для мгновенного описания состояния системы, совершающей квазистатический процесс, требуется столько же параметров, сколько и для описания равновесного состояния. В случае газа таких параметров два, например объём и температура.
Квазистатические процессы в строгом смысле этого слова никогда не реализуются в природе. Они являются абстракциями. Но к ним можно подойти сколь угодно близко. Очень многие реальные процессы, идущие с конечными скоростями, часто могут считаться приблизительно квазистатическими.
Простейшей идеализированной моделью вещества является идеальный газ. Идеальный газ это газ, в котором взаимодействие между молекулами пренебрежимо мало, а размеры молекул много меньше размеров сосуда.
Для описания сложной системы (термодинамической системы), состоящей из большого числа молекул, используют усреднённые параметры системы. Основные из них это объём, давление и температура.
Уравнение состояния – функциональная зависимость между параметрами состояния при равновесии. Приведём общий вид уравнения состояния термодинамической системы F (P ,V ,T )=0
Конкретный вид уравнения зависит от физических свойств рассматриваемой системы. Многочисленные экспериментальные данные свидетельствуют, что большинство газов при нормальных условиях с достаточной точностью могут быть описаны уравнением состояния идеального газа.
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона)
pV =vRT или pV = m RT |
, |
μ |
|
где v= mμ – количество вещества; Т – термодинамическая температура; V – объём,
занимаемый газом; P – давление газа; m – масса газа; – молярная масса газа; R – универсальная газовая постоянная, R = 8,31 Дж /(мольК).
Универсальная газовая постоянная – это физическая величина, характеризующая работу одного моля газа при его изобарном нагревании на один Кельвин.
Другая форма уравнения состояния: P=nkT где k – постоянная Больцмана, выражающая соотношение между единицей энергии и единицей температуры, k = 1.38·10-23Дж/К, Т – температура, выраженная в Кельвинах.
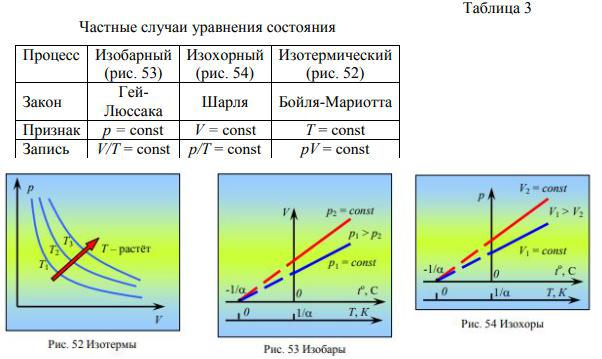
Процессы изменения состояния термодинамической системы, протекающие при неизменной массе и постоянном значении одного из параметров состояния, называют изопроцессы. Все законы идеальных газов для изопроцессов могут быть получены из уравнения состояния идеального газа (см. табл. 3).
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений.
Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Билет №20. Работа, внутренняя энергия, количество теплоты. Первое начало термодинамики.Теплоемкость. Уравнение Майера.
1.Внутренняя энергия в термодинамике
Внутренней энергией тела называется сумма кинетических энергий хаотического движения молекул и потенциальных энергий их взаимодействия друг с другом. Кинетическая энергия тела как целого (или например энергия ветра) во внутреннюю энергию не входит.
Внутренняя энергия тела является аддитивной величиной, т.е. внутренняя энергия всего тела равна сумме энергий его частей.

Внутренняя энергия тела является функцией состояния системы. Это значит, что, каким бы способом мы ни привели систему в некое состояние, энергия всегда будет одной и той же, т.е. изменение внутренней энергии при переходе из одного состояния в другое всегда равна разности энергий в этих двух состояниях и не зависит от процесса перехода.
2.Работа в термодинамике
При перемещении поршня сечением S в цилиндре газ совершает работу, равную произведению силы F на перемещение. Сила связана с давлением р известным соотношением F = pS.
Интегрирование дает работу при переходе из начального состояния с объемом V1 в конечное состояние с объемом V2
3.Количество теплоты в термодинамике.
Коли́чество теплоты́— энергия, которую получает или теряет тело при теплопередаче.
Количество теплоты входит в математическую формулировку первого начала термодинамики 

Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние
4.Первое начало термодинамики.
5.Теплоемкость.

