
- •Предисловие
- •Список сокращений
- •Глава 1. Взаимодействие микробов и организма человека
- •2.1. Физиологические барьеры
- •2.2. Врожденный и адаптивный иммунитет
- •3.1. Функции органов иммунной системы
- •4.1. Элементы врожденного иммунитета
- •4.2. Элементы адаптивного иммунитета
- •Глава 5. Развитие иммунного ответа
- •5.1. Патоген-ассоциированные молекулярные образы и антигены
- •5.2. Активация фагоцитов и эндотелия
- •5.3. Активация комплемента
- •5.4. Презентация антигенов
- •5.5. Активация T и B-лимфоцитов
- •5.6. Эффекторные лимфоциты и клетки иммунологической памяти
- •Глава 6. Особенности иммунного ответа против различных патогенов
- •6.1. Механизмы, обеспечивающие элиминацию патогенов
- •6.1.1. Фагоцитоз, комплемент
- •6.1.2. Иммуноглобулины
- •6.1.3. Клеточная цитотоксичность
- •6.1.4. Гранулематозная гиперчувствительность
- •6.2. Иммунный ответ против внеклеточных бактерий
- •6.3. Иммунный ответ против внутриклеточных бактерий
- •6.4. Иммунный ответ против вирусов
- •Глава 7. Механизмы уклонения патогенов от иммунного ответа
- •7.1. Уклонение от фагоцитоза и незавершенный фагоцитоз
- •7.2. Антигенная вариабельность
- •7.3. Нарушение презентации клетками микробных антигенов и выработка веществ, блокирующих развитие иммунного ответа
- •7.4. Инфицирование иммунокомпетентных клеток
ГЛАВА |
4. |
СИСТЕМЫ |
ВРОЖДЕННОГО |
И |
Фагоциты |
|
|
||
АДАПТИВНОГО ИММУНИТЕТА |
|
|
|
Фагоцитами называют гетерогенную группу клеток |
|||||
|
|
|
миелоидного происхождения, способную поглощать и |
||||||
Системы врожденного и адаптивного (приобретен- |
|||||||||
переваривать микробы. В крови это нейтрофилы и мо- |
|||||||||
ного) иммунитета представлены различными клетка- |
|||||||||
ноциты, в тканях – макрофаги и дендритные клетки. |
|||||||||
ми и растворимыми (гуморальными) факторами. Ней- |
|||||||||
Фагоцитоз является общей и основной функцией всех |
|||||||||
трализацию патогенов обеспечивает совместное и ко- |
|||||||||
этих клеток. |
|
|
|||||||
ординированное действие этих систем. Система врож- |
|
|
|||||||
Нейтрофилы являются мобильным пулом фагоци- |
|||||||||
денного иммунитета реагирует на внедрение микро- |
|||||||||
тов, они мигрируют из сосудистого русла в ткани, где |
|||||||||
бов незамедлительно, и если количество возбудителя |
|||||||||
фагоцитируют микробы. Миграция нейтрофилов в |
|||||||||
было небольшим, он не располагает выраженными ан- |
|||||||||
воспалительный очаг направляется специальными хи- |
|||||||||
тифагоцитарными факторами и не способен к внутри- |
|||||||||
мическими веществами – хемокинами (смотри 5.2. Ак- |
|||||||||
клеточному паразитированию, |
то инфекция может |
||||||||
тивация фагоцитов и эндотелия). В воспалительном |
|||||||||
быть остановлена уже на начальном этапе. Если же |
|||||||||
очаге каждый нейтрофил способен фагоцитировать |
|||||||||
система врожденного иммунитета не может самостоя- |
|||||||||
примерно 10-20 бактерий, после чего погибает. По- |
|||||||||
тельно нейтрализовать микроба, то активируется сис- |
|||||||||
гибшие нейтрофилы являются основным компонентом |
|||||||||
тема приобретенного иммунитета, что |
в конечном |
||||||||
гноя. |
|
|
|||||||
итоге обеспечивает элиминацию (удаление) возбуди- |
|
|
|||||||
Остальные фагоциты: моноциты, макрофаги и ден- |
|||||||||
теля. Система адаптивного иммунитета обладает им- |
|||||||||
дритные клетки способны не только фагоцитировать |
|||||||||
мунологической памятью, то |
есть при повторной |
||||||||
микробы, но и осуществлять процессинг и презента- |
|||||||||
встрече с тем же микробом иммунный ответ развива- |
|||||||||
цию бактериальных антигенов T-лимфоцитам (смотри |
|||||||||
ется гораздо быстрее и интенсивнее. |
|
|
|||||||
|
|
5.4. Презентация антигенов). Поэтому данную группу |
|||||||
|
|
|
|
|
|
||||
4.1. Элементы врожденного иммунитета |
|
клеток называют антигенпрезентирующими клетками |
|||||||
|
(antigen-presenting cells – APC). Особенно эффективно |
||||||||
Система |
врожденного иммунитета |
обеспечивает |
|||||||
презентируют антигены дендритные клетки, так как |
|||||||||
быструю нейтрализацию патогенов. Данная система |
|||||||||
могут одновременно контактировать с большим коли- |
|||||||||
способна отличать «свое» от «чужого», |
за счет чего |
||||||||
чеством T-хелперов. Кроме фагоцитоза и презентации |
|||||||||
происходит атака микробов, но не поражаются собст- |
|||||||||
антигенов, макрофаги и дендритные клетки обеспечи- |
|||||||||
венные ткани (смотри 5.1. Патоген-ассоциированные |
|||||||||
вают развитие воспалительной реакции за счет про- |
|||||||||
молекулярные образы и антигены). Данная система не |
|||||||||
дукции сигнальных молекул – цитокинов (смотри 5.2. |
|||||||||
требует времени на предварительную активацию и |
|||||||||
Активация фагоцитов и эндотелия). Функции макро- |
|||||||||
действует сразу после попадания микроба за физиоло- |
|||||||||
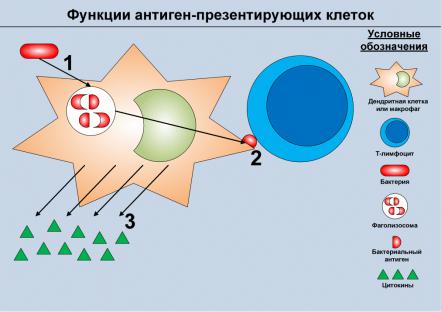
фагов и дендритных клеток отражены на рисунке 4.1. |
|||||||||
гические барьеры. Врожденный иммунитет обеспечи- |
|||||||||
|
|
|
|||||||
вается различными клетками и гуморальными факто- |
Система комплемента |
|
|
||||||
рами, основными из которых являются фагоциты, NK- |
|
|
|||||||
Комплемент – это система белков сыворотки крови, |
|||||||||
клетки и система комплемента. |
|
|
|
||||||
|
|
|
основной функцией которой является защита орга- |
||||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
Рисунок 4.1. Основные функции дендрит- |
|||
|
|
|
|
|
|
ных клеток и макрофагов – антигенпрезен- |
|||
|
|
|
|
|
|
тирующих клеток (APC). Данные клетки спо- |
|||
|
|
|
|
|
|
собны фагоцитировать практические любые |
|||
|
|
|
|
|
|
группы микробов, попадающих в ткани орга- |
|||
|
|
|
|
|
|
низма (1). После разрушения микробов в фа- |
|||
|
|
|
|
|
|
голизосоме отдельные бактериальные анти- |
|||
|
|
|
|
|
|
гены в комплексе с особыми белками транс- |
|||
|
|
|
|
|
|
портируются на поверхность клетки и презен- |
|||
|
|
|
|
|
|
тируются T-лимфоцитам (2). В то же время, за |
|||
|
|
|
|
|
|
счет распознавания микробов через специаль- |
|||
|
|
|
|
|
|
ные рецепторы, происходит активация APC, |
|||
|
|
|
|
|
|
которая приводит к продукции растворимых |
|||
|
|
|
|
|
|
сигнальных молекул – цитокинов (3). Цито- |
|||
|
|
|
|
|
|
кины обладают |
множеством биологических |
||
|
|
|
|
|
|
эффектов, в том числе модулируют воспали- |
|||
|
|
|
|
|
|
тельный ответ и способствуют активации |
|||
|
|
|
|
|
|
лимфоцитов. С целью упрощения на рисунке |
|||
|
|
|
|
|
|
не отображены молекулы, участвующие в раз- |
|||
|
|
|
|
|
|
витии всех перечисленных процессов, и отсут- |
|||
|
|
|
|
|
|
ствуют их отдельные стадии; вместо этого по- |
|||
|
|
|
|
|
|
казаны только конечные эффекты. |
|||
|
|
|
|||||||
|
|
|
|||||||
Зорников Д.Л., Литусов Н.В. Основы противоинфекционной иммунологии |
Страница 9 |
||||||||

низма человека от микробов. На долю комплемента приходится около 10% всех белков сыворотки крови. Синтезируемые в печени компоненты комплемента (9 основных компонентов и вспомогательные белки) циркулируют в крови в неактивной форме. Активация комплемента происходит при наличии микробного стимула с помощью нескольких механизмов (смотри
5.3. Активация комплемента). Активированный ком-
племент обеспечивает противоинфекционную защиту организма посредством нескольких механизмов (под-
робно смотри в 6.1.1. Фагоцитоз, комплемент):
прямой деструкции (лизиса) микробов;
тия адаптивного иммунитета требуется контакт с отдельными микробными структурами и время, продолжительностью от нескольких суток до нескольких недель.
Адаптивный иммунитет специфичен, то есть развивается только против отдельных микробных структур
– антигенов. Следовательно, для развития адаптивного иммунного ответа против каждого патогена требуется контакт с антигенами конкретного микроба. В то же время, система адаптивного иммунитета обладает памятью: после первого контакта с антигеном происходит как бы его «запоминание». В результате, при по-
ускорения фагоцитоза микробов (опсонизавторном попадании данного антигена в организм им-
ции); |
мунный ответ развивается быстрее и интенсивнее. |
|||
модулирования воспалительной реакции. |
Именно наличие иммунологической памяти обеспечи- |
|||
|
вает возможность вакцинации людей от инфекцион- |
|||
NK-клетки |
ных заболеваний. |
|
|
|
Данные клетки являются особой группой лимфоци- |
Развитие адаптивного иммунного ответа обеспечи- |
|||
тов, не имеющих дифференцировочных маркеров T и |
вается антиген-презентирующими клетками, T и B- |
|||
B-лимфоцитов. По морфологии NK-клетки отличаются |
лимфоцитами. Но при этом только T и B-лимфоциты |
|||
от T и B-лимфоцитов несколько большими размерами |
обладают способностью распознавать антиген. От- |
|||
и наличием гранул в цитоплазме, отсюда другое их на- |
дельные субпопуляции T-лимфоцитов выполняют раз- |
|||
звание – большие гранулярные лимфоциты. Цито- |
ные функции. B-лимфоциты представляют относи- |
|||
плазматические гранулы NK-клеток содержат белок |
тельно гомогенную популяцию клеток, способных |
|||
перфорин и ферменты гранзимы. Свое название клет- |
дифференцироваться в |
антителопродуцирующие |
||
ки получили от английского словосочетания natural |
клетки – плазмоциты. |
|
|
|
killers, что в переводе означает естественные, или на- |
|
|
|
|
туральные, киллеры. Функцией NK-клеток является |
T-хелперы |
|
|
|
разрушение инфицированных микробами клеток ор- |
Лимфоциты, несущие на поверхности цитоплазма- |
|||
ганизма (механизмы распознавания и деструкции ин- |
тической мембраны кластеры дифференцировки CD3 и |
|||
фицированных клеток NK-клетками смотри в 6.1.3. |
CD4, называют T-хелперами. Данная группа клеток |
|||
Клеточная цитотоксичность). |
осуществляет регуляцию иммунного ответа (отсюда и |
|||
|
название, от английского helper – помощник). |
|
||
4.2. Элементы адаптивного иммунитета |
Активированные T-хелперы способны активиро- |
|||
В отличие от врожденного иммунитета, для разви- |
вать другие клетки иммунной системы: макрофаги, |
|||
|
Рисунок 4.2. Влияние T-хелперов |
|||
|
на развитие иммунного ответа. |
|||
|
После |
распознавания презентиро- |
||
|
ванного антигена T-хелперы 0 типа |
|||
|
дифференцируются в T-хелперы 1 |
|||
|
или 2 типа. T-хелперы 1 типа про- |
|||
|
дуцируют цитокины (основными из |
|||
|
которых являются интерлейкин-2 и |
|||
|
гамма-интерферон), активирующие |
|||
|
макрофаги и цитотоксические T- |
|||
|
лимфоциты, что обеспечивает раз- |
|||
|
витие клеточного иммунного отве- |
|||
|
та. T-хелперы 2 типа, в свою оче- |
|||
|
редь, продуцируют иные цитокины |
|||
|
(интерлейкин-4 и др.), которые спо- |
|||
|
собствуют |
активации |
B- |
|
|
лимфоцитов и их дифференцировке |
|||
|
в плазматические клетки, что при- |
|||
|
водит |
к |
развитию гуморального |
|
|
иммунного ответа. С целью упроще- |
|||
ния на рисунке отображены не все молекулы, участвующие в развитии перечисленных процессов.
Зорников Д.Л., Литусов Н.В. Основы противоинфекционной иммунологии |
Страница 10 |

цитотоксические T-лимфоциты, B-лимфоциты (смотри
5.5. Активация T и B-лимфоцитов). Особая роль при этом отводится растворимым сигнальным молекулам
– цитокинам, но также активация может происходить и путем непосредственного межклеточного взаимодействия, через связывание сигнальных трансмембранных белков.
В зависимости от набора продуцируемых цитокинов выделяют два типа T-хелперов. T-хелперы 1 типа продуцируют преимущественно цитокины, активирующие макрофаги и цитотоксические T-лимфоциты, тем самым регулируют развитие клеточного иммунного ответа. T-хелперы 2 типа вырабатывают цитокины, обеспечивающие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки. Преобладание T-хелперов 2 типа способствует развитию гуморального иммунного ответа (рисунок 4.2).
Цитотоксические T-лимфоциты
Дифференцировочными маркерами цитотоксиче-
ских T-лимфоцитов (cytotoxic T lymphocyte – CTL) яв-
ляются молекулы CD3 и CD8. Второе название этих клеток – T-киллеры. Функцией активированных CTL является уничтожение клеток организма, презентирующих микробные антигены (т.е. инфицированных клеток). CTL и NK-клетки обладают общей функцией и схожей тактикой деструкции клеток, однако отличаются механизмами распознавания атакуемых клеток
(смотри в 6.1.3. Клеточная цитотоксичность).
B-лимфоциты и плазматические клетки
B-лимфоциты экспрессируют на поверхности цитоплазматической мембраны дифференцировочные молекулы CD19, CD20, CD21, CD22. На поверхности данных клеток также присутствуют иммуноглобулины, с помощью которых B-лимфоциты распознают антиген
(смотри 5.5. Активация T и B-лимфоцитов).
Плазматические клетки – это терминально дифференцированные B-лимфоциты. Эти клетки в огромных количествах продуцируют и секретируют во внеклеточное пространство иммуноглобулины.
Иммуноглобулины
Иммуноглобулины – это гликопротеины, продуцируемые B-лимфоцитами и плазматическими клетками. Существуют две формы иммуноглобулинов: мембранные и растворимые. Мембранные иммуноглобулины продуцируются B-лимфоцитами и остаются связанными с их цитоплазматической мембраной. Растворимые иммуноглобулины продуцируются плазматическими клетками и секретируются ими во внеклеточное пространство. Данные иммуноглобулины называют антителами.
Рисунок 4.3. Схематичное строение молекулы иммуног-
лобулина класса G (IgG). IgG является типовым иммуноглобулином. Это мономерная молекула, состоящая из двух тяжелых белковых γ-цепей (зеленый цвет) и двух легких белковых κ или λ-цепей (синий цвет). Между собой цепи связаны дисульфидными (красный цвет) и множеством нековалентных связей. Активные центры образуются N- концевыми участками тяжелых и легких цепей (выделены серыми овалами). Ближе к C-концевым участкам тяжелых цепей имеются боковые полисахаридные цепи (оранжевые полукруги).
Функцией мембранных иммуноглобулинов является распознавание антигенов (смотри 5.5. Активация T и B-лимфоцитов), в то время как антитела обеспечивают нейтрализацию микробов и их токсинов, а также усиливают функционирование элементов врожденного иммунитета (смотри 6.1.2. Иммуноглобулины).
Молекулы иммуноглобулинов состоят из тяжелых и легких белковых цепей, соединенных между собой дисульфидными связями (рисунок 4.3). Существует пять изоформ тяжелых цепей (альфа – α, гамма – γ, дельта – δ, эпсилон – ε, мю – µ) и две изоформы легких цепей (каппа – κ и лямбда – λ). Тяжелые и легкие цепи могут комбинироваться в любых сочетаниях, однако в составе каждой молекулы иммуноглобулина присутствуют только одинаковые изоформы тяжелых и легких цепей.
Зорников Д.Л., Литусов Н.В. Основы противоинфекционной иммунологии |
Страница 11 |

В зависимости от изоформы тяжелых цепей, входящих в молекулу иммуноглобулина, выделяют пять классов иммуноглобулинов (Ig): IgA, IgG, IgD, IgE, IgM.
Различные классы иммуноглобулинов отличаются не только по химической структуре, но и некоторым биологическим свойствам (таблица 4.1).
Таблица 4.1. Особенности строения и биологические свойства отдельных классов иммуноглобулинов (Ig). Иммуног-
лобулины отличаются по строению молекул и отличаются по биологическим свойствам. Класс иммуноглобулинов определяется изоформой тяжелых цепей, входящих в его состав. Выделяют пять классов иммуноглобулинов: IgA, IgG, IgD, IgE и IgM. В качестве типового иммуноглобулина принят IgG – мономер, состоящий из двух тяжелых γ-цепей и двух легких κ или λ цепей. Разные классы Ig отличаются количеством мономерных молекул входящих в состав иммуноглобулина, количеством активных центров и т.д.
Зорников Д.Л., Литусов Н.В. Основы противоинфекционной иммунологии |
Страница 12 |
