
- •Классификация наркотических и других одурманивающих средств.
- •Определения наркотик, психотропное вещество, психическая зависимость, физическая зависимость.
- •Охарактеризуйте действие одурманивающих средств (алкалоидов гр опия, каннабиноидов, фенилалкиламинов, галлюциногенов, кокаина) на организм. Каковы симптомы острого и хронического отравления.
- •5.Какова цель хта на одурманивающие в-ва.
- •6.Этапы хта.
- •7.Как проводится забор проб и хранение биоматериала. От каких факторов зависит выбор биоматериала при исследования на психоакитвные в-ва.
- •Правила отбора волос, ногтей, потожировых отделений.
- •8. Какие методы определения хта относятся к предварительным, а какие к подтверждающим.
- •9.Определение термина ложноположительный результат и ложноотрицательный.
- •10. Для каких целей применяется экстракция в хта.
Правила отбора волос, ногтей, потожировых отделений.
Масс-спектрометрия:
-опиаты
-амфетамины
-кокаин
-канабиноиды
(в отдаленные сроки после окончания их приема, даже когда анализ биожид. дает отрицат. результ.)
Прядь волос срезают- (300мг) 1 см2 как ближе к основанию, упаков. в конверт из фольги, подпис. Так же делят на две части, перед анализом можно промыть моющ.ср-вом, высуш.
Ногти-с каждого пальца как можно ближе к основанию, упак. в конверт.
Потожировые выделения. Анализ на кокаин. Берут смывы тампоном 400-500 мг, смоченный этанолом, обтирают вокруг рта и с каждой руки. Помещают в разные контейнеры. В лаборатории экстрагируют.
Таблетки. По атласу предполагают что за в-во. Смывают оболочку, взвешивают, измельчают с орагническим ра-ем. Фильтруют и анализируют.
Жидкость сразу анализируют.
Травы. Сначала фармакогностический анализ, экстракция, фильтрация, анализ примесей, свойственных стране-поставщике.
Трупы. 50-100 г печени, 1 почка, 50-100г мозга с описание объекта. Желудок с содержимым и промывные воды.
8. Какие методы определения хта относятся к предварительным, а какие к подтверждающим.
Скрининг – система методических приемов, позволяющих выбрать научно-обоснованную последовательность операций, в результате кот-го поэтапно «отсеиваются» группы соединений и отдельные в-ва.
Все пробы, поступившие в лабораторию подвергают обязательному иммунологическому исследованию на: канабиноиды, опиаты, амфетамины.
К предварительным методам относятся:
-цветные реакции
-.иммунохимические методы
- ТСХ-скрининг в норльно-фазовом варианте (для в-в изолируемых экстракцией и сорбцией)
-ТСХ-скрининг в-в кислотного, нейтрального и слабоосновного характера (определение гр соед-я)
- ТСХ-скрининг в-в основного хар-ра
- ТСХ-скрининг в-в кислотного хар-ра
К подтверждающим методам:
-микрокристаллоскопические реакции
-.УФ-спектрофотометрия
- ИК-спектроскопия
- ГЖХ
- ВЭЖХ
-хроматомасс-спектрометрия
-люминесцентный метод
-фармакогностический анализ
-фармакологический анализ
9.Определение термина ложноположительный результат и ложноотрицательный.
ложноположительный результат за счет перекрестных реакций: слабая подготовка экспертов, грязные реагенты, систематические ошибки.
Положительный: употребляет в-во постоянно или по рецепту врача.
Отрицательный результат: человек никогда не употреблял в-во, употреблял, но в последнее время прекратил, знал, что будет анализ и прекратил, разбавил пробу, подмена побы.
Ложноотриц: недостаточная чувствительность метода. Преднамеренная фальсификация. Низкая квалификация эксперта, систематические ошибки.
10. Для каких целей применяется экстракция в хта.
Это основной метод изолирования сильнодействующих и др одурманивающих ср-в из биологического материала.
Экстракция- процесс извлечения растворителями соответствующих в-в из объектов.
Жидкостная – распределение в-ва между двумя несмешивающимися жидкостями.
Экстрагент – орг растворитель, извлекающий в-во.
Проводят с помощью делительной воронки. В кот помещают исс-ый р-р и органический растворитель. Воронку встряхивают. Достигается равновесие концентраций жидкости расслаиваются и в-во остается в одной из фаз.
На экстакцию влияет:
-число экстраций от 2 до 6, соотношение экстрагент-биоматериал 1:1 или 2:1
- влияние Т на константу распределения. Что приводит к изменению степени извлечения
- электролиты. Высаливание переход в-ва из воды в органику, всаливание из органики в воду
- рН переход в-ва из ионизированного со-я в молекулярного, т к ионы лучше рас-ся в воде. В зависимости от гру в-в нам нужно менять рН.
11. Каковы основные количественные характеристики процесса экстаркции?
Для расчёта количества в-ва, которое экстрагируется органическим растворителем введены следующие характеристики. Для расчета кол-ва в-ва, экстрагируемого орг-ми растворителями, необходимо знать константу, коэффициент распределения, степень экстракции.
Константа
распределения в-ва
– величина,
отражающая отношение концентраций
распределяемного в-ва, находящегося в
водной и орг-ой фазах (после наступление
равновесия), в одной и той же форме:
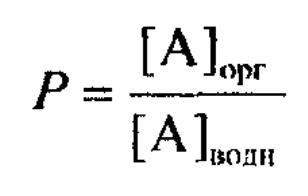
Коэффициент распределения – отношение суммарной аналитической концентрации в-ва в фазе орг-го растворителя к суммарной аналитической концентрации этого в-ва в водной фазе:
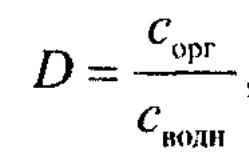
Степень экстракции – отношение кол-ва экстрагируемого в-ва к общему (начальному) кол-ву этого в-ва в водном р-ре:
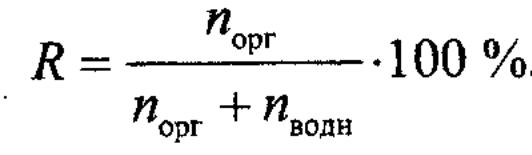
12. Почему взаимная растворимость воды в органических растворителях и органич. растворителей в воде является недостатком при использовании экстракции в ХТА? Почему необходимо многократно экстрагировать токсичные в-ва из вытяжек малыми объемами органических растворителей, не смешивающихся с водой, а не применять однократную экстракцию этих вещ-в большими объемами органических растворителей?
13. Как влияет рН среды на экстракцию органических кислот, оснований и амфотерных соединений? Какое влияние оказывают электролиты на экстракцию химических соединений?
С повышением рН ( т.е. уменьш. конц-я водородных ионов Н + в водном р-ре) увеличивается диссоциация кислоты в растворе и следовательно, понижается экстрагируемость слабой кислоты органическими растворителями. С понижением рН ( повышается конц-я Н + ) возрастает экстрагируемость вещ-в кислотного характера оргнич. растворителями.
Наибольшие количества амфотерных соединений экстрагируются при значении рН, соответ-щем изоэлектрической точке этих веществ.
Понижение растворимости веществ в водных растворах под влиянием электролитов- высаливание, а повышение растворимости – всаливание. Высаливание понижает растворимость вещ-в в воде и повышает их экстрагируемость органич. растворителями.
14. какие требования предъявляют к органическим растворителям, используемым для экстракции в ХТА?
Органич. р-ль должен эффективно и избирательно извлекать экстрагируемое вещ-во
Должен мало растворяться в воде и мало растворять воду, плотность также должна отличасться от плотности воды
Должен быть нелетуч и высококипящим ( выше 50)
Должен быть неогнеопасен, нетоксичный и дешевый
Такими характеристиками мало вещ-в обладают, используют эфир диэтиловый, хлороформ, а гексан, гептан – реже.
15. как проводится экстракция веществ кислого характера из биологических жидкостей?
10 мл биолгич. Жидкости ( мочи) в делительной воронке подкисляют HCl до рН 2. Добавляют диэтиловый эфир и проводят экстракцию в течении 5 мин ( перемешивая фазы без встряхиваний). После разделения фаз нижнюю водную сливают в другую делительную воронку с диэтиловым эфиром и повторно экстрагируют , а органическую фазу фильтруют через безводный сульфат натрия в стакан. Проводят 3 экстракции. Эфирное извлечение фильтруют через безводный сульфат натрия и обе вытяжки объединяют.
Органические растворители из экстрактов удаляют в испарительных чашках в токе теплого воздуха. Сухие остатки растворяют в 2 мл хлороформа и переносят в пробирки.
16. Как проводится экстракция веществ основного характера из биологических жидкостей?
10 мл биолгич. Жидкости ( моча) в делительную воронку, доводят до рН 9-10 с помощью гидроксида натрия. Проводят экстракцию хлороформом в течении 5 мин. Затем нижнюю органическую фазу сливают фильтруя через безводный сульфат натрия в стакан, а водную фазу повторно экстрагируют хлороформом. Органические фазы объединяют. Растворитель из экстрактов удаляют в испарительных чашках в токе теплого воздуха. Сухие остатки растворяют в 2 мл диэтилового эфира и переносят в пробирки.
17. В чем сущность метода твердофазной экстракции? Какие сорбенты используются?
В основе метода ТФЭ лежит принцип колоночной хроматографии. М основан на распределении целевого компонента между подвижной и неподвижной фазами в результате сорбционных процессов, протекающих в спец-ой колонке (картридже) для ТФЭ.
Картридж-патрон имеет полиэтиленовую оболочку, внутри которой находится сорбент, упакованный между 2мя пористыми фильтрами, наход-ся на входе и выходе патрона, выполненного из энертного материала.
3 основных типа ТФЭ:
при проведении удерживающей ТФЭ целевой компонент сначала удерживается на сорбенте, при этом мешающие примеси сорбентом не удерживаются, а затем происходит элюирование (смывка) целевого компонента.
При проведении неудерживающей ТФЭ на сорбенте сразу оседают мешающие примеси, а целевой компонент проходит через колонку, не удерживаясь. Т.о. достигается его очистка от мешающих примесей.
Примись+токсикан. Исп-ют эксперемент со стандартами
Часто для заполнения патронов исп-ют сорбенты на основе силикагеля. В практике ХТА находят широкое применение отечественные патроны фильмы (Диапак), заполненные немодифицированным силикагелем и хим-ки модифицированным силикагелем. Для модиф-ии силикагеля исп-ют в-ва, содерж-ие различные функциональные группы (нитрильные, амино-, карбокси-, сульфогруппы), а так же алифатические (С1-С18) и ароматические (фенильные гр.).
Преимущества сорбентов на основе силикагеля:
высокая интенсивность процессов сорбции-десорбции;
постоянство их объема при контакте с орг-ми и водно-солевыми растворами;
не требуют длительного предварительного набухания;
хим-ая стабильность модифицированных силикагелей.
В зависимости от вида сорбента мех-м разделения на патроне для ТФЭ различен. Процесс очистки состоит из:
Активация. ч/з патрон пропускают этанол или метанол.
Кондиционирования патрона. Пропускают буфер кислотного или основного характера
Сорбция. Пропускание через патрон р-ра исследуемого объекта в матрице с целью разделения, выделения и концентрирования целевых компонентов.
Десорбция. Осушение сорбента воздухом.
Элюирование сорбированных компонентов. Вымывание
18 . Как проводится ТФЭ с использованием патронов Дипак?
Пропускание всех растворов через патрон проводится самотеком в одном направлении- сверху вниз.
Активация- приведение патрона в рабочее состояние , промывают этиловм спиртом. Скорость пропускания 2,5 мл/ мин.
Кондиционирование- пропускание буферного раствора ( ацетатного) 10 мл
Сорбция-пропускание исследуемого раствора через патрон. Объем 100 мл
Десорбция- удаление исследуемого вещества с сорбента с помощью воздуха шприцем
Элюирование образца осуществляется реагентом., который применялся на стадии активации. 100 мл. Ввводят его порциями задерживая в патроне первую для установления равновесия в системе.
19. как осуществляется качественный и количественный анализ методом тсх?
Качественный анализ . основной качественной характеристикой вещ-ва в тсх является значение относительная скорость перемещения компонента в тонком слое : R= L х/ L S где L х - длина пробега центра хроматографической зоны исследуемого соединения, L S - длина пробега фронта растворителя. R всегда больше и зависит от природы носителя, толщины слоя, качества и природы растворителей, их соотношения, способы наненисения пробы, детектирование . Для снижения влияния всех факторов используют относительную величину R R= R/ R1 , где R – иследумого вещ-ва, R 1 –значение стандарта- метчика.
Количественный анализ . При анализе пятен предполагают что существует связь между площадью пятен и содержанием исследуемого вещ-ва, которую устанавливают путем построения градуировочного графика, измеряя площади пятен, иногда сравнивают интенсивность окраски пятен
20.Каковы особенности проведения ненправленного анализа лек вещ-в методом тсх? Приведите схему тсх скрининга.
Скрининг – система методических приемов, позволяющих выбрать научно-обоснованную последовательность операций, в результате кот-го поэтапно «отсеиваются» группы соединений и отдельные в-ва.
Скрининг исп-ся для анализа многокомпонентных смесей, а также при ненаправленном анализе. Скрининговые тесты имеющие невысокую специфичность, позволяют в мин-ое время из большого кол-ва токсикантов выявить 1 или несколько в-в, для подтверждения обнаружения кот-го проводится целенаправленное исследование.
Из ЛВ, имеющих определенное токсикологическое значение, в извлечениях из кислого р-ра могут быть: 1)производные барбитурой кислоты; 2) пирозолона; 3) 1,4-бензодиазепина; 4) кофеин.
В извлечениях из щелочного раствора: алкалоиды и синтетические в-ва основного хар-ра.
При проведение ненаправленного анализа пробу делят на 2 части и наносят на пластинки вместе с соответствующими свидетелями. Проявляют пластинку групповыми реагентами.
ТСХ-скрининг в анализе в-в кислотного и слабоосновного хар-ра экстрагируемых хлороформом из кислого раствора (рН=2-2,5)
Пластинку помещают в общую систему растворителей: хлороформ-диоксан-ацетон-25% р-р аммиака (45:47,5:5:2,5)
Когда растворитель поднимается на высоту 10 см, пластинку вынимают, высушивают и обрабатывают реагентами в след-ей послед-ти:
- 0,5% р-р HgSO4 в H2SO4 и 0,1% ДФК в хлороформе. Обнаруж-ся производные барбитуровой к-ты в виде фиолетовых пятен.
- 10% р-р FeCl3. Производные пиразолона.
- модифицированные реактив Драгендорфа. Опред-ют соед-ия пиразолона, 1,4-бензодиазепина, кофеина (т.е. соединение сод-ие в своей структуре вторичный и третичный атом азота).
- 10% р-р H2SO4. Для повышения чувствительности реактива Драгендорфа.
Если ни в одной из зон не проявилось ни одного пятна, то делают заключение о ненахождении в-в в извлечении кислого раствора.
ТСХ-скрининг в анализе в-в основного хар-ра, экстрагируемых хлороформом из щелочного р-ра (рН=8-10)
Пластинку помещают в общую систему растворителей: хлороформ-диоксан-ацетон-25% р-р аммиака (45:47,5:5:2,5)
Когда растворитель поднимается на высоту 10 см, пластинку вынимают, высушивают и обрабатывают реагентами в след-ей послед-ти:
- 10% FeCl3. Произв-е пиразолона и фенотиазина.
- 10% р-р H2SO4 в этаноле. Произв-е фенотианзина.
-10% H2SO4 и УФ-свет. Обнаруживается хинин.
- модицифированный р-в Драгендорфа. Соединения в структуре которых имеется третичный атом азота.
- 10% H2SO4. Для повышения чувствительности и усиления окраски пятен с реактивом Драгендорфа.
Если ни в одной из зон не проявилось ни одного пятна, то делают заключение о ненахождении в-в в извлечении щелочного раствора.
