
ОБЩИЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ В ТКАНЯХ
.pdfТема: «ОБЩИЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ В ТКАНЯХ»
Цель занятия: изучить превращения аминокислот в организме человека. Усвоить значение этих процессов. Использовать приобретенные знания при изучении других разделов биохимии.
План
1.Аминокислоты: классификация (заменимые и незаменимые), биологическая роль. Пути образования и использования фонда аминокислот в организме.
2.Классификация путей обмена аминокислот: общие (по амино- и карбоксильной группам) и специфические.
3.Реакции АК по аминогруппе - трансаминирование: характеристика, роль, субстраты, ферменты, кофермент. Роль витамина В6. Использование аминотрансфераз в энзимодиагностике.
4.ДезаминированиеАК:характеристикапроцесса,типы(прямоеинепрямое), значение.
5.Прямое окислительное дезаминирование глутаминовой кислоты: ферменты, кофермент, значение.
6.Прямое неокислительное дезаминирование аминокислот (цис, сер, тре, гис): субстраты, ферменты, коферменты.
7.Непрямое окислительное дезаминирование аминокислот: субстраты, стадии, ферменты, коферменты, значение.
8.Реакции АК по карбоксильной группе – декарбоксилирование: схема, ферменты, коферменты, значение.
9.Декарбоксилирование АК (глу, гис, три): биологическая роль продуктов
реакции.
10.Биогенные амины: классификация (гормоны, нейромедиаторы, местные регуляторы), пути их обезвреживания.
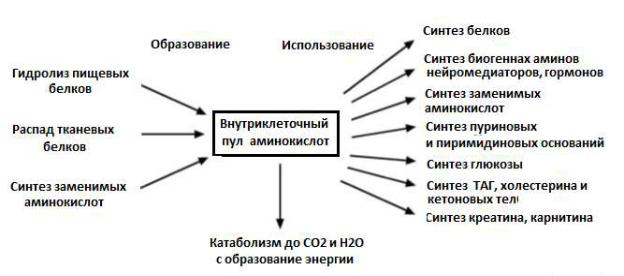
По способности синтеза в организме различают заменимые и незаменимые аминокислоты.
Заменимые аминокислоты – синтезируются в необходимых количествах в организме: Ала, Асп, Асн, Глу, Глн, Гли, Про, Сер.
Незаменимые аминокислоты – не могут синтезироваться в необходимом количестве в организме и должны поступать с пищей: Вал, Лей, Иле, Мет,
Фен, Три, Лиз, Тре. Частично заменимые аминокислоты –
синтезируются очень медленно и в количествах, не покрывающих потребностиорганизма и особенно в детском возрасте: Гис и Арг. Условно заменимые аминокислотысинтезируются из незаменимых аминокислот Мет и Фен соответственно:Цис и Тир.
Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. Путь дальнейшего превращения аминокислот зависит от вида и функционального состояния клетки.
Рис.12 Пути образования пула аминокислот в крови и его использование в организме.
Аминокислоты в норме не резервируются (как глюкоза или жирные кислоты). Редко аминокислоты используются для энергетических целей как топливные молекулы. Аминокислоты, не использованные для биосинтетических процессов, подвергаются катаболизму, а из углеродных
цепей аминокислот синтезируются вещества, способные резервировать энергию – глюкоза (гликоген) и липиды.
Реакции превращения аминокислот в клетке условно делят на три части, в зависимости от реагирующей группы:
с участием аминогруппы (трансаминирование и дезаминирование)
с участием карбоксильной группы (декарбоксилирование)
по радикалу
Аминокислоты являются бифункциональными соединениями, содержащими амино- и карбоксильную группы. Реакции по этим группам являются общими для различных аминокислот, а реакции по радикалу являются специфичными для каждой аминокислоты.
Трансаминирование
Трансаминирование (переаминирование) – реакции межмолекулярного переноса аминогруппы от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Этот процесс открыт в 1937 году Е. А. Браунштейном и М. Г. Крицман.
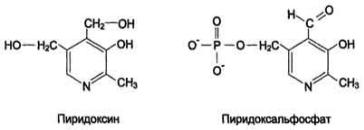
Реакции трансаминирования являются обратимыми и универсальными для всех живых организмом, протекают при участии специфических ферментов аминотрансфераз,кофермент–пиридоксальфосфат(активнаяформавитамина В6.
Локализация в цитозоле и митохондриях многих клеток, но наиболее активно в печени, скелетных мышцах, миокарде, головном мозге.
Механизм реакции трансаминирования достаточно сложен. Перенос аминогруппы совершается в две стадии. На первой стадии аминокислота передает аминогруппу пиридоксальфосфату и превращается в кетокислоту.
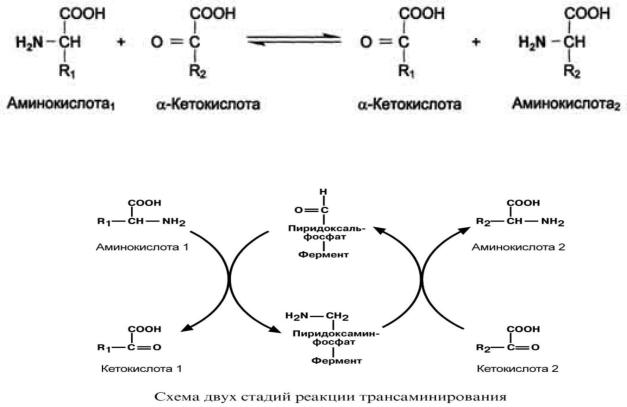
Пиридоксальфосфат, забрав аминогруппу, пиридоксаминфосфат и на второй стадии отдает второму участнику – кетокислоте, превращая пиридоксальфосфат регенерирует.
Реакция трансаминирования: в общем виде:
превращается в приобретенную группу ее в аминокислоту, а
- в виде схемы:
Рис. 13
Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина. Основными донорами аминогрупп в реакциях трансаминирования являюся глутамат, аланин и аспартат. Универсальным акцептором аминогруппы – α-кетоглутарат.
В медицине нашло практическое применение определение активности двух аминотрансфераз – аланинаминотрансферазы (АлАТ) и аспартатаминтрансферазы (АсАТ).
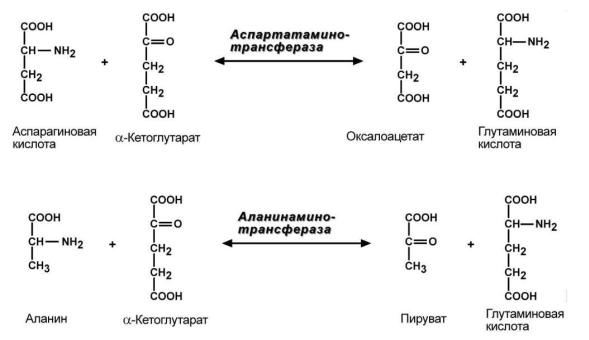
В норме активность этих ферментов в клетках превышает активность в сыворотке крови. При повреждениях тканей, они секретируются в кровь. В клинической практике определение активности АлАТ и АсАТ используется для дифференциальной диагностики болезней печени и миокарда, определения глубины поражения и контроля эффективности лечения. При поражении сердца преимущественно повышается активность сывороточной АсАТ, а при повреждениях гепатоцитов - АлАТ. В норме соотношение активностей АсАТ/АлАТ (коэффициент де Ритиса) составляет 1,33±0,42. При инфарктемиокардавеличинаэтогокоэффициентарезко возрастает,убольных инфекционным гепатитом, напротив, происходит снижение этого показателя.
Значение реакций трансаминирования.
Трансаминирование является первым этапом и основным путем метаболизма аминокислот. Трансаминирование происходит при катаболизме и анаболизме аминокислот и является пунктом "переключения" метаболических превращений. Направление превращений зависит от скорости поступления субстратов в клетку и скорости удаления продуктов реакции. Поэтому трансаминирование может обеспечить образование тех аминокислот, содержание которых в клетке недостаточно, за счет имеющихся в избытке. Замещение кетогруппы в α-кетокислоте на аминогруппу, обычно,
представляет собой конечную стадию синтеза аминокислот. Наоборот, замещение аминогруппы на кетогруппу - первая стадия катаболизма аминокислот.
Таким образом, реакции трансаминирования:
обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
являются первой стадией непрямого окислительного дезаминирования аминокислот и дальнейшего катаболизма их безазотистого остатка.
вызывают перераспределение аминного азота в тканях и органах. Функциональное значение реакций трансаминирования в различных органах различно. Например, работающая мышца выделяет в кровь наряду с молочной
кислотой – аланин, который образуется в мышцах из ПВК путем трансаминирования. Из кровотока аланин поглощается печенью, где превращается в пируват, который используется для глюконеогенеза (глюкозоаланиновый цикл). Этим путем осуществляется перенос в печень не только пирувата, но и азота, используемого для биосинтеза мочевины.
Реакции дезаминирования аминокислот.
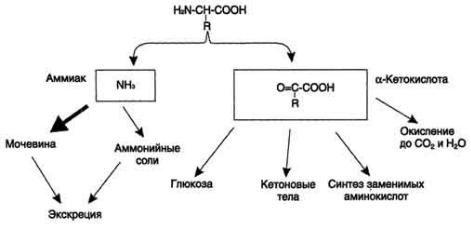
Дезаминирование – процесс удаления α-аминогруппы из аминокислот и выделение ее в виде аммиака. При дезаминировании в отличие от трансаминирования общее количество аминокислот уменьшается.
Рис. 14 Судьба продуктов дезаминирования аминокислот.
Значение дезаминирования состоит в выделении аммиака, который используетсядлясинтезамочевины,образованииα-кетокислот,используемых
для различных метаболических процессови окислении до углекислотыи воды с образованием энергии.
Существует несколько видов дезаминирования:
Окислительное (прямое– характерно только для глутаминовой кислоты и непрямое – характерно для остальных аминокислот)
Неокислительное – характерно для серина, треонина, цистеина и гистидина;
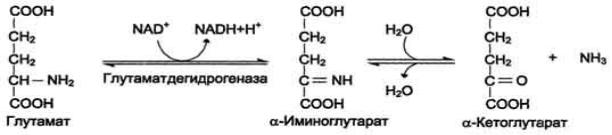
Прямое окислительное дезаминирование
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты:
Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных) и катализирует реакцию дезаминирования глутамата. Кофермент этого фермента является НАД+. Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии при помощи АДФ и ингибируется избытком АТФ и НАДН. Фермент глутаматдегидрогеназа играет ключевую роль во взаимосвязи метаболизма аминокислот и общего пути катаболизма. Это аллостерический олигомерный фермент с мол. массой 312000 Да, состоящий из 6 субъединиц по 52000 Да каждая.
Непрямое окислительное дезаминирование
Самое распространенное в организме – непрямое окислительное дезаминирование, а точнее трансдезаминирование, которое проходят все аминокислоты на стадии катаболического превращения. Процесс идет в два этапа:
1) в результате реакций трансаминирования аминные группы собираются в составе глутаминовой кислоты. В качестве кетокислоты-
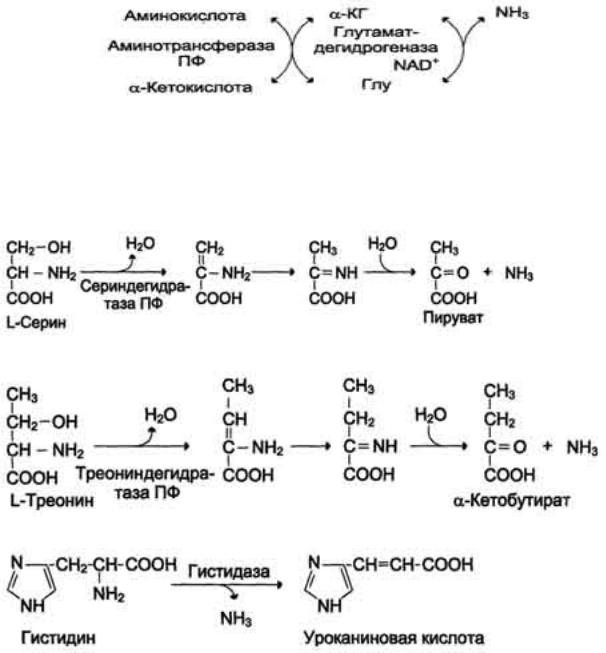
акцептора в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат.
2) глутамат поступает в митохондрии, где подвергается прямому дезаминированию в глутаматдегидрогеназной реакции. α-кетоглутарат, образующийся при дезаминировании глутаминовой кислоты, используется в ЦТК или для синтеза глюкозы.
Рис. 15. Непрямое окислительное дезаминирование.
Дезаминирование серина и треонина происходит с отщеплением воды под действием серин- и треониндегидратазы. Из серина образуются пируват и аммиак, а из треонина α–кетобутират и NH3.
Цистеин дезаминируется с выделением Н2S и использованием воды. Внутримолекулярное дезаминирование гистидина до уроканиновой кислоты катализирует гистидаза (лиаза). Оно относится к внутримолекулярным,
поскольку аммиак отщепляется от молекулы без участия воды. Эта реакция происходит только в печени и коже.
Превращения аминокислот по радикалу. Пути использования безазотистого остатка аминокислот.
Углеродные скелеты 20 белковых аминокислот превращаются в итоге в семь различных продуктов деградации. Пять метаболитов (α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат и пируват) служат предшественниками глюкозы в процессе глюконеогенеза. Первые четыре являются еще и промежуточными продуктами цитратного цикла, в то время как пируват может быть переведен пируватдекарбоксилазой в оксалоацетат и тем самым стать участником глюконеогенеза. Аминокислоты, при распаде которых образуются пируват и метаболиты ЦТК, называются гликогенными аминокислотами. За двумя исключениями (лизин и лейцин) гликогенными являются все белковые аминокислоты. Ацетоацетат и ацетил-КоА не могут
включаться в глюконеогенез в организме животных, поэтому |
используются |
для синтеза кетоновых тел, жирных кислот и изопреноидов. |
Аминокислоты, |
которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел называют
кетогенными.
Фактически кетогенными являются только лейцин и лизин.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или
гликокетогенными.
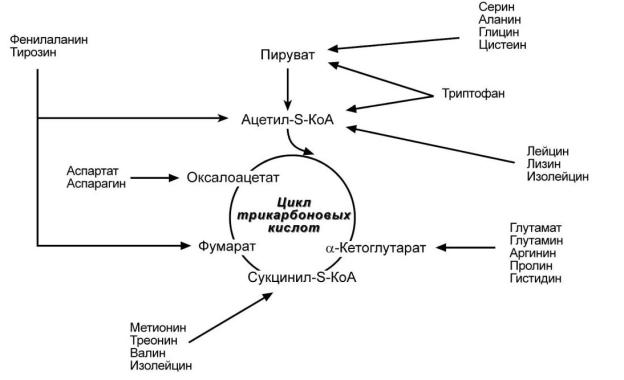
Рис. 16 Судьба углеродного скелета аминокислот.
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. Можно выделить пять анаплеротических реакций:
1. 
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат Превращение происходит во многих тканях под действием
глутаматдегидрогеназы или аминотрансфераз.
3. 
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода
4.Аминокислоты → Фумарат
5.Аминокислоты → Оксалоацетат
