
Переваривание белков в ЖКТ. «Гниение» белков в кишечнике
.pdfТема: «Переваривание белков в ЖКТ. «Гниение» белков в
кишечнике»
Цель занятия: изучить закономерности и особенности переваривания
белков в различных отделах желудочно-кишечного тракта.
План:
1.Белковое питание: полноценные и неполноценные белки, заменимые
инезаменимые аминокислоты. Азотистый баланс. Роль белков в организме человека.
2.Полостное переваривание в желудке: пепсин, его характеристика и активация, специфичность действия. Механизм образования и роль соляной кислоты.
3.Полостное переваривание в двенадцатиперстной кишке: ферменты,
их активация, специфичность действия.
4.Пристеночное переваривание и всасывание аминокислот в тонком кишечнике.
5.Общая схема переваривания белков в ЖКТ. Особенности переваривания белков у детей.
6.Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения белков в печени. Роль УДФГК и ФАФС.
7.Регуляция процесса переваривания.
Белки – это главная составная часть живых организмов и материальная
основа процессов жизнедеятельности.
Белки в организме человека выполняют следующие функции:
•каталитическую (ферменты);
•структурную (коллаген, эластин, кератин);
•сократительную (актин, миозин);
•защитную (иммуноглобулины, белки системы комплемента);
•транспортную (гемоглобин, альбумины, глобулины);
•регуляторную (гормоны, рецепторы);
•буферную (гемоглобин, белки сыворотки крови);
•энергетическую;
•принимают участие в создании онкотического давления (белки сыворотки крови).
В организме человека массой 70 кг содержится примерно 15 кг белка,
причем большая его часть локализована в мышцах. Количество свободных аминокислот составляет около 35 гр. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Ежесуточно в организме распадается до аминокислот почти 400 гр. белков и столько же синтезируется. Обновление белков в организме происходит с разной скоростью, большинство из них полностью обмениваются примерно за 35 дней. Основным источником аминокислот для человека являются пищевые белки. Суточная норма потребления белков составляет в среднем около 100 гр.
Об общем состоянии белкового обмена в организме судят по азотистому балансу.
Азотистый баланс – разница между количеством азота, поступившего с пищей и количеством выделяемого азота почками (в основном в виде мочевины и аммонийных солей).
У взрослого человека при нормальном питании имеет место азотистое равновесие, т.е. количество поступившего азота равно количеству выделенного.
Азотистый баланс может быть положительным и отрицательным.
Положительный азотистый баланс (азота поступает больше, чем выводится) наблюдается у здоровых детей, при нормальной беременности,
выздоравливающих больных, спортсменов, т.е. в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках.
Отрицательный азотистый баланс (выделяется азота больше, чем его поступает) наблюдается при старении, голодании, во время тяжёлых заболеваний и при безбелковой диете.
По биологической ценности различают полноценные и неполноценные белки.
Питательная ценность белка зависит от его аминокислотного состава и
способности усваиваться в организме.
По способности синтеза в организме различают заменимые и незаменимые аминокислоты.
Заменимые аминокислоты – синтезируются в необходимых количествах в организме: Ала, Асп, Асн, Глу, Глн, Гли, Про, Сер.
Незаменимые аминокислоты – не могут синтезироваться в необходимом количестве в организме и должны поступать с пищей: Вал, Лей, Иле, Мет,
Фен, Три, Лиз, Тре.
Частично заменимые аминокислоты – синтезируются очень медленно и в количествах, не покрывающих потребности организма и особенно в детском возрасте: Гис и Арг.
Условно заменимые аминокислоты – синтезируются из незаменимых аминокислот Мет и Фен соответственно: Цис и Тир.
Полноценные белки содержат полный набор незаменимых аминокислот в количестве более 32 % (от общего количества аминокислот) и
в оптимальных соотношениях. Неполноценные белки содержат неполный набор незаменимых аминокислот или в недостаточном количестве.
Отсутствие в белке даже одной незаменимой аминокислоты ведет к неполноценному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением и нарушением функции нервной системы. К полноценным белкам относят белки животного происхождения. К идеальному белку, сбалансированному по аминокислотному составу, относят белок куриного яйца и грудного женского молока. Неполноценными считают белки растительного происхождения.
Общая характеристика переваривания белков в ЖКТ
При переваривании белков происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонком кишечнике под действием пептидгидролаз
(пептидаз).
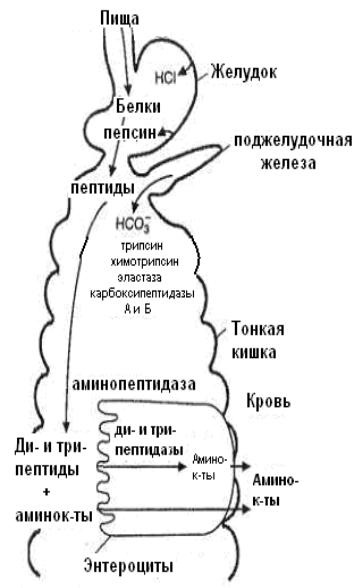
В желудке белки пищи денатурируются и гидролизуются до высокомолекулярных пептидов.
В кишечнике панкреатические пептидазы продолжают гидролиз высокомолекулярных пептидов до олиго- три-,
дипептидов и свободных аминокислот.
Короткие пептиды расщепляются до свободных аминокислот в процессе пристеночного пищеварения в клетках
кишечного эпителия.
Рис.1. Схема переваривания белков в ЖКТ
Затем происходит их всасывание и транспорт в кровеносное русло.
Характеристика протеолитических ферментов ЖКТ
Протеолитические ферменты ЖКТ относят к классу гидролаз и обладают относительной субстратной специфичностью. Основные пептидазы синтезируются в клетках желудка, поджелудочной железы и кишечника. В
зависимости от места гидролиза пептидной связи в полипептидной цепи белка все пептидазы делятся на эндопептидазы и экзопептидазы.
Экзопептидазы (карбоксипептидазы А и В, аминопептидазы)
отщепляют концевые N- и C-аминокислоты. Эндопептидазы (пепсин,
трипсин, химотрипсин, эластаза) расщепляют внутренние пептидные связи.
Желудочные и панкреатические пептидазы вырабатываются в неактивной форме в виде проферментов, активируются за счёт ковалентной модификации путём частичного протеолиза. Место синтеза проферментов и место их активации пространственно разделены (синтез протекает в клетках,
а активация - в просвете ЖКТ). Такой механизм образования активных форм ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания. Частичный протеолиз лежит в основе активации пепсина, трипсина, химотрипсина, эластазы,
карбоксипептидаз А и В. Ферменты эпителия кишечника (аминопептидаза,
ди- и трипептидазы) синтезируются сразу в активной форме.
Переваривание белков в желудке
В желудке пища подвергается воздействию желудочного сока,
включающего соляную кислоту и ферменты. Значение рН желудочного сока
1,5-2,0. Слизистая оболочка желудка вырабатывает соляную кислоту и пепсиноген. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+ и
переносящие ионы Сl– из крови в полость, желудка.
Источником Н+ для HCl является Н2СО3, которая образуется в обкладочных клетках желудка из СО2 и Н2О под действием карбоангидразы:
Н2СО3 диссоциирует на бикарбонат, который выделяется в плазму крови в обмен на С1-, и Н+, который активно переносится Н+/К+-АТФ-азой в просвет желудка в обмен на К+. При этом в просвете желудка концентрация Н+
увеличивается ≈ в 100 раз, а значения рН снижается до 1,0-2,0. Синтез HCl -
аэробный процесс, требующий большого количества АТФ, поэтому при гипоксии он снижается (рис 2).
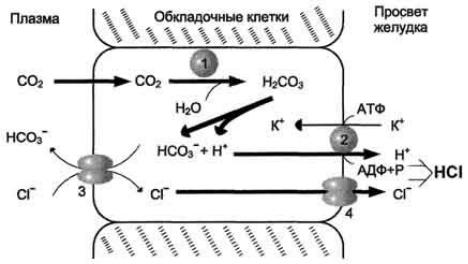
Рис.2. Механизм образования и секреции НСl
Вода выходит из клеток в просвет желудка по осмотическому
градиенту.
Функции соляной кислоты:
•активирует пепсиноген;
•участвует в создании оптимума рН для действия пепсина;
•оказывает бактерицидное действие;
•денатурирует белки пищи;
•способствует всасыванию железа;
•вызывает секрецию секретина в двенадцатиперстной кишке.
Пепсин синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр "прикрыт" N-
концевым фрагментом полипептидной цепи.
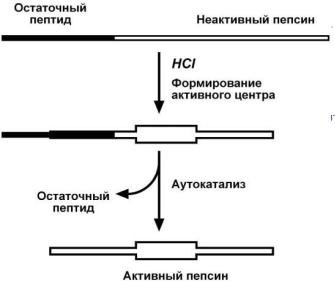
При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что
"раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), блокирую-
Рис. 3. Схема активации пепсиногена щий активный центр
фермента, т.е.
происходит аутокатализ
(рис. 3).
В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Продуктами переваривания белков в желудке являются высокомолекулярные пептиды.
Оптимум рН для пепсина 1,5-2,0. Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные амино-
группами ароматических аминокислот (тирозина, фенилаланина,
триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты.
Соляная кислота и пепсин способны разрушать клетки эпителия желудка. В норме это не происходит благодаря наличию защитных факторов слизистой оболочки:
•образованию на поверхности слизи, содержащей гетерополисахариды, которые не являются субстратами пептидаз;
•секреции эпителиальными клетками ионов НСО3-, создающих в пристеночном слое менее агрессивную среду с рН 5,0-6,0, в которой пепсин неактивен;
• быстрой регенерации клеток поврежденного эпителия.
Желудочный сок кроме соляной кислоты содержит и другие кислые продукты, а при патологии – молочную кислоту и летучие жирные кислоты.
Поэтому определение кислотности желудочного сока используют для диагностики заболеваний желудка.
Кислотность желудочного сока выражается в титрационных единицах
(ТЕ) – количество 0,1 м (моль) NaOH в 1 мл, затраченное на титрование 100
мл желудочного сока.
Различают следующие виды кислотности:
•общая кислотность – совокупность всех кислото-реагирующих веществ желудочного сока, собираемых в течение 1 часа. Значение общей кислотности в норме составляет 40-60 ТЕ;
•связанная соляная кислота – связанная HCl с белками и продуктами их переваривания у здоровых людей 20-30 ТЕ;
•свободная HCl соляная кислота, не связанная с компонентами желудочного сока в норме 20-40 ТЕ.
Полостное переваривание белков в кишечнике
Желудочное содержимое (химус) в процессе переваривания поступает в 12-кишку, где при рН=7,5-8,0 под действием панкреатических ферментов до низкомолекулярных пептидов, ди-, три-пептидов и свободных аминокислот. Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу.
Проферменты в просвете кишечника активируются до трипсина,
химотрипсина, карбоксипептидаз и эластазы, соответственно. Указанные ферменты осуществляют основную работу по перевариванию белков.
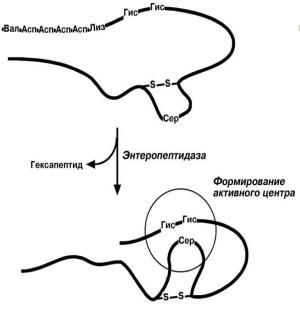
|
Выделяемый pancreas трипсиноген |
||||
|
в |
двенадцатиперстной |
кишке |
||
|
подвергается |
|
частичному |
||
|
протеолизу |
под |
действием |
||
|
фермента |
энтеропептидазы |
|||
|
(другое название - энтерокиназа), |
||||
|
секретируемой |
|
клетками |
||
|
кишечного |
эпителия. |
От |
||
|
профермента |
|
отделяется |
||
|
гексапептид, |
что |
приводит к |
||
Рис. 4. Механизм активации трипсиногена |
формированию |
его |
активного |
||
|
центра. |
|
|
|
|
Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока:
химотрипсиноген, проэластазу, прокарбоксипептидазу.
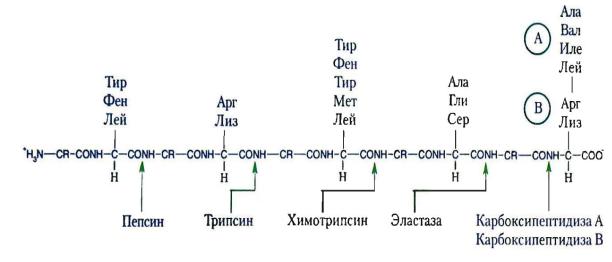
Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина.
Химотрипсин специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана, т.е.
так же, как пепсин.
Эластаза гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В.
Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Пристеночное переваривание в кишечнике
Последний этап переваривания происходит в пристеночном слое
кишечника под действием |
ферментов аминопептидаз, ди- и трипептидаз, |
||
которые синтезируются клетками кишечного эпителия в активной форме. |
|||
Аминопептидазы |
последовательно |
отщепляют |
N-концевые |
аминокислоты пептидной цепи. Дипептидазы, трипептидазы расщепляют
ди-и трипептиды на свободные аминокислоты.
Рис. 5. Специфичность действия протеолитических ферментов ЖКТ
В результате последовательных действий всех пищеварительных протеаз большинство пищевых белков в ЖКТ расщепляется до свободных аминокислот, которые поступают в кровеносное русло и разносятся во все органы и ткани организма.
Существуют 2 основных механизма переноса аминокислот: симпорт с ионами натрия и γ-глутамильный цикл.
Аминокислота поступает в энтероцит путём симпорта с ионом Na+.
Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-
активного транспорта с помощью Na+, К+-АТФ-азы (рис. 6).
