
БИОХИМИЯ СКЕЛЕТНЫХ МЫШЦ
.pdfБИОХИМИЯ СКЕЛЕТНЫХ МЫШЦ
Вопросы
1.Классификация видов мышечной ткани. Особенности химического состава и функций.
2.Сократительные и регуляторные белки миофибрилл.
3.Биохимические механизмы мышечного сокращения и расслабления скелетных. гладких мышц и миокарда.
4.Особенности обмена веществ в скелетных мышцах.
5.Пути ресинтеза АТФ в мышцах.
6.Заболевания мышц
Классификация видов мышечной ткани. Особенности химического
состава и функций.
Мышечная ткань составляет 40% от веса тела человека. Биохимические процессы, протекающие в мышцах, оказывают большое влияние на весь организм.
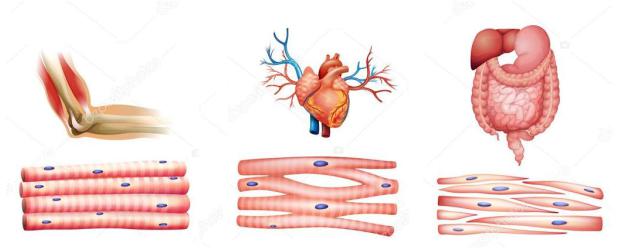
Строение мышечной ткани представлено на рисунке 1.
Функции мышц – в основном направлены на формирование механического движения, в котором химическая энергия превращается в механическую при постоянном давлении и постоянной температуре.

Кфункциям мышц относятся:
•Передвижение тела в пространстве
•Перемещение частей тела относительно друг друга
•Поддержание позы
•Обеспечение работы сердечно-сосудистой, дыхательной, моче-
•половой, желудочно-кишечной систем
•Выработка тепла
•Механическая защита внутренних органов
•Депо аминокислот, так как содержат много белков
•Депо воды и солей
Основные виды мышечной ткани
•Поперечнополосатая
•Сердечная
•Гладкая
Для каждого вида характерны свои мышечные волокна и функции:
Скелетные мышцы |
|
Миокард |
|
Гладкие |
|
|
|
|
|
|
|
▪ |
Сокращаются |
▪ |
Сокращаются |
▪ |
Сокращаются |
|
произвольно |
|
непроизвольно |
|
непроизвольно |
▪ |
Движение |
▪ |
Работа сердца и |
▪ |
Работа |
▪ |
Поддержание позы |
|
обеспечение |
|
внутренних |
▪ |
Терморегуляторная |
|
кровообращения |
|
органов |
|
|
|
|
▪ |
Тонус сосудов |
|
|
|
|
|
|
Строение мышечного волокна
Мышечное волокно состоит из клеток, окруженных электровозбудимой мембраной — сарколеммой, которая, как и любая другая мембрана, имеет липопротеиновую природу (толщина бимолекулярного слоя около 10 нм).
Сарколемма отгораживает внутреннее содержимое мышечного волокна от межклеточной жидкости. Подобно другим мембранам сарколемма имеет избирательную проницаемость для различных веществ. Через нее не проходят высокомолекулярные вещества (белки, полисахариды и др.), но проходят глюкоза, молочная и пировиноградная кислоты, кетоновые тела,
аминокислоты и короткие пептиды. Перенос через сарколемму имеет активный характер (осуществляется с помощью переносчиков), что позволяет накапливать внутри клетки некоторые вещества, в том числе ионы, в большей концентрации, чем снаружи. Это приводит к возникновению мембранного

потенциала, который в состоянии покоя мышечного волокна равен90–100 мВ и является необходимым условием возникновения и про ведения возбуждения.
Внутриклеточная жидкость — саркоплазма
В саркоплазме локализованы органические вещества, минеральные соли, а также субклеточные частицы: ядра, митохондрии, рибосомы,
лизосомы, функция которых заключается в регуляции обмена веществ в мышечном волокне путем воздействия на синтез специфических мышечных белков. Число митохондрий в мышечном волокне очень велико, и
располагаются они цепочками вдоль миофибрилл, тесно прилегая к мембранам ретикулума.
Внутри саркоплазмы находится система продольных и поперечных трубочек, мембран, пузырьков — саркоплазматический ретикулум.
Толщина мембран саркоплазматического ретикулума около 6 нм.
Саркоплазматический ретикулум делит саркоплазму на отдельные отсеки, в
которых протекают различные биохимические процессы. Пузырьки и трубочки оплетают каждую миофибриллу. Через трубочки,связанные с наружной клеточной мембраной, возможен прямой обмен веществами между клеточными органеллами и межклеточной жидкостью. Трубочки, в частности Т-трубочки, могут служить и для распространения волны возбуждения от
наружной мембраны волокна к внутренним его зонам, к везикулам и цистернам саркоплазматического ретикулума. Мембраны пузырьков,
прилегающих к миофибриллам, содержат белки (в частности,
кальсеквестрин), связывающие катионы Са2+.
Химический состав мышечной ткани
• Вода 75–77%
• Белки 20%
Белки миофибрилл |
Белки саркоплазмы |
Белки стромы |
|
|
|
Миозин |
Миоглобин |
Коллаген |
Актин |
Кальмодулин |
Эластин |
Тропомиозин |
Миогенная фракция: |
|
Тропонины |
альбуминов, |
|
|
глобулинов |
|
|
Ферменты гликолиза |
|
|
ЦТК, ЦПЭ и др. |
|
|
|
|
•Липиды 1–3%
Вмышечной ткани из липидов преобладают фосфолипиды и холестерин. Миокард по сравнению с другими мышечными тканями богаче фосфолипидами.
•Углеводы 0,5–3,0%
Основным углеводом мышечной ткани является гликоген (0,3-3,0%).
Также в мышечной ткани присутствуют ГАГ, моносахариды глюкоза,
фруктоза и т.д.
• Экстрактивные вещества 1,5–2,0%
oмного креатинфосфата и креатина (до 60% небелкового азота мышц), мало креатинина;
oмного адениновых нуклеотидов АТФ, АДФ и АМФ (АТФ 4,43
мкмоль/г, АДФ
o мало нуклеотидов неаденинового ряда ГТФ, УТФ, ЦТФ и др.
o имидазолсодержащие дипептиды – карнозин и ансерин.

oсвободные аминокислоты (много глутамина, аланина) и др.
•Минеральные соли 1% (макро- и микроэлементы)
Белки миофибрилл
Сократительные |
Регуляторные |
Соединительные |
|
|
(добавочные) белки |
|
|
|
Актин |
Тропомиозин: |
Титин, α-актинин, |
Миозин |
Тропонины |
десмин, миомизин, |
: |
(C, I,Т) |
небулин и др |
|
|
|
Актин — небольшой глобулярный белок, его молекулярная масса 42 кД.
G-актин представляет собой глобулу. В физиологических условиях его молекулы способны к спонтанной агрегации с образованием F-актина. В
состав тонкой нити входят две F-актиновые нити, образуется суперспираль
(две перекрученные нити). В области Z-линий актин прикрепляется к α--
актинину.
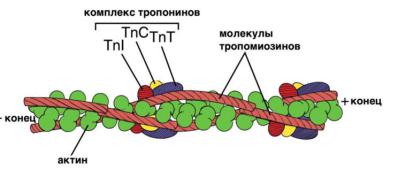
Тропомиозин — фибриллярный белок молекулярной массой 70
кД. Имеет вид спирали. В тонкой нити на 1 молекулу тропомиозина приходится 7 молекул Gактина. Располагается тропомиозин в желобке между двумя спиралями G-актина. Соединяется тропомиозин “конец вконец”, цепочка непрерывная. Молекула тропомиозина закрывает активные центры связывания актина на поверхности глобул актина.
Тропонин — глобулярный белок молекулярной массой 80 кД,
имеет 3 субъединицы: тропонин Т, тропонин С и тропонин I.
Функции субъединиц тропонина
Тропонин Т (ТнТ) — отвечает за связывание тропонина с тропомиозином, через ТнТ конформационные изменения тропонина передаются на тропомиозин.
Тропонин С (ТнС) — Ca2+связывающая субъединица, содержит
4 участка для связывания кальция, по строению похожа на белок кальмодулин.
Тропонин I (ТнI) — ингибиторная субъединица — это ненастоящий ингибитор, он только создает пространственное препятст вие, мешающее взаимодействию актина и миозина в момент, когда ТнС не связан с Са2+.
Тропонин располагается на тропомиозине с равными промежутками, длина которых равна длине молекулы тропомиозина.
Таким образом формируется тонкая нить — тонкий филамент.
Миозин — крупный олигомерный белок молекулярной массой 500 кД.
состоит из 6 субъединиц, попарно одинаковых. При гидролизе трипсином миозин распадается на легкий меромиозин (ЛММ) и тяжелый меромиозин (ТММ).
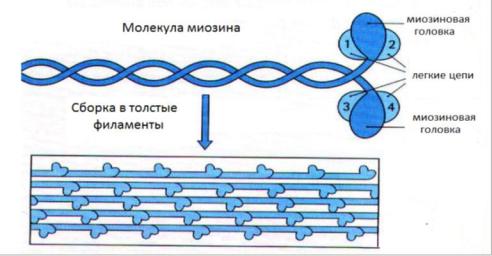
Тяжелая цепь: на С-конце — α- спираль, на N-конце — глобула
(головка). При соединении двух тяжелых цепей С-концевыми участками образуется суперспираль. Две легкие цепи входят в состав глобулы (головки). Стержневой участок суперспирали имеет два отдела, где спирали оголены — эти места открыты для действия протеолитических ферментов и имеют повышенную подвижность.
Свойства миозина
В физиологических условиях (оптимальные pH, температура,
концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками (“конец-в-конец”, “бок-в- бок”) с помощью слабых типов связей. Взаимодействуют только стержни, головки остаются свободными
Молекула миозина обладает ферментативной активностью (АТФ-азная активность: АТФ +Н2О→АДФ+Ф). Активные центры расположены на головках миозина
Толстые нити образованы белком миозином
Тонкие нити образованы актином,тропомиозином и тропонином

Структурная единица миофибриллы – саркомер.
Оба конца толстых миозиновых ниток свободны Тонкие нити одним концом прикреплены к Z-пластинкам
Темный участок –диск А (анизотропная зона), он образован
«толстыми» нитями миозина. Его размер постоянен.
Светлый участок диск I (изотропная зона), он образован «тонкими» нитями актина. Размер диска I уменьшается при сокращении мышцы
Центральная область диска А называется зона Н. В зоне Н нет
«тонких» нитей актина, в отличие от более темной части, которая образована и
«толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении
мышцы
Полоса М пересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину
150 нм, в не заходят «тонкие» нити актина
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина
Соединительные (добавочные) белки саркомера
Титин (коннектин) - гигантский белок (самый большой из известных белков М около 3000 кДа). Нити титина прикреплены к Z-диску и проходят
посередине толстых филаментов, очень легко растягивается и обусловливает
высокую эластичность мышечных волокон при растяжении.
Миомезин и М-белок ассоциированы с миозином в области центральной "голой" зоны филамента, не несущей головок: поддержание
правильной упаковки миозиновых филаментов
Небулин - белок ассоциирован c тонкими нитями – скрепляет
миозиновые филаменты в области М-линии
α-актинин- скрепляет тонкие филаменты в области Z-линии
Десмин - содержится между Z-линиями соседних миофибрилл,
обеспечивая совпадение границ всех их саркомеров
Тропомодулин закрывает отрицательный конец актина, блокируя спонтанную диссоциацию АДФ-связанных мономеров актина из окружающей
среды
Биохимические механизмы сокращения скелетных мышц
Мышца сокращается благодаря укорочению множества
последовательно соединенных саркомеров в миофибрилле.
Актиновые нити скользят вдоль миозиновых навстречу друг другу за счет «гребковых движений» головок миозина.
Во время скольжения сами актиновые и миозиновые нити не укорачиваются.
