
БИОХИМИЯ СКЕЛЕТНЫХ МЫШЦ
.pdfЭтапы мышечного соркращения
l –й этап. Мышечное сокращение начинается с нервного импульса.
Под воздействием ацетилхолина развивается возбуждение клеточной мембраны и резко повышается ее проницаемость для ионов Са2+.
Это приводит к выходу ионов Са2+ из саркоплазматического ретикулума в цитозоль. Содержание ионов Са2+ в цитозоле миофибриллы увеличивается до 10-5 моль/л.
l –й этап. Ионы Са2+ связываются с С-субъединицей тропонина, что вызывает конформационные изменения тропонина и тропомиозина.
В результате на актине открываются центры связывания головок миозина
III– й этап.
•Фиксация АТФ на головке миозина
•Гидролиз АТФ
•Продукты гидролиза (АДФ и Ф) остаются фиксированными, а
выделившаяся энергия |
аккумулируется в головке. |
|
• Содержащая АДФ и Фн |
миозиновая «головка» |
присоединяется |
к центру связывания на актине под углом |
90°, образуется |
|
актинмиозиновый комплекс |
|
|
IV - й этап. АДФ и Рн выходят из |
актин-миозинового комплекса. |
Происходит спонтанный поворот миозиновой «головки» на 45° |
|
При этом тонкая актиновая нить |
движется вдоль миозиновой в |
направлении к М-линии. Происходит сокращение саркомера.
Головки миозина "работают" циклично, как весла у лодки, поэтому этот процесс называется "весельным механизмом" мышечного сокращения.
Комплекс "актин-миозин«очень прочен. Он может быть разрушен только при сорбции новой молекулы АТФ.
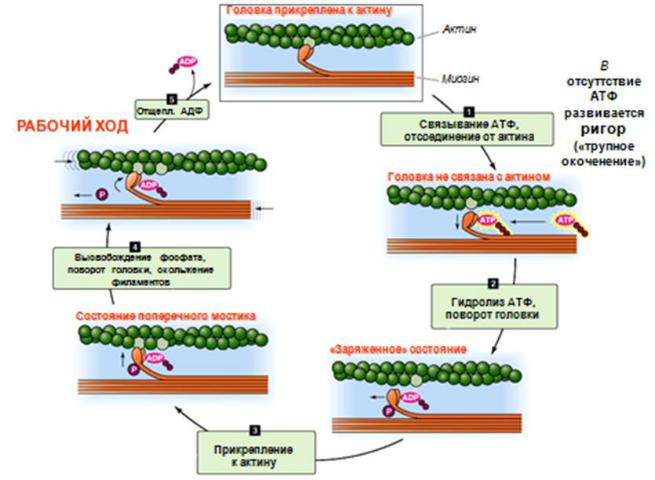
V й этап. Новая молекула АТФ связывается с «головкой» миозина,
что приводит к распаду актомиозина Связывание (но не гидролиз) АТФ с миозином сопровождается
отделением миозина от актина и создает возможность повторения цикла поперечных мостиков.
На этой стадии АТФ не расщепляется, т.е. служит не источником энергии, а аллостерически изменяет конформацию миозиновой головки и тем самым ослабляет связь миозина с актином
При поступлении нового нервного импульса к мышце цикл
сокращения повторяется.
Цикл работы «головки» миохина
Мышечное расслабление
• в отсутствии нервного импульса содержание Са2+ в саркоплазме падает ниже 10-7 моль/л вследствие его поглощения саркоплазматическим
ретикулумом;
•распад комплекса ТnС•Са2+
•изменение конформации тропонина I и тропомиозина приводит к закрытию активных центров F-актина и ингибирование дальнейшее взаимодействие миозиновой головки с F-актином
•миозиновые головки в присутствии АТФ отделяются от F-актина,
вызывая расслабление.
Не только процесс сокращения, но и процесс расслабления нуждается в АТФ, потому что если нет АТФ, то не работает Са2+-зависимая АТФаза. В
этих условиях кальций связан с тропонином "С" - вся система находится в активном состоянии, нет распада актомиозинового комплекса - мышца постоянно находится в состоянии сокращения. Такая ситуация наблюдается после смерти организма в состоянии "трупного окоченения".
В сердечной мышце основным источником ионов Са2+ для возбуждения служит внеклеточная жидкость, при отсутствии Са2+ во внеклеточной жидкости сокращения сердечной мышцы прекращаются в течение одной минуты. Скелетная мышца в таких условиях может сокращаться часами.
Сокращение гладких мышц
•Пусковой механизм в сокращении гладких мышц – повышение
[Ca2+] в клетке.
•Ca2+ связывается с кальмодулином, активирует киназу легких цепей миозина.
•Фосфорилирование легких цепей миозина
•Взаимодействие его с актином скольжение нитей, вызывает сокращение аналогично со скелетными мышцами
•Процесс сокращения в гладких мышцах происходит значительно медленнее.
Особенности обмена веществ в скелетных мышцах.
Обмен белков; мышцы являются главным местом катаболизма аминокислот с разветвленной цепью. Мышечная ткань окисляет лейцин до СО2 и превращает углеродный скелет аспартата, аспарагина, глутамата,
изолейцина и валина в субстраты ЦТК. Способность мышц разрушать аминокислоты с разветвленной цепью при голодании и диабете возрастает в
3–5 раз.
Обмен липидов: в мышцах выражен катаболизм липидов. Жирные кислоты, кетоновые тела в аэробных условиях окисляются в мышцах для получения энергии.
Обмен углеводов: в мышцах преобладает катаболизм углеводов.
Глюкоза окисляется в аэробных или анаэробных условиях для синтеза АТФ.
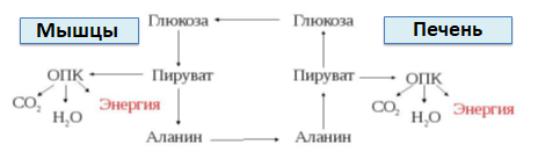
Из глюкозы в мышцах образуется аланин (источником почти всего пирувата, идущего на синтез аланина, является гликолиз).
Аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается в процессе синтеза мочевины, а пируват включается в глюконеогенез или ОПК. Глюкоза из печени поступает в мышцы и в процессе гликолиза окисляется до пирувата.
Образование аланина в мышцах, его перенос в печень и перенос глюкозы в обратном направлении составляют глюкозоаланиновый цикл
Глюкоза, поступившая из крови и образовавшаяся в глюконеогенезе,
запасается в мышцах в форме гликогена (до 1–2% от массы мышцы).
Распад гликогена в скелетных мышцах идет только до глюкозо-6-
фосфата, так как в мышцах отсутствует фермент глюкозо-6фосфатаза.
Гликоген мышц является источником глюкозы только для собственных
нужд.
В скелетных мышцах высокое накопление молочной кислоты (лактата)
является следствием анаэробного гликолиза при очень интенсивной работе,
при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе,
ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5
часа в мышце лактата уже нет.
Лактат не используется скелетными мышцами.
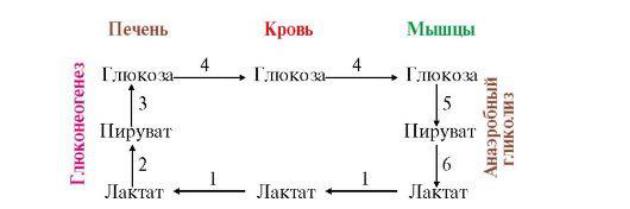
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза,
образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
Цикл Кори
Пути ресинтеза АТФ в мышцах
Аэробный механизм
•Окислительное фосфорилирование АДФ в митохондриях
Анаэробные механизмы
•Креатинкиназный
•Анаэробный гликолиз
•Миокиназный
Преимущества аэробных механизмов ресинтеза АТФ:
•наиболее энергетически выгодный процесс
•самый большой резерв субстратов: может использоваться
•глюкоза, ВЖК, кетоновые тела (при голодании)
Недостаток: требует повышенных количеств кислорода.
При умеренной мышечной активности АТФ образуется преимущественно путем ОФ, и в течение первых 5-10 мин главным ресурсом для этого служит гликоген.
В последующие ~30 мин доминирующими становятся субстраты,
поставляемые кровью, причем глюкоза и ВЖК участвуют примерно в одинаковой мере.
На поздних этапах сокращения преобладает утилизация ВЖК, а
глюкоза расходуется меньше.
При физической нагрузке возрастает метаболизм свободных
жирных кислот.
При гипоксии или ишемии основным энергетическим субстратом служит либо глюкоза, поступающая в клетки из вне, либо
внутриклеточный гликоген.
Анаэробные пути ресинтеза АТФ являются дополнительными способами образования АТФ в мышечных волокнах в тех случаях, когда основной путь получения АТФ – тканевое дыхание не может обеспечить мышечную деятельность необходимым количество кислорода.

Креатинкиназная реакция - специальная реакция субстратного
фосфорилирования.
Креатинкиназный путь ресинтеза АТФ
Обратная реакция может протекать в митохондриях с использованием АТФ, образовавшейся в процессе окислительного фосфорилирования. Мембрана митохондрий хорошо проницаема как для креатина, так и для креатинфосфата, а креатиназа есть и в саркоплазме, и
в межмембранном пространстве митохондрий.
Креатинфосфатный челнок
Преимущества креатинкиназного пути ресинтеза АТФ
•Это самый быстрый способ ресинтеза АТФ.
•Запасов креатинфосфата хватает для обеспечения мышечной работы в течение 20 секунд.
•Максимально эффективен.
•Не требует присутствия кислорода
•не дает побочных нежелательных продуктов, включается мгновенно.
Его недостаток — малый резерв субстрата (хватает только на 20
секунд работы).
Миокиназный путь
Миокиназная реакция происходит в мышцах при значительном увеличении концентрации AДФ – это аварийный механизм, когда другие пути ресинтеза АТФ невозможны.
2АДФ – АТФ +АМФ.
Реакция катализируется миокиназой (аденилаткиназой).
Главное значение этой реакции заключается в образовании АМФ
— мощного аллостерического активатора ключевых ферментов гликолиза
(фосфофруктокиназы) и гликогенолиза (гликогенфосфорилазы).
Частично АМФ путем дезаминирования превращается в ИМФ,
сдвигая миокиназную реакцию в сторону образования АТФ.
Анаэробный гликолиз
Преимущества:
• не требуют присутствия кислорода
Недостатки:
•небольшая эффективность
•накопление недоокисленных продуктов (лактат).
•начинается не сразу — только через 10–15 секунд после
начала мышечной работы.
Заболевания мышц
Миопатии ( от греч. mys, myos мышца + pathos страдание,
болезнь)- нервно-мышечные заболевания, характеризующиеся развитием первичного дистрофического или вторичного (денервационного)
атрофического процесса в скелетной мускулатуре
Признаки
•мышечная слабость
•двигательные нарушения
•снижение сухожильных рефлексов
•деформация костей и суставов
Биохимические изменения в скелетгых мышцах при патологии
Уменьшение в мышцах:
•количества миофибриллярных белков
•уровня АТФ и креатинфосфата
•активности саркоплазматических ферментов
•АТФ-азной активности миозина
Увеличение в мышцах:
•количества белков стромы и миоальбумина
•активности лизосомальных ферментов
•активности КК-3
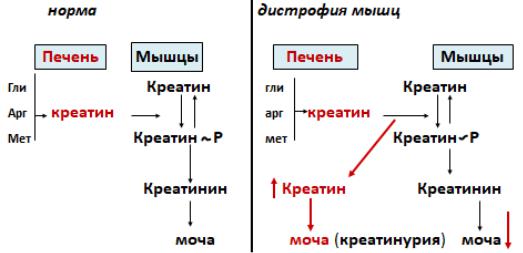
•креатинурия
Суточное выделение |
Креатин не |
креатинина величина |
фосфорилируется в мышцах, |
постоянная – прямо |
уровень в крови |
пропорциональная |
повышается. Креатинин в |
массе. Креатина в |
почках не реабсорбируется, |
моче нет. |
поэтому его количество в |
|
моче отражает величину |
|
клубочковой фильтрации |
|
|
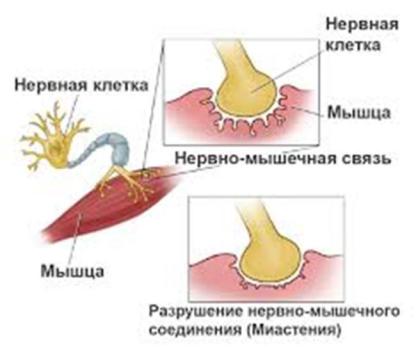
Миастения (лат. myasthenia— «мышца» и ἀσθένεια — «бессилие,
слабость») — аутоиммунное нервно-мышечное заболевание,, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью поперечнополосатых мышц.
Заболевание, в основе которого лежит повышение активности холинэстеразы, в результате чего быстро расщепляется медиатор ацетилхолин и блокируется проводимость на уровне мионеврального синапса.
Коррекция
холинэстеразы.
