
Ответы на экзаменационные вопросы по биологии. Экзамен
.pdf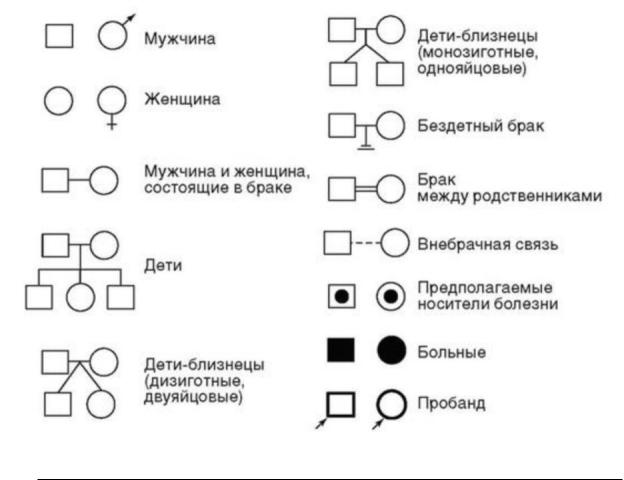
Правила составления:
При составлении родословной исходным является человек - пробанд, родословную которого изучают. Обычно это либо больной, либо носитель определенного признака, характер наследования которого предполагается исследовать. Результаты генеалогического анализа оформляют в виде таблиц с использованием унифицированных обозначений, предложенных Г. Юстом в 1931 г. В этих таблицах последовательные поколения обозначают римскими цифрами, а конкретных лиц в каждом поколении - арабскими.
26. Методы генетики человека: популяционно–статистический;
дерматоглифический, генетики соматических клеток, изучения ДНК; их роль в изучении наследственной патологии человека.
Популяционно-статистический метод:
С помощью популяционно-статистического метода изучают наследственные признаки в больших группах населения, в одном или нескольких поколениях. Существенным моментом при использовании этого метода является статистическая обработка получаемых данных. Этим методом можно рассчитать частоту встречаемости в популяции различных аллелей гена и разных генотипов по этим аллелям, выяснить распространение в ней различных наследственных признаков, в том числе заболеваний. Он позволяет изучать мутационный процесс, роль наследственности и среды в формировании фенотипического полиморфизма человека по нормальным признакам, а также в возникновении болезней, особенно с наследственной предрасположенностью. Этот метод используют и для выяснения значения генетических факторов в антропогенезе, в частности в расообразовании.
При статистической обработке материала, получаемого при обследовании группы населения по интересующему исследователя признаку, основой для выяснения генетической структуры популяции является закон генетического равновесия Харди — Вайнберга. Он отражает закономерность, в соответствии с которой при определенных условиях соотношение аллелей генов и генотипов в генофонде популяции сохраняется неизменным в ряду поколений этой популяции. На основании этого закона, имея данные о частоте встречаемости в популяции рецессивного фенотипа, обладающего гомозиготным генотипом (аа), можно рассчитать частоту встречаемости указанного аллеля (а) в генофонде данного поколения. Распространив эти сведения на ближайшие поколения, можно предсказать частоту появления в них людей с рецессивным признаком, а также гетерозиготных носителей рецессивного аллеля.
Математическим выражением закона Харди — Вайнберга служит формула (рА. + qa)2, где р и q — частоты встречаемости аллелей А и а соответствующего гена. Раскрытие этой формулы дает возможность рассчитать частоту встречаемости людей с разным генотипом и в первую очередь гетерозигот — носителей скрытого рецессивного аллеля: p2AA + 2pqAa + q2аа. Например, альбинизм обусловлен отсутствием фермента, участвующего в образовании пигмента меланина и является наследственным рецессивным признаком. Частота встречаемости в популяции альбиносов (аа) равна 1:20 000. Следовательно, q2 = 1/20 000, тогда q = 1/141, up = 140/141. В соответствии с формулой закона Харди — Вайнберга частота встречаемости гетерозигот = 2pq, т.е. соответствует 2 х (1/141) х (140/141) = 280/20000 = 1/70. Это означает, что в данной популяции гетерозиготные носители аллеля альбинизма встречаются с частотой один на 70 человек.
Анализ частот встречаемости разных признаков в популяции в случае их соответствия закону Харди — Вайнберга позволяет утверждать, что признаки обусловлены разными аллелями одного гена.В том случае, если ген в генофонде популяции представлен несколькими аллелями, например ген группы крови системы АВО, соотношение различных генотипов выражается формулой (pIA + qIB + rI0) 2.

Дерматоглифический метод:


Метод генетики соматических клеток:
Суть метода генетики соматических клеток сводится к использованию в целях генетического анализа человека культур клеток, получаемых из различных источников, - периферическая кровь, кожа, скелетная мускулатура, биопсийный материал (клетки плаценты и ворсин хориона плода, опухолей), амниотическая жидкость. В зависимости от задачи проводят простое культивирование клеток in vitro, клонирование (получение от одной клетки генетически идентичного клеточного потомства), селекцию (отбор из клеточной массы клеток с заданной характеристикой, например, несущих определенную мутацию), гибридизацию клеток, различающихся по некоторым характеристикам, полученных от разных людей или от человека и животного другого вида - мыши, крысы, курицы, хомячка, обезьяны, генетическую модификацию клеток с использованием генно-инженерных технологий knock out (инактивация конкретного гена, замена аллеля дикого типа на мутант-ный) и knock in (введение в клеточный геном определенного гена).
Культивирование клеток решает задачу увеличения массы биоматериала, получаемого, например, от эмбриона или плода, до уровня, позволяющего выполнить в полном объеме цитогенетические, биохимические, иммунологические, иные молекулярно-биологические и
клеточно-биологические, прежде всего диагностические, исследования. Практикуемые в целях активной профилактики рождения детей с наследственной патологией плацентобиопсии и хорионбиопсии (8-12-е недели беременности), амниоцентез (забор амниотической жидкости с находящимися в ней клетками, 15-18-е недели беременности), кордоцентез (забор пуповинной крови с находящимися в ней клетками, беременность более 18 нед), забор клеток из бластоцист, получаемых путем экстракорпорального оплодотворения или маточного лаважа (от франц. lavage - мытье, стирка, здесь - промывание полости органа жидкостью с целью извлечения зародыша; срок 90-130 ч после оплодотворения) дают недостаточное количество клеток. Без последующего наращивания объема биоматериала в условиях in vitro качественная дородовая (пренатальная) и предымплантационная диагностика генетических дефектов невозможна. Селекция,
клонирование, генетическая модификация клеток расширяют возможности научного анализа форм и степени генетического контроля развития различных (в том числе патологических) фенотипических признаков, повышают вероятность выявления стартового патогенетического звена заболевания, в частности, из числа наследственных болезней обмена веществ или наследственных иммунодефицитов (отсутствие синтеза или образование функционально дефектного продукта генной активности - фермента, рецептора, иммуноглобулина, транспортного или сигнального белка и т.п.). Названные выше манипуляции с клетками находят применение при создании терапевтических генно-инженерных конструкций, тканеинженерных конструкций для регенеративной медицины.
Гибридизация соматических клеток в условиях культуры дает возможность исследовать сцепление генов и их локализацию на той или иной хромосоме (картирование). Особенность межвидовых клеточных гибридов состоит в том, что в последовательных делениях из кариотипа теряются хромосомы предпочтительно одного вида. Клетки-гибриды «человек-мышь», например, утрачивают, причем постепенно, все хромосомы человека, что дает возможность проследить с потерей каждой очередной хромосомы утрату определенных генов (сайтов, нуклеотидных последовательностей ДНК). Используя метод генетики соматических клеток, изучают характер межгенных взаимодействий, механизмы регуляции генной активности. Получаемые этим методом данные позволяют судить о генетической гетерогенности наследственных болезней, а также изучать их патогенез на молекулярном и клеточном уровнях.
Метод изучения ДНК:
Нарушения первичных продуктов генов выявляются с помощью биохимических методов. Локализация соответствующих повреждений в самом наследственном материале может быть выявлена методами молекулярной генетики. Разработка метода обратной транскрипции ДНК на молекулах мРНК определенных белков с последующим размножением этих ДНК привела к появлению ДНК-зондов для различных мутаций нуклеотидных последовательностей человека. Использование таких ДНК-зондов для гибридизации с ДНК клеток пациента дает возможность выявлять у него соответствующие изменения в наследственном материале, т.е. диагностировать определенные виды генных мутаций (генодиагностика). Методы молекулярной генетики и генной инженерии позволяют не только диагностировать целый ряд генных мутаций и устанавливать нуклеотидную последовательность отдельных генов человека, но и размножать

(клонировать) их и получать в большом количестве белки — продукты соответствующих генов.
27. Понятие наследственных болезней: моногенные, хромосомные и мультифакториальные болезни человека, механизмы их возникновения и проявления. Примеры.
Наследственные заболевания — заболевания, возникновение и развитие которых связано с дефектами в наследственном аппарате клеток, передаваемыми по наследству через гаметы.
Моногенный тип наследования - наследственный признак контролируется одним геном.
Моногенные заболевания подразделяются по типу наследования:
●Аутосомно-доминантные (если хоть один из родителей болен, то и ребенок будет болеть; Синдром Марфана, ахондроплазия);
●Аутосомно-рецессивные (ребенок может заболеть, если оба родителя носители данного заболевания, или один родитель болен, а второй-носитель мутаций гена, вызывающих это заболевание; муковисцидоз, спинальная миоатрофия).
У всех моногенных заболеваний разная распространенность, которая может колебаться и от географии, и от национальности.
К хромосомным относятся болезни, обусловленные геномными мутациями или структурными изменениями отдельных хромосом. Хромосомные мутации возникают в результате мутаций в половых клетках одного из родителей.
Они делятся:
Аномалии числа хромосом:
●Болезни, обусловленные нарушением числа аутосом (неполовых) хромосом
(Синдром Дауна (трисомия по 21 хромосоме, слабоумие, задержка роста, характерная внешность, изменение дерматоглифики; Синдром Патау (трисомия по 13 хромосоме, идиотия, нарушение строения половых органов, глухота; Синдром Эдвардса(трисомия по 18 хромосоме, ротовое отверстие и нижняя челюсть маленькие, глазные щели узкие и короткие, ушные раковины деформированы);
●Болезни, связанные с нарушением числа половых хромосом (Синдром Шерешевского-Тернера(отсутствие одной Х-хромосомы у женщин, низкорослость, бесплодие, половой инфантилизм; Синдром Клайнфельтера (полисомия по Х и Y хромосомам у мальчиков, евнухоидный тип строения, половой инфантилизм, бесплодие, чаще всего отстает развитие);
●Болезни, причиной которых является полиплоидия (триплодии, тетраплодии и т.д.- причиной является нарушение процесса мейоза вследствие мутации, в результате чего дочерняя половая клетка получает вместо гаплоидного - диплоидный набор хромосом);
Нарушения структуры хромосом:
●Транслокации — обменные перестройки между негомологичными хромосомами;
●Делеции — потери участка хромосомы; синдром кошачьего крика связан с делецией короткого плеча 5-й хромосомы(необычный плач детей, напоминающий мяуканье или крик кошки - это связано с патологией гортани или голосовых связок, умственное и физическое недоразвитие, микроцефалия (аномально уменьшенная голова);
●Инверсии — повороты участка хромосомы на 180 градусов;
●Дупликации — удвоения участка хромосомы;
●Изохромосомия — хромосомы с повторяющимся генетическим материалом в обоих плечах;
●Возникновение кольцевых хромосом — соединение двух концевых делеций в обоих плечах хромосомы.
Мультифакториальные заболевания - болезни с наследственной предрасположенностью.
Группа болезней отличается от генных тем, что для своего проявления нуждается в действии факторов внешней среды (бывают моногенными, наследственная предрасположенность обусловлена одним патологически измененным геном, и полигенными).
У человека описана мутация, обуславливающая патологическую реакцию на загрезнение атмосферы (ранняя эмфизема легких), непереносимость лактозы, специфические реакции на алкоголь.
28. Понятие о болезнях с нетрадиционным наследованием (митохондриальные, болезни импритинга, болезни экспансии тринуклеотидных повторов). Примеры. Общие подходы к лечению наследственных болезней.
В настоящее время описано достаточно много заболеваний, которые в современной классификации наследственной патологии человека объединяют в отдельную группу: болезни с нетрадиционным типом наследования. Среди них различают: болезни импринтинга, митохондриальные болезни, болезни экспансии тринуклеотидных повторов с явлением антиципации и др.
Болезни импринтинга. Особенности наследования и фенотипического проявления при болезнях импринтинга обусловлены явлением геномного импринтинга (ГИ) (импринтинг от англ. imprinting — запечатление). (Нашла примеры : Синдром Прадера-Вилли (изменения в отцовской хромосоме) , синдром Ангельмана ( изменения в материнской хромосоме)
Явление геномного импринтинга связывают со специфическими изменениями хромосом или их участков во время образования мужских и женских гамет. Этим объясняется дифференциальная маркировка отцовских и материнских хромосом у потомков.
Точные механизмы дифференциальной маркировки хромосом или их участков в сперматогенезе или овогенезе пока окончательно не выяснены. Однако, немаловажная роль,
вероятно, принадлежит процессам специфического метилирования цитозиновых оснований ДНК, выключающим транскрипцию гена.
Импринтированные участки в хромосомах определенного родительского происхождения (отцовских или материнских) избирательно репрессируются у потомка. В связи с этим фенотипически проявляется только информация, полученная от другого родителя, т.е. имеет место моноаллельная экспрессия. Следовательно, фенотипическое проявление мутантного аллеля зависит от того с какой половой клеткой (яйцеклеткой или сперматозоидом) он был передан потомку.
Явлением ГИ объясняется, например, избирательная инактивация у млекопитающих отцовской Х-хромосомы в клетках провизорных органов. В клетках самого зародыша имеет место равновероятная инактивация отцовской и материнской Х-хромосом.
Таким образом, следствием ГИ (дифференциальной маркировки в гаметогенезе родителей и последующей избирательной инактивации у потомков участков хромосом) является функциональная неравноценность в генотипе потомка аллелей разного родительского происхождения.
Доп.: Под геномным импринтингом понимают эпигенетический процесс, который дифференциально маркирует материнские и отцовские гомологичные хромосомы, что приводит к разному фенотипическому проявлению мутаций у потомства, унаследованных от матери или отца. В участках генома, подверженных импринтингу, экспрессируется только один из двух аллелей – отцовский или материнский, т.е. наблюдается моноаллельная экспрессия генов. Второй аллель, вследствие наличия на нем некоего отпечатка, импринтирован (выключен или подавлен) и не экспрессируется. Такой способ регуляции генов свидетельствует о неэквивалентном вкладе родителей в геном потомков.
+Пример: известно, что в проксимальном участке хромосомы 15 имеются близко сцепленные, но противоположно импринтированные локусы: один из них активно экспрессируется на отцовской хромосоме, а другой – на материнской. Если эти гены работают – нет патологии. При их отсутствии или выключении развиваются синдром Прадера-Вилли или Энгельмана. Для синдрома Прадера-Вилли кандидатный ген экспрессируется на отцовской хромосоме, а для синдрома Энгельмана кандидатный ген экспрессируется на материнской хромосоме.
Митохондриальные болезни - связь некоторых видов наследственной патологии у человека с мутациями митохондриальной ДНК.
●болезни, вызванные точковыми мутациями, приводящими к замене консервативных аминокислот в собственных белках митохондрий (пигментный ретинит и нейроофтальмопатия Лебера, при которой наступает двусторонняя потеря зрения);
●болезни, вызванные мутациями в генах т-РНК, приводящими к многочисленным дегенеративным заболеваниям с различной степенью тяжести клинических проявлений, коррелирующей с количеством мутантной мтДНК;
●болезни, вызванные делениями и дупликациями участков митохондриалъных генов (отсроченная кардиопатия, при которой обнаружены делеции мтДНК кардиоцитов, заболевание носит семейный характер);
● болезни, вызванные снижением числа копий мтДНК, что является следствием определенных мутаций (летальная инфантильная дыхательная недостаточность и синдром молочнокислого ацидоза).
Изменения в ДНК митохондрий сопровождаются нарушением их функций, связанных с клеточным дыханием. Это определяет характер и степень тяжести клинических проявлений митохондриалъных болезней.
Болезни экспансии тринуклеотидных повторов. Данная патология зависит от количества тринуклеотидных повторов в мутантном аллеле. Чем их больше, тем тяжелее протекает болезнь. Поскольку количество повторов формируется в мейозе у одного из родителей, может быть более тяжёлое течение в последующих поколениях, что связано с их увеличением. Клиническая картина зависит от дозы генов. Примером является синдром Мартина-Белла (умственной отсталости с ломкой Х-хромосомой). Фенотип: удлинённое лицо, выступающий лоб, большие оттопыренные уши, большие кисти и стопы, умственная отсталость. Цитогенетика: отличается ломкостью в дистальной части длинного плеча Х-хромосомы (Хq), что напоминает «спутник».
Общие подходы к лечению наследственных болезней сходны с подходами к лечению болезней любой другой этиологии. При наследственных болезнях полностью сохраняется принцип индивидуализированного лечения, ведь врач и при наследственной патологии лечит не просто болезнь, а болезнь конкретного человека. Возможно, что при наследственной патологии принцип индивидуализированного лечения должен соблюдаться еще строже, потому что гетерогенность наследственных болезней далеко не расшифрована, а, следовательно, одну и ту же клиническую картину могут вызвать разные наследственные болезни с различным патогенезом. В зависимости от условий пре- и постнатального онтогенеза, а также от всего генотипа человека фенотипические проявления мутаций у конкретного человека могут модифицироваться в ту или другую сторону. Следовательно, необходима разная коррекция наследственной болезни у разных пациентов.
29. Медико-генетическое консультирование, его медицинское значение. Виды и этапы консультирования. Методы пренатальной диагностики (инвазивные, неинвазивные) и их возможности.
Медико-генетическое консультирование (МГК) – вид медицинской помощи,
направленный на предотвращение рождения ребёнка с наследственным заболеванием.
Медицинское значение:
1)Определение прогноза в семьях с наследственной патологией;
2)Разъяснение величины риска и помощь в выборе решения;
3)Уточнение диагноза наследственного заболевания для лечащего врача;
