
- •Билет № 1.
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •28)Углеводы. Классификация. Функции
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •24) Общее представление о липидах. Классификация липидов
- •1) Структурная
- •2) Запасная (энергетическая)
- •3) Защитная
- •4) Важный компонент пищевого сырья
- •2 Классификация липидов
- •2.12. Химическое равновесие. Обратимые и необратимые реакции
- •2.13. Константа химического равновесия. Прогнозирование смещения химического равновесия
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •18) Альдегиды, особенности строения карбонильный группы. Химические свойства альдегидов: образование
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •16) Спирты и фенолы. Многотомные спирты.
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем.
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •3.5. Биологические функции углеводов
- •1. Клеточная локализация и функция
- •2. Строение миоглобина
- •3.Связывание гема с апомиоглобтом
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •17. Механизм действия буферных систем. Буферные системы крови
- •48)Вторичная структура белка
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •54)Классификация сложных белков
- •50) Классификация белков
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
I. Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
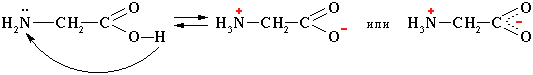
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
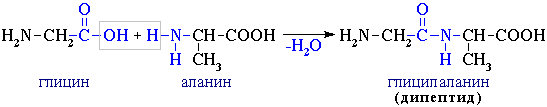
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
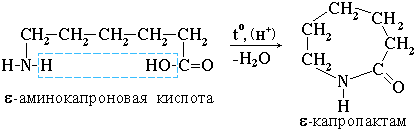
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка)
IV. Качественная реакция
1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
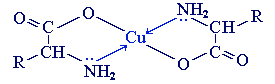
Билет 25
17. Механизм действия буферных систем. Буферные системы крови
Механизм буферного действия рассмотрим на примере ацетатной БС: СН3СООН/СН3СОО- +Na+,
где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH).
При добавлении:
а) сильной кислоты (избытка протонов) ацетат-анион связывает этот избыток протонов (т.е. проявляет свойства основания) с образованием эквивалентного количества слабой уксусной кислоты:
СН3СОО- + Н+ ↔ СН3СООН
Несмотря на увеличение общей кислотности, активная кислотность вырастет мало, так как оно произошло за счёт увеличения концентрации слабой кислоты, степень диссоциации которой понизится согласно закону Оствальда.
б) сильного основания (щёлочи, избытка ОН--анионов) она нейтрализуется за счёт резервной кислотности:
СН3СООН + ОН- ↔ СН3СОО- + Н2О.
Активная кислотность при этом изменяется незначительно, так как согласно закону Оствальда уменьшение концентрации слабой кислоты приводит к росту степени её диссоциации.
Обратите внимание, что катион металла, входящего в состав соли, не принимает участие в буферном действии.
При разбавлении и концентрировании рН не изменяется, так как остаётся прежним соотношение компонентов БС
Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Первичная структура каждого белка уникальна и запрограммирована генетически.
Первичную структуру белка формируют пептидные связи, образующиеся при взаимодействии α-карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты. Полипептидная цепь состоит из регулярно повторяющихся участков, образующих основную цепь или пептидный остов, и вариабельной части, включающей в себя характерные боковые цепи - радикалы аминокислот.Особенности первичной структуры белка. В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (—СНR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве.
Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу .
Пептидные связи обычно расположены в транс-конфигурации, Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей.Пептидные связи образуются при взаимодействии a -аминогруппы одной аминокислоты с a -карбоксильной группой другой аминокислоты: Пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку. Следовательно, пептиды - это цепочки аминокислот.
Билет 26
Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая
Бикарбонатная (гидрокарбонатная) БС (Н2СО3/НСО3-) – мощная система плазмы крови, составляющая примерно 10% от её общей буферной ёмкости. В норме соотношение компонентов (гидрокарбонат-анион / угольная кислота) равно 20.
Механизм действия бикарбонатной БС в организме аналогичен таковому ацетатной БС, с той лишь разницей, что при увеличении концентрации угольной кислоты, она интенсивно разлагается под действием фермента карбангидразы: Н2СО3 ↔ Н2О + СО2↑.
Образующийся при этом углекислый газ удаляется с выдыхаемым воздухом.
Фосфатная БС. Образована двумя ионами: гидро- и дигидрофосфат-анионами: НРО42-/Н2РО4-
Первый из них выполняет роль соли, второй – слабой кислоты. На долю фосфатной БС приходится примерно 1% буферной ёмкости крови. Механизм её действия аналогичен описанному выше.
Белковая БС имеет меньшее значение в поддержании рН. Благодаря амфотерным свойствам белков, состав белковой БС условно можно представить, как белок-кислоту (НООС–Pr–NH3+) и белок-основание (-ООС–Pr–NH2), где Pr – протеин (белок). При добавлении в систему протонов они последовательно будут связываться с оснόвными группами:
-ООС–Pr–NH2+ Н+ → -ООС–Pr–NH3+,
-ООС–Pr–NH3+ + Н+ → НООС–Pr–NH3+.
При добавлении в систему гидроксид-ионов они последовательно будут нейтрализоваться протонами, отщепляющимися от кислотных групп:
НООС–Pr–NH3+ + ОН- → -ООС–Pr–NH3+ + Н2О,
-ООС–Pr–NH3+ + ОН- → -ООС–Pr–NH2 + Н2О.
