
Составляющие расклинивающего давления
1.
Молекулярная
составляющая расклинивающего давления
(![]() )
– обусловлена силами Ван-дер-Ваальса
(силами притяжения, действующими между
ядрами мицелл).
)
– обусловлена силами Ван-дер-Ваальса
(силами притяжения, действующими между
ядрами мицелл).
2.
Электростатическая
составляющая расклинивающего давления
(![]() )
– возникает при перекрывании ДЭС мицелл,
обусловлена электростатическими силами
отталкивания.
)
– возникает при перекрывании ДЭС мицелл,
обусловлена электростатическими силами
отталкивания.
3.
Адсорбционная
составляющая расклинивающего давления
(![]() )
– возникает в случаях, когда на поверхности
твердой фазы адсорбируются молекулы,
обладающие большой адсорбционной
способностью (длинноцепочечные ПАВ,
молекулы белков, ВМС и т.д.).
)
– возникает в случаях, когда на поверхности
твердой фазы адсорбируются молекулы,
обладающие большой адсорбционной
способностью (длинноцепочечные ПАВ,
молекулы белков, ВМС и т.д.).
4.
Структурная
составляющая расклинивающего давления
(![]() )
– обусловлена существованием особых
слоев жидкости вблизи поверхности
твердого тела (например, молекулы воды
образуют упругие слои, которые препятствуют
сближению частиц).
)
– обусловлена существованием особых
слоев жидкости вблизи поверхности
твердого тела (например, молекулы воды
образуют упругие слои, которые препятствуют
сближению частиц).
Таким образом
![]() .
.
Структурная и адсорбционная составляющие расклинивающего давления и носят название адсорбционно-структурного барьера, который имеет большое значение в устойчивости лиофильных коллоидных систем.
В теории устойчивости ДЛФО для лиофобных коллоидных систем адсорбционную и структурную составляющие расклинивающего давления не учитывают и рассматривают только баланс (соотношение) сил притяжения и отталкивания, которые действуют между мицеллами лиофобного золя.
Таким
образом, для лиофобных коллоидных
систем:
![]() .
.
Зная , рассчитывают энергию притяжения между частицами, зная , рассчитывают энергию отталкивания. Суммарную энергию взаимодействия двух частиц лиофобных золей рассчитывают, как сумму энергии притяжения и энергии отталкивания.
Причины возникновения гидрофильного отталкивания и гидрофобного притяжения
□ при Θ <10, U(H)с >0 – возникает гидрофильное отталкивание при перекрывании слоев
□ при Θ>50 поверхность «гидрофобная». При перекрывании слоев возникает гидрофобное притяжение (U(H)с <0).
□ при 10<Θ <50 – при сближении дополнительных эффектов не возникает
Причины в строении слоев воды на соответствующих поверхностях.
На гидрофильной поверхности (SiO2)

Диполи воды плотно упакованы и ориентированы по нормали к поверхности. Этот слой имеет более высокую вязкость и плотность, чем вода в равновесном объеме. Взаимодействие проявляется на расстоянии ~6 нм.
Гидрофобная поверхность (графит, тефлон)
Вблизи поверхности диполи воды ориентируются параллельно поверхности. Структурно измененный слой обладает пониженной сдвиговой вязкостью, проявляется гидрофобное притяжение.
Гидрофильные (или олеофобные) материалы, которые лучше смачиваются водой: кальций, кварц, большинство силикатов и окисленных минералов, галогениды щелочных металлов.
Гидрофильные в-ва интенсивно взаимодействуют с молекулами воды. Гидрофильность характеризуется величиной адсорбционной связи (см. Адсорбция) B-B с молекулами воды, образованием с ними неопределённых соединений и распределением кол-ва воды по величинам энергии связи. Гидрофильность преимущественно определяется величиной энергии связи адсорбционного монослоя, т. к. последующие слои связаны с веществом гораздо слабее. Гидрофильность может выражаться теплотой адсорбции водяного пара или теплотой смачивания, а также работой смачивания единицы поверхности вещества.
Абсолютно гидрофобных ("водоотталкивающих") в-в нет; даже наиболее гидрофобные - углеводородные и фторуглеродные - поверхности адсорбируют воду. Поэтому гидрофобность рассматривают как малую степень гидрофильности.
Г. и г. могут быть оценены, как и смачиваемость поверхности водой (в воздушной среде), величиной угла смачивания q: для гидрофильных поверхностей <90° (для абсолютно гидрофильных поверхностей q=0); для гидрофобных поверхностей 90°< <180° (напр., для парафина 105°). На трёхфазной границе твёрдого тела с водой и углеводородной жидкостью при <90° (в водной фазе) поверхность олеофобна, т.е. не смачивается маслом, а при =180° - предельно олеофильна.
Гидрофильными являются вещества с полярными хим. связями: галогениды, оксиды и их гидраты, карбонаты, сульфаты, фосфаты, силикаты и алюмосиликаты (глины, стекла), а также клеточные мембраны. Чистые поверхности металлов, углерода, полупроводников, вещества, состоящие из слабо полярных молекул, листья растений, кожа животных, хитиновый покров насекомых гидрофобны. Все полярные группы, входящие в состав молекул ПАВ - поверхностно-активных веществ - COOH, -NH2,-SO3Na и др., гидрофильны; связанные с ними углеводородные радикалы - гидрофобны.
Гидрофильность твёрдых тел может резко понижаться (происходит их гидрофобизация) при адсорбции (особенно при хемосорбции) на их поверхности молекул ПАВ, ориентированных полярными группами в сторону поверхности, а углеводородными цепями - в окружающую среду (напр., при адсорбции жирных кислот, их солей и др. органич. ПАВ на поверхности минералов). Обратная ориентация адсорбированных молекул ПАВ приводит к гидрофилизации гидрофобных поверхностей.


4. Адсорбционная составляющая расклинивающего давления (Uадс). Механизм эффекта экранирования. Анализ уравнения для расчета адсорбционной составляющей, физический смысл величин, входящих в уравнение. Соотношение диэлектрических проницаемостей дисперсной фазы и адсорбционных слоев, приводящее к ослаблению или усилению молекулярного притяжения. Эффект защиты расстоянием. Какое строение должны иметь адсорбционные слои для обеспечения высокой агрегативной устойчивости системы?
За счет изменения энергии молекулярного притяжения частиц при наличии на их поверхности адсорбционных слоев из НПАВ и полимеров.
Может проявляться двояко:
Наличие адсорбционных слоев может влиять на молекулярное притяжение частиц (эффект экранирования)
Слои не позволяют частицам сблизиться на необходимое расстояние.

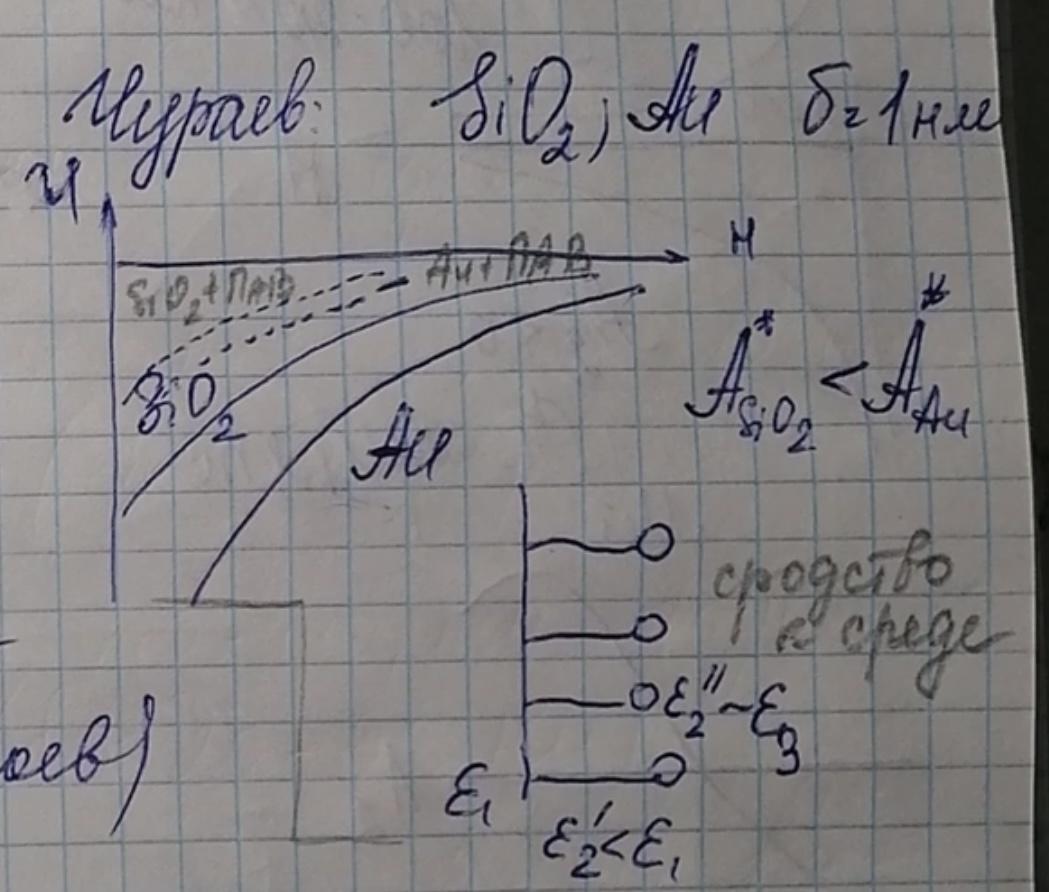
Механизм эффекта экранирования проявляется если:
- ε2 (слоя) ≠ ε1(частицы) ≠ ε3 (дисперсионной среды)
- ε2 < ε1 уменьшение. Uм(адс) < Uм(без слоя). Слои ослабляют притяжение.
- ε2 > ε1 – адсорбционные слои усиливают молекулярное притяжение частиц.
Эффект экранирования- изменение энергии молекулярного притяжения частиц.
Эффект защиты расстоянием- адсорб. слои могут раздвигать частицы на расст., где ослаблены силы молекулярного взаимодействия.
Эти эффекты влияют на энергию молекулярного притяжения в зависимости от толщины адс. слоя.

A = f(ε2;ε3 ) , те функция диэлектрических проницаемостей слоев и среды
B
= f(ε1;ε2
; )
; C = f(ε1;ε2
)
)
; C = f(ε1;ε2
)




а) <
<
 =>
|
=>
| (адс.)|
< |
|
(адс.)|
< |
|
б)
>
=>
|
(адс.)|
> |
|
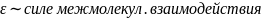
Эффект
защиты расстояния
>
 (образование сольватных слоев)
(образование сольватных слоев)
Адсорбция слабая. Адсорбционные слои получаются «рыхлыми», но сильно сольватированными. Они имеют большую толщину. Перекрывание происходит на больших расстояниях. В результате частицы не могут сблизится.
Чтобы эффекты проявились одновременно, адсорбционные слои должны быть плотными и сильно сольватированными. (концентрация>ККМ)
5. Стерическая составляющая расклинивающего давления (Uст). Механизм стабилизирующего действия адсорбционных слоев ПАВ и ВМС. Анализ уравнения Фишера для расчета (Uст). Физический смысл величин, входящих в уравнение. В каких случаях А2>0, A2<0, A2=0, как при этом происходит взаимодействие адсорбционных слоев?

Вытеснительная стабилизация.
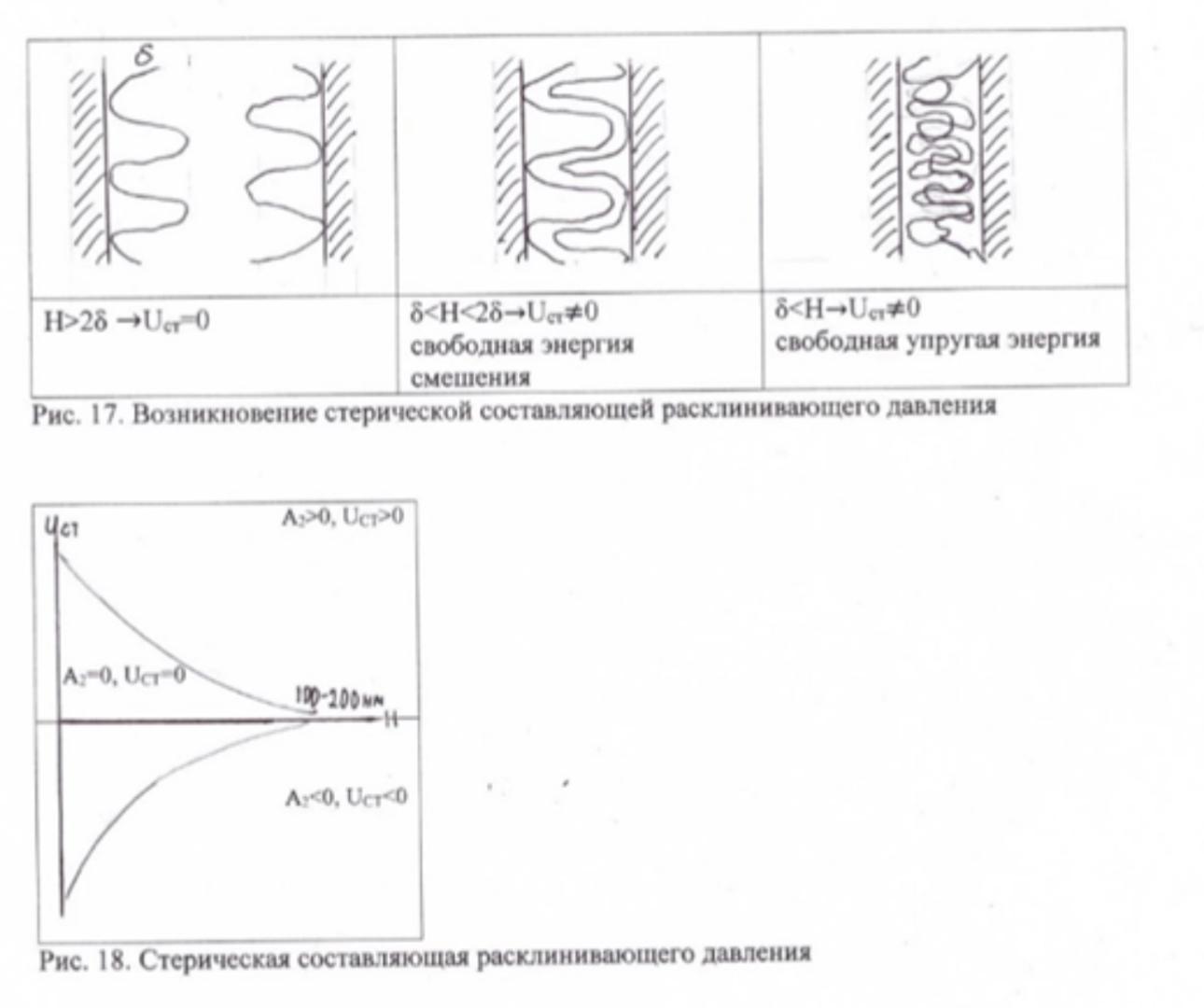
Проявление данной составляющей расклинивающего давления обусловлено наличием на поверхности частиц адсорбционных слоев из молекул полимеров или неионогенных ПАВ. Однако, в отличие от адсорбционной составляющей, здесь рассматриваются энергетические эффекты, которые возникают при перекрытии адсорбционных слоев. Энергия стерического взаимодействия складывается из двух составляющих, проявляющихся при различных расстояниях между частицами (рис 17).
При сближении частиц на расстояния δ ≤ Н ≤ 2δ стерическое взаимодействие возникает в результате взаимного проникновения (смешения) адсорбционных слоев без их деформирования и повышения концентрации адсорбата в области перекрытия. Энергия, затрачиваемая на этот процесс, называется свободной энергией смешения.
Сближение частиц на расстояния Н<δ возможно только при деформировании (сжатии) адсорбционных слоев, в результате чего происходит снижение энтропии молекул адсорбата, что приводит к возникновению взаимодействия, определяемого как свободная упругая энергия.
Соотношение между этими составляющими UСТ определяется концентрацией дисперсной фазы, строением адсорбционных слоев, их плотностью, протяженностью, сродством к дисперсионной среде.
Первые работы по теории стерической стабилизации принадлежат Мекору. В качестве допущений он принимал, что адсорбированные молекулы представляют собой жесткие стержни, направленные в среду. В области перекрытия адсорбционных слоев происходит снижение подвижности молекул, что вызывает уменьшение энтропии системы. Поскольку этот процесс является энергетически невыгодным перекрытие адсорбционных слоев приводит к возникновению стерического отталкивания между частицами. При всех недостатках своей теории Мекор показал, что потеря энтропии при перекрытии адсорбционных слоев может быть достаточно большой, чтобы скомпенсировать молекулярное притяжение частиц. Последующее развитие теории стерической стабилизации привело к учету влияния термодинамического качества растворителя и выделению двух составляющих стерического отталкивания. В работе Мейера впервые были даны выражения для оценки вкладов эффектов смешения и упругого сжатия. Теория Мейера была развита и существенно дополнена Хесселинком, Врие и Овербеком (теория ХВО). В этой теории были уточнены такие параметры, влияющие на энергию стерического взаимодействия частиц, как молекулярная масса адсорбата, плотность адсорбционных слоев, термодинамическое качество растворителя.
Уравнение Фишера для расчета (Uст) (учитывается термодинамическое качество дисперсионной среды):
где
R, [Дж/моль К] -газовая постоянная;
Т, [К] -температура;
Cδ, [кг/м3] - плотность адсорбционных слоев;
A2, [мольм3/кг2] - второй вириальный коэффициент;
δ, [м]- толщина адсорбционного слоя;
r, [м]- радиус, взаимодействующих частиц
Второй вириальный коэффициент A2 характеризует термодинамическое сродство адсорбата (полимера, ПАВ) к дисперсионной среде. Величина A2 определяется соотношением энергий взаимодействия молекул растворенного вещества (адсорбата) друг с другом и молекулами растворителя. В том случае, когда молекулам адсорбата энергетически выгоднее взаимодействовать с молекулами растворителя, чем друг с другом, растворитель считается термодинамически хорошим и для него A2 >0. Если же молекулам адсорбата энергетически более выгодно взаимодействовать друг с другом, а не с молекулами растворителя, последний является термодинамически плохим - A2 <0. При равноценных значениях энергий взаимодействия молекул адсорбата друг с другом и молекулами среды, растворитель считается квазиидеальным - A2=0.Численные значения A2 определяются осмотическим, вискозиметрическим или методом светорассеяния.
Из анализа уравнения (24) видно, что при A2 >0 перекрытие адсорбционных слоев приводит к возникновению стерического отталкивания -UСТ>0 (см. рис18.). В случае термодинамически плохого растворителя перекрытие адсорбционных слоев вызывает появление дополнительного стерического притяжения (адсорбционные слои втягиваются друг в друга) - UСТ<0. При A2= 0 перекрытие адсорбционных слоев не приводит к возникновению каких-либо энергетических эффектов. В уравнение Фишера наряду с A2 входят и другие величины, которые также зависят от термодинамического качества растворителя, поскольку оно влияет на адсорбционную способность растворенного вещества. С увеличением величины A2 адсорбционная способность падает и, следовательно, поверхностные слои становятся менее плотными, т.е. уменьшается величина Cδ в уравнении (24). При этом одновременно увеличивается толщина адсорбционных слоев - δ. Таким образом, зависимость величины UСТ от термодинамического качества растворителя может быть неоднозначной.
Необходимо отметить, что уравнение Фишера рассматривает случаи взаимного проникновения адсорбционных слоев без их деформирования, поэтому оно неприменимо при высокой плотности адсорбционных слоев, когда более вероятным является сжатие слоев, а не их взаимное проникновение.
Вытеснительная стабилизация. Рис.20.
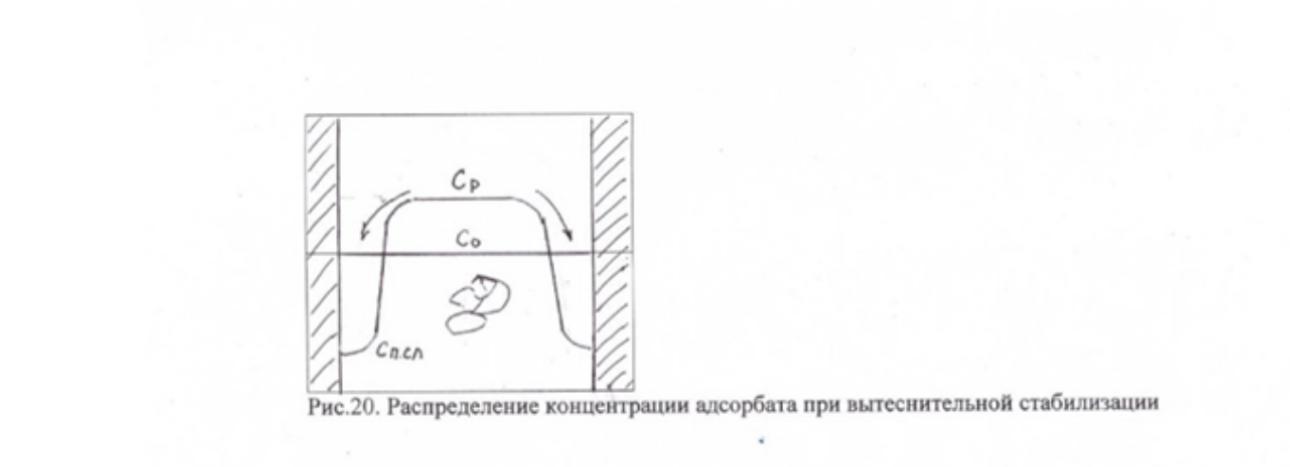
Одним из проявлений действия стерической составляющей является т.н. вытеснительная стабилизация.
В случае адсорбции ионогенных ПАВ или полиэлектролитов, при одноименных зарядах поверхности адсорбента и ионов адсорбата, последние, в результате электростатического отталкивания, «вытесняются» из поверхностного слоя в раствор. В рез-те этого концентрация адсорбата в поверхностном слое СП.СЛ. становиться ниже, чем в равновесной дисперсионной среде СР (имеет место отрицательная гиббсовская адсорбция) (см. рис20).
СР, в свою очередь, оказывается выше начальной концентрации С0 т.е. реализуется следующее соотношение СР> С0 > СП.СЛ..
С увеличением концентрации дисперсной фазы и, следовательно, с уменьшением средних расстояний между частицами, разности (СР - С0) и (СР - СП.СЛ) возрастают.
Появление градиента концентраций (СР - СП.СЛ) приводит к возникновению осмотического потока направленного в зону поверхностного слоя и стремящегося раздвинуть частицы.
Кроме того, увеличение концентрации адсорбата в зазоре между частицами вызывает сжатие клубков макромолекул, снижение молекулярной подвижности их сегментов и, следовательно, приводит к уменьшению энтропии системы, что энергетически не выгодно.
При адсорбции ионогенных ПАВ возможна ситуация, когда начальная концентрация оказывается ниже критической концентрации мицеллобразования С0<СККМ, а равновесная выше СР> СККМ. В этом случае в межчастичном пространстве будут возникать ионные мицеллы ПАВ, отталкивающиеся от частиц в результате действия электростатической составляющей расклинивающего давления.
Все эти факторы работают на отталкивание частиц и могут обеспечивать высокую агрегативную устойчивость дисперсных систем.
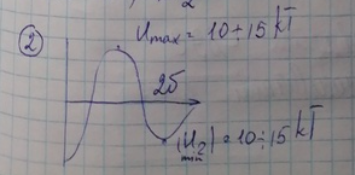
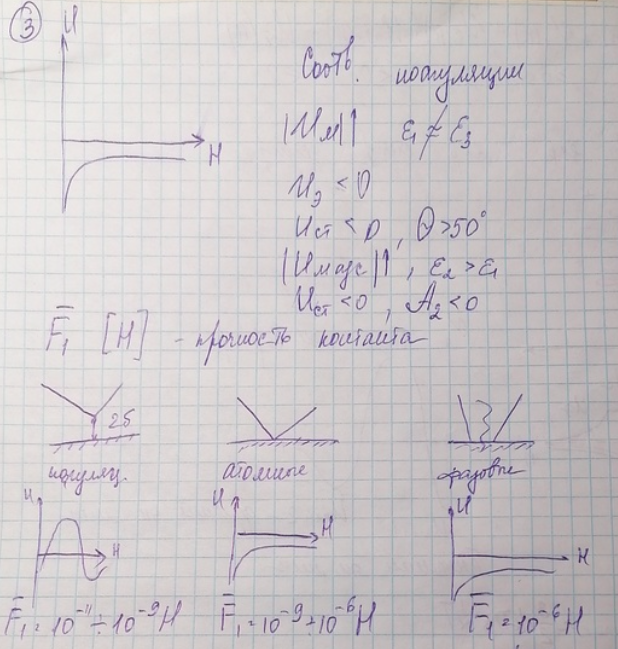
6. Возможные варианты энергетических кривых взаимодействия частиц. При каких условиях реализуется тот или иной вариант U(Н)? Изменением, каких параметров системы можно перейти от одного варианта взаимодействия частиц к другому? Типы межчастичных контактов. Порядок величин прочностей единичных контактов различных типов (F1).
Есть три варианта взаимодействия частиц (рисунки ниже). Условия, при которых реализуется конкретный вариант подписаны под графиком.
Чтобы перейти от 1 варианта к 3, надо повысить ионную силу или добавить растворитель, при котором A2>0. А если идёт обратный переход от 3 к 1, то надо добавить хороший растворитель, увеличить ДЭС и добавить ионных или неионогенных ПАВ, тогда появится ДЭС благодаря ионным ПАВ и сольватный слой благодаря неионогенным.

7. В каких условиях в дисперсных системах при взаимодействии частиц на всех расстояниях между ними могут преобладать силы притяжения (3-й вариант энергетических кривых)? Какие контакты между частицами формируются при этом?
В 3-м варианте вся энергетическая кривая лежит в области отрицательных значений энергии, а энергетический барьер, если он имеется, очень мал (Umax <1-2 kT). В результате этого происходит сближение частиц вплоть до их непосредственного соприкосновения (т.е. коагуляция частиц).
Коагуляция частиц в первом энергетическом минимуме становится возможной при сильном молекулярном притяжении (полярности частиц дисперсной фазы и среды существенно различаются) и слабом электростатическом отталкивании (высокая ионная сила дисперсионной среды, низкое значение поверхностного электрического потенциала). В том случае, если поверхность частиц гидрофобна К<0, частицы могут сближаться до соприкосновения. При К>0 (гидрофильная поверхность) непосредственный контакт частиц невозможен из-за наличия сольватных слоев, в результате частицы фиксируются друг относительно друга на расстояниях в несколько нм.
1 вариант -

2 вариант -

