
- •Глава 1. Микроорганизмы, восстанавливающие и окисляющие серу 4
- •Глава 2. Механизм бактериального окисления 11
- •Глава 3. Круговорот серы в природе 15
- •Введение
- •Глава 1. Микроорганизмы, восстанавливающие и окисляющие серу
- •1.1 Восстанавливающие серу бактерии
- •1.2 Окисляющие серу бактерии
- •Глава 2. Механизм бактериального окисления
- •Глава 3. Круговорот серы в природе
- •Заключение
- •Список литературы
Глава 2. Механизм бактериального окисления
Механизм бактериального окисления и выщелачивания сульфидных минералов можно представить на примере арсенопирита следующим образом с учетом кинетики процесса и особенностей биохимического окисления железа и серы.
Бактериальные клетки сорбируются и прочно закрепляются на поверхности арсенопирита. Под действием химических агентов кислорода и трехвалентного железа, а также биологических агентов ферментативных систем бактерий элементы кристаллической решетки минерала - железо и сера - подвергаются окислению, при этом поверхность минерала разрушается и компоненты кристаллической решетки выщелачивается. Двухвалентное железо, образующееся при этом, входит в состав активного центра фермента, как связующее звено между минералом и ферментом, находясь с обоими в соединении и удерживая субстрат около активного центра фермента. Последующий распад этого комплекса дает конечный продукт окисления - трехвалентное железо. Подобному бактериальному окислению подвергается сульфидная сера, конечным продуктом ферментативного окисления которой является сульфат-ион.
В соответствии с реакцией:
FeAsS > Fe2++ As3+ + S0 + 7e
при электрохимическом процессе на поверхности арсенопирита образуется закисное железо, элементная сера и мышьяковистая кислота:
FeAsS + Fe2(SO4)3 +1,5 H2O + 0,75 O2 = 3 FeSO4 + S0 + 7e
На поверхности арсенопирита железо и сера подвергаются биокаталитическому окислению до соединений высшей степени окисления. Элементная сера под действием серосодержащих ферментов окисляется до сульфат - ионов.
S0 + 4 H2O > SO42- + 8 H+ + 6з
или S0 + H2O + 1,5 O2 = H2SO4
Двухвалентное железо, которое образуется при деструкции кристаллической решетки минерала за счет восстановления трехвалентного железа арсенопирита с принятием электронов от серы и мышьяка, окисляется микроорганизмами до трехвалентного в диффузионном слое минерала и при выходе его из минерала в объеме раствора:
2 FeSO4 + 0,5 O2 + H2SO4 > Fe2(SO4)3 + H2O.
Окисное железо при этом частично переходит в раствор и остается в диффузионном слое минерала, что обеспечивает его быстрое взаимодействие с сульфидной поверхностью.
Мышьяк в растворе присутствует в виде мышьяковистой кислоты, т.к. он может существовать в виде катиона только в сильнокислых растворах:
As3+ + 3 H2O = AsO33- + 6 H+ = H3AsO3 + 3 H+
Мышьяковистая кислота, в свою очередь, окисляется до мышьяковой кислородом:
H3AsO3 + 0,5 O2 > H3AsO4.
При наличии в растворе окисного железа образуется арсенат:
Fe3+ + H2AsO4- > FeAsO4 + 2 H+.
Таким образом, конечными продуктами бактериального окисления и выщелачивания арсенопирита являются арсенат железа и серная кислота:
FeAsS + 3,5 O2 + H2O > FeAsO4 + H2SO4.
Схематическая модель механизма бактериального окисления арсенопирита представлена на рис.1, где показана тесная связь процессов биологического характера и связанных с ними электрохимических процессов на поверхности арсенопирита и в объеме жидкой фазы. Поэтому ускорение ферментативными системами бактерий электрохимических реакций окисления сульфидных минералов можно назвать биоэлектрокатализом.
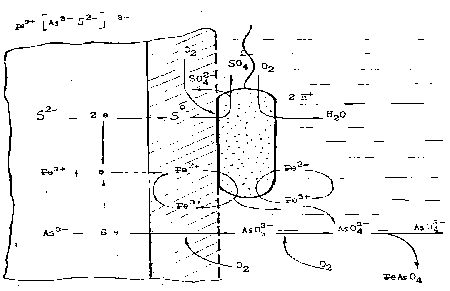
Рисунок 1. Схематическая модель процесса бактериального окисления и выщелачивания арсенопирита
Подобный механизм бактериального окисления и выщелачивания сульфидных минералов характерен и для других минералов, как содержащих в своей структуре железо, так и не имеющих его.
Однако в рассматриваемом механизме не учитывается один немаловажный фактор - наличие в выщелачиваемом материале нескольких сульфидных минералов, которые отличаются своими электрохимическими характеристиками, а, следовательно, находясь в пульпе в присутствии бактерий, оказывают взаимное влияние на окисление и выщелачивание друг друга.
Сера, как известно, входит в состав сульфидных минералов в виде S2- . При бактериальном окислении сульфидов окисление сульфидной серы до элементной происходит при электрохимической реакции окисления сульфидной поверхности и под действием бактерий, например:
FeS2 + Fe2(SO4)3 = 3FeSO4+2S
при участии ферментов - сульфидооксидазы и полисульфидооксидазы. Окисление этой серы бактериями сопряжено также с генерацией АТФ.
Образующаяся элементная сера является единственным твердым продуктом окисления таких сульфидных минералов, как арсенопирит, пирит, пирротин, халькопирит и др. Элементная сера переходит в пульпу при выщелачивании в виде отдельных агрегатов, а также покрывает поверхность минералов. На этой сере происходит адгезия минеральных клеток, которые при таком непосредственном контакте осуществляют ее окисление до сульфат - ионов. Следует учитывать, что при бактериальном окислении таких хорошо окисляющихся минералов, как пирротин, образуется большое количество элементной серы, которая является хорошим субстратом для бактерий А. thiooxidans. Поэтому в жидкой фазе пульпы количество этих бактерий увеличивается до 109-1010 кл/мл.
Общая схема бактериального окисления сульфидной серы может быть представлена в виде:
S2- > Sо > SO32-> SO42-
Ромбическая элементная сера перед окислением ее ферментами должна быть в таком состоянии, при котором возможно ее растворение липидами и фосфолипидами микробного синтеза. Поэтому при бактериальном окислении сульфидной серы образуется элементная сера в-модификации, которая хорошо растворяется в таких органических растворителях как липиды и фосфолипиды. Сера в-модификации, растворенная компонентами мембраны клеток, транспортируется в периплазматическое пространство клетки, где окисляется на наружной стороне цитоплазматической мембраны и на ее инвагинатах при участии ферментов. [3]
