
pdf.php@id=6179
.pdfОборудование:
1)штатив с пробирками;
2)пипетки;
3)воронки для фильтрования;
4)бумажные фильтры.
Ход работы
1. Осаждение белков спиртами
Метод основан на способности органических спиртов нарушать гидрофобные взаимодействия внутри белковой молекулы и вызывать ее денатурацию, что приводит к снижению растворимости и выпадению осадка белка.
При осаждении спиртом раствор белка должен быть нейтральным или слабокислым, но не щелочным. Реакция происходит лучше в присутствии электролита (например, хлорида натрия) вследствие снятия заряда с частиц белка.
Реакция осаждения белка спиртом при кратковременном действии спирта на холоду обратима. Если осадок быстро отделить от спирта, то белок сохранит нативное состояние и может быть вновь растворен в воде. При длительном воздействии спирта наступает необратимаяреакцияосаждения, т.е. денатурациябелка.
К 5 каплям раствора исследуемого белка приливают 15–20 капель этилового спирта. Раствор мутнеет. Добавляют 1 каплю насыщенного раствора хлорида натрия. При стоянии выпадает осадок белка.
2. Осаждение белков органическими кислотами
Метод основан на способности органических кислот вызывать нейтрализацию заряда молекулы белка и разрушать ее пространственную структуру, что приводит к денатурации и осаждению белка. Органические кислоты вызывают необратимое осаждение белков.
Трихлоруксусная кислота способна осаждать только белки и не осаждает продукты распада белков. При использовании трихлоруксусной кислоты в качестве осадителя удается отдель-
61
но определить содержание азота белков и азота других азотсодержащих веществ (мочевины, аминокислот и др.), присутствующих в растворе.
К5 каплям исследуемого раствора белка добавляют 2 капли 10%-ного раствора трихлоруксусной кислоты. Выпадает осадок белка.
3. Осаждение белков сульфатом аммония
В пробирку наливают 2–3 мл раствора белка, добавляют равный объем насыщенного раствора сульфата аммония и перемешивают. Выпадает осадок глобулинов, альбумины остаются в растворе. Осадок отфильтровывают через бумажный фильтр.
Кфильтрату малыми порциями при перемешивании добавляют тонко растертый порошок сульфата аммония до получения насыщенного раствора (т.е. до тех пор, пока последняя порция соли уже не будет растворяться). Выпадает осадок альбуминов, который также отфильтровывают.
С фильтратом проделывают биуретовую реакцию: в пробирку наливают 2 мл фильтрата, затем прибавляют равный объем раствора гидроксида натрия и 1–2 капли раствора сульфата меди. Если произошло полное осаждение белков, то биуретовая реакция будет отрицательной, т.е. сине-фиолетовоеокрашиваниенепроявится.
4. Осаждениебелковсульфатоммагнияихлоридомнатрия
В две пробирки наливают по 2–3 мл раствора яичного белка и добавляют малыми порциями при перемешивании (до получения насыщенного раствора) в одну пробирку порошок хлорида натрия, в другую – сульфата магния. Через 5–6 мин в пробирках начинается выпадение осадка глобулинов. Альбумины в нейтральных растворах солей щелочных и щелочно-земельных металлов не осаждаются.
Содержимое пробирок отфильтровывают через бумажные фильтры. Фильтраты подкисляют 1%-ным раствором уксусной кислоты, при этом появляется осадок альбуминов. Осадок отфильтровывают, а в фильтратах с помощью биуретовой реакции доказывают отсутствие белка.
62
Указания к составлению отчета Результаты работы записать в табл. 2.
Таблица 2
Осаждение белков под действием различных высаливающих веществ
Высаливающее вещество |
Степень насыщения |
Осаждаемая |
|
раствора |
фракция белков |
||
|
|||
Этиловый спирт |
|
|
|
Трихлоруксусная кислота |
|
|
|
(NH4)2SO4(нейтральная среда) |
Неполное насыщение |
|
|
(NH4)2SO4(кислая среда) |
Полное насыщение |
|
|
NaCl (нейтральная среда) |
Полное насыщение |
|
|
NaCl (кислая среда) |
Полное насыщение |
|
|
MgSO4 (нейтральная среда) |
Полное насыщение |
|
|
MgSO4 (кислая среда) |
Полное насыщение |
|
В выводе указать возможность разделения белков методом высаливания, принцип его и отличия от осаждения путем денатурации.
Вопросы для самостоятельной работы
кразделу «Аминокислоты и белки»
1.На чем основано хроматографическое разделение аминокислот?
2.Почему для хроматографии используется смесь растворителей?
3.На чем основана классификация цветных реакций?
4.Какую из цветных реакций лучше всего использовать для определения концентрации белка? Почему?
5.На чем основана нингидриновая реакция?
6.Где на практике применяют цветные реакции на белки?
7.Что такое коэффициент Rf?
8.Как связаны между собой остатки аминокислот в молекуле белка?
63
9.Почему для проведения биуретовой реакции нужна щелочная среда?
10.Будет ли протекать нингидриновая реакция с β-алани-
ном?
11.Какие серосодержащие аминокислоты вы знаете?
12.В чем преимущество определения концентрации веществ по стандарту перед определением по калибровочному графику?
13.Что такое кислый, основной и нейтральный белок? Приведите примеры аминокислот, определяющих эти свойства белков.
14.Белок куриного яйца содержит в своем составе в основном моноаминодикарбоновые аминокислоты. Какой заряд имеет молекула такого белка? Какова реакция среды в растворе яичного белка? При каких условиях этот белок достигает изоэлектрической точки?
15.Как объяснить, что белок молока казеин при кипячении сворачивается (выпадает в осадок), если молоко кислое?
64
Раздел V. ФЕРМЕНТЫ
Ферменты – биологические катализаторы белковой природы. Они присутствуют во всех тканях, клетках, внутриклеточных органеллах и биологических жидкостях. Благодаря ферментам обмен веществ в живых организмах протекает с большой скоростью при температуре тела и без участия сильнодействующих химических реагентов.
Ферменты как катализаторы: 1) не вызывают каких-либо реакций, невозможных по термодинамическим законам; 2) увеличивают скорость как прямой, так и обратной реакции обратимого химического процесса; 3) остаются химически неизменными; 4) в очень малых количествах способны превращать несоизмеримо большие массы субстратов.
Согласно современным представлениям ферменты увеличивают скорость химической реакции, снижая энергетический барьер данной реакции. Ведущую роль в механизме ферментативного катализа играют промежуточные фермент-субстратные комплексы, образование которых определяется тонкой структурой активного центраиуникальнойструктуройвсеймолекулыфермента.
Ферменты делят на простые и сложные. У простых функции контактных и каталитических групп активного центра определяются только радикалами аминокислотных остатков, у сложных ферментов активный центр включает также коферменты и ионы металлов.
Ферменты локализованы во всех отделах клетки. Значительная их часть ассоциирована с мембранами. В клетке ферменты обычно собраны в полиферментные комплексы. Такие комплексы представляют собой ряд ферментов, катализирующих согласованные реакции, причем конечные продукты одной реакции являются исходными субстратами для следующих реакций. Полиферментные системы могут быть растворены в цитоплазме, и субстраты перемещаются от одного фермента к другому посредством простой диффузии (ферменты гликолиза).
65
Ферменты могут быть соединены друг с другом за счет белокбелковых взаимодействий (синтазный комплекс жирных кислот). Также ферменты могут быть в определенном порядке иммобилизированы на мембране (дыхательная цепь).
Современная номенклатура ферментов допускает старые тривиальные названия (папаин, пепсин, трипсин, цитохромы) и названия по рациональной номенклатуре, согласно которой название фермента составляется из названия субстрата и окончания -аза (амилаза, липаза, протеаза). По научной номенклатуре название фермента составляют из химического названия субстрата, акцептора и названия той реакции, которая осуществляется ферментом, например, L-аланин: 2-оксоглутаратаминотрансфераза.
Существует Международная классификация ферментов. Согласно ей все ферменты включены в «Каталог ферментов» под своим классификационным номером, состоящим из четырех цифр. Первая цифра указывает на принадлежность к одному из шести главных классов. Следующие две определяют подкласс и подподкласс, а последняя цифра – номер фермента в данном подподклассе. Например, лактатдегидрогеназаимеетномер КФ1.1.1.27.
В основу классификации ферментов положен тип реакций, подвергающихся каталитическому воздействию. Выделяют следующие классы ферментов:
1.Оксидоредуктазы катализируют окислительно-восстано- вительные реакции.
2.Трансферазы переносят ту или иную функциональную группу от одного субстрата к другому.
3.Гидролазы также участвуют в переносе групп, однако акцептором всегда является молекула воды.
4.Лиазы (синтазы) катализируют расщепление или образование химических соединений или образование химических связей, при этом образуются или исчезают двойные связи.
5.Изомеразы перемещают группы в пределах одной моле-
кулы.
66
6. Лигазы (синтетазы) катализируют энергозависимые реакции присоединения, и поэтому их действие сопряжено с гидролизом АТФ.
На практике наиболее широко применяют ферменты класса гидролаз, например, амилазы используют для гидролиза крахмалсодержащего сырья с получением глюкозы. Процесс пищеварения у человека начинается в ротовой полости, поскольку в слюне содержится фермент амилаза, который начинает расщеплять содержащийся в пище крахмал.
Лабораторная работа № 12 Действие амилазы на крахмал
Цель работы – исследовать скорость гидролиза крахмала под действием амилазы.
Теоретические сведения
При взаимодействии раствора I2 с крахмалом образуется адсорбционное соединение сложного состава, имеющее синий цвет. Реакция экзотермическая. Равновесие этой реакции можно условно представить следующей схемой:
I2 + (C6H12O6)n  йодокрахмальный комплекс.
йодокрахмальный комплекс.
При воздействии амилазы на крахмал происходит разрыв ковалентных гликозидных связей в молекуле полимера. Амилазы относятся к классу ферментов гидролаз. Реакции гидролиза, катализируемые этими ферментами, идут по общей схеме:
R–R1 + H–OH  R–H + R1–OH
R–H + R1–OH
R–O–R1 + H–OH  R–OH + R1–OH
R–OH + R1–OH
Гидролиз крахмала амилазой протекает через образование ряда промежуточных продуктов реакции до конечных продуктов – мальтозы и глюкозы. В ходе реакции гидролиза сначала
67
образуются амилодекстрины (фиолетово-синие продукты), затем – эритродекстрины (красно-бурые продукты) и, наконец, ахродекстрины (желто-бурые продукты), а также мальтоза и глюкоза. Промежуточные продукты гидролиза определяются по цвету реакции, которую они дают с йодом. Конечные продукты – мальтоза и глюкоза – имеют свободные альдегидные группы и могут быть обнаружены реакцией Троммера, в основе которой лежит окислительно-восстановительный процесс. При этом альдегидная группа окисляется до глюконовой кислоты, а ионы меди (CuОН)+ голубого цвета восстанавливаются в гидрат закиси меди (I) желтого цвета. При нагревании гидрат закиси меди переходит в красную закись меди (I).
Исследуемый материал: слюна, разведенная водой в 5 раз. Реактивы:
1)0,5%-ный раствор крахмала;
2)0,1 %-ный раствор I2;
3)10%-ный раствор NaOH;
4)7%-ный раствор CuSO4.
Оборудование:
1)спиртовка;
2)штатив с пробирками;
3)пипетки.
Техника безопасности. На занятиях предусматривается пользование спиртовками. Будьте внимательны при нагревании пробирок с реактивами.
Ход работы В 5 пробирок наливают по 2 мл 0,5%-ного раствора крахмала,
затем быстро прибавляют, начиная от 1-й к 5-й пробирке, по 2 капли слюны. В 1-ю пробирку сразу вносят каплю 0,1%-ного раствора I2, в остальные пробирки раствор I2 добавляют с интервалами через 30 с. Еще в одной пробирке проводят холостой опыт
68
(без слюны): наливают 2 мл 0,5%-ного раствора крахмала и добавляют каплю 0,1%-ного раствора I2.
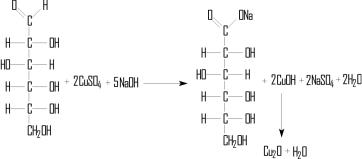
В пробирке, где желтый цвет раствора I2 не изменяется, гидролиз считают законченным. Затем проводят реакцию Троммера. Пробирку с продуктами реакции немного подогревают – йод улетучивается. Прибавляют 4–5 капель 10%-ного раствора NaOH и 5–7 капель 7%-ного раствора CuSO4. Содержимое пробирок нагревают до кипения. Выпадает желтый (красный) осадок закиси (окиси) меди, так как глюкоза обладает восстановительными свойствами. Схема процесса имеет вид:
Глюконовая кислота в виде D-глюконата Na
Указания к составлению отчета Результаты опыта занести в табл. 3 и сделать вывод о ско-
рости гидролиза крахмала под действием амилазы.
Таблица 3
Скорость гидролиза крахмала под действием амилазы
Номер |
Время |
Амилозная реакция |
Продукты |
Реакция |
пробирки |
инкубации |
(окраска раствора с I2) |
гидролиза |
Троммера |
(+ или –) |
||||
|
|
|
|
|
69
Лабораторная работа № 13 Количественное определение активности амилазы слюны
Цель работы – научиться приемам количественного определения активности амилазы слюны по Вольгемуту.
Теоретические сведения Об активности фермента судят по количеству субстрата,
изменяющегося под влиянием фермента в единицу времени. За изменением субстрата в присутствии фермента можно следить по появлению в растворе тех или иных продуктов реакции.
Метод количественного определения активности амилазы слюны по Вольгемуту заключается в том, что слюну разводят в определенной последовательности, после чего одно и то же количество крахмала приливают, определяют наименьшее содержание фермента, которое полностью расщепляет все количество добавленного крахмала, затем производят расчет на 1 мл слюны.
Амилазная активность слюны в данной работе выражается количеством 0,5%-ного раствора крахмала в миллилитрах, которое может расщепить 1 мл слюны при температуре 37 °С в течение 30 мин.
Исследуемый материал: слюна, разведенная водой в 10 раз. Реактивы:
1)0,5%-ный раствор крахмала;
2)0,5%-ный раствор I2;
3)вода дистиллированная.
Оборудование:
1)штатив с пробирками;
2)пипетки.
Ход работы
В9 пронумерованных пробирок наливают по 1 мл воды.
В1-ю добавляют 1 мл слюны, разведенной в 10 раз, перемеши-
70
