
2.4
.docx1) На чем основана принципиальная возможность электрохимического получения дихромата калия из водного раствора хромата калия? Какие условия необходимы для этого?
Для осуществления данной реакции необходимо разделить анодное и катодное пространство. Для того что бы на аноде выделялся H+ и в кислой среде образовывался дихромат. Диафрагма в данном случае не подойдёт так, как ионы OH- будет нейтрализовать ионы H+, образуя нейтральную среду, в следствии чего будет протекать нежелательная побочная реакция.
2) Что такое число переноса иона?
Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому возникает вопрос, каково участие в этом процессе ионов каждого знака.
Количество переносимого электричества определяется концентрацией ионов и скоростью их движения; когда концентрации катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Т.к. скорости движения катионов и анионов могут быть существенно различными, потому и числа переноса должны быть разными. Это было установлено Гитторфом (1854).
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов
3) Чем ограничено значение выхода по току при получении дихромата калия в условиях опыта?
Выход по току ограничен переносом ионов OH-
4) Какие реакции протекают на катоде и аноде в условиях опыта, а также в случаях использования в качестве электролита нейтрального раствора хромата калия (письменно)?
Первичный процесс
![]()
![]()
Вторичный процесс
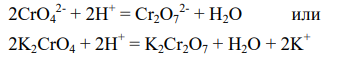
Побочная реакция (нейтральный раствор хромата калия)
![]()
5) Какие процессы протекают на электродах кулонометра? На чем основана возможность измерения с его помощью количества электричества, прошедшего через электролизер? Электродные процессы – письменно
Электролиз раствора соли CuSO4
CuSO4 ↔ Cu2 + SO42
катод (–) Cu2 + 2ē → Cu0
анод (+) 2H2O – 4ē → 4H + O2 ↑
6) Что лежит в основе расчета выхода по току K2Cr2O7? Как выводятся формулы, рекомендованные для расчета выхода по току и расхода электроэнергии? Какие формулы можно использовать еще для этих расчетов?
Результаты опыта вносят в таблицу и рассчитывают выход дихромата по току, а также расход электроэнергии на одну тонну, основываясь на том, что приращение количества KOH во время электролиза соответствует количеству образовавшегося K2Cr2O7. Выход по току может быть рассчитан по формуле:
![]()
где ηт – выход дихромата по току, %.
νOH –количество молей в катодном пространстве, расчет см. ниже;
F – число Фарадея (96500 К или 26.8 А*ч)
Qпр – количество электричества, прошедшее через электролизер в ходе процесса, А*час.
В частном случае, когда количество электричества определяется по кулонометру (по закону Фарадея, исходя из прироста меди в медном кулонометре, расчет может быть произведен по формуле
![]()
n – число электронов, которые принимают участие в соответствующей электрохимической реакции
Эх – химический эквивалент меди, г
7) Перечислите меры безопасности при проведении работы.
8) Что такое вторичный процесс? Приведите примеры вторичных катодных или анодных процессов.
Вторичный процесс это когда на катоде или аноде образуются ионы, которые в дальнейшем взаимодействуют с раствором.
9) Почему в работе используют в качестве анода платиновый электрод?
Платиновый электроды обладают тем преимуществом, что исключают возможность загрязнения раствора посторонними ионами во время электролиза
10) Какой объем 0.1 М HCl необходим для титрования 1 М раствора щелочи, если объем аликвоты 1 мл. Напишите реакцию.
11) От чего зависит числа переноса ионов?
Числа переноса ионов зависят от природы иона и растворителя, заряда иона, температуры, концентрации электролита
http://irbis.bti.secna.ru/doc7/2017-02.pdf#:~:text=Числа%20переноса%20ионов%20зависят%20от,(14)%20и%20учитывая%20условие%20электро-
с. 16
12) С какой целью в работе разделяют анодное и катодное пространства?
Для того чтобы OH- ионы не нейтрализовали ионы H+, и не проходила побочная реакция
