
Коллоквиум РЗМ
.docx1.Электронное строение атомов РЗЭ.
1s22s22p63s23p63d104s24p64d104fn 5s25p65dm6s2
[Xe] 4fn5dm6s2,
n = 0 – 14, m = 0 – 1
РЗЭ |
Название |
Атомный номер |
Электронная конфигурация |
Окраска иона Ln(III) |
|
атом |
Ион Ln(III) |
||||
La |
Лантан |
57 |
[Xe] 5d16s2 |
[Xe] |
Бесцветная |
Ce |
Церий |
58 |
[Xe] 4f15d16s2 |
[Xe] 4f1 |
Бесцветная |
Pr |
Празеодим |
59 |
[Xe] 4f36s2 |
[Xe] 4f2 |
Зеленая |
Nd |
Неодим |
60 |
[Xe] 4f46s2 |
[Xe] 4f3 |
Красно-фиолетовая |
Pm |
Прометий |
61 |
[Xe] 4f56s2 |
[Xe] 4f4 |
Розовая |
Sm |
Самарий |
62 |
[Xe] 4f66s2 |
[Xe] 4f5 |
Желтоватая-зеленая |
Eu |
Европий |
63 |
[Xe] 4f76s2 |
[Xe] 4f6 |
Желтая |
Gd |
Гадолиний |
64 |
[Xe] 4f75d16s2 |
[Xe] 4f7 |
Бесцветная |
Tb |
Тербий |
65 |
[Xe] 4f96s2 |
[Xe] 4f8 |
Розовато-желтая |
Dy |
Диспрозий |
66 |
[Xe] 4f106s2 |
[Xe] 4f9 |
Зеленоватая |
Ho |
Гольмий |
67 |
[Xe] 4f116s2 |
[Xe] 4f10 |
Бежево-желтая |
Er |
Эрбий |
68 |
[Xe] 4f126s2 |
[Xe] 4f11 |
Розовая |
Tm |
Тулий |
69 |
[Xe] 4f136s2 |
[Xe] 4f12 |
Бледно-зеленая |
Yb |
Иттербий |
70 |
[Xe] 4f146s2 |
[Xe] 4f13 |
Бесцветная |
Lu |
Лютеций |
71 |
[Xe] 4f145d16s2 |
[Xe] 4f14 |
Бесцветная |
Y |
Иттрий |
39 |
[Kr] 4d15s2 |
[Kr] |
Бесцветная |
Все редкоземельные элементы имеют устойчивую степень окисления Ln3+.
58Ce имеет на 4f-подуровне 2ē, поскольку 5d1ē перемещается на 4f-
подуровень. Это определяет существование соединений церия, в которых степень окисления металла равна 4+.
До 63Eu идет последовательное заполнение 4f-уровня вплоть до f7. 62Sm и 63Eu существуют в степенях окисления 2+.
Следующий ē появляется у Gd не на 4f-подуровне, а на 5d (5d1)- уровне из-за стремления к сохранению наиболее устойчивой конфигурации (правило Хунда2).
У 65Tb имеет место «перескок» ē (аналог Ce), 5d ē «перескакивает»
на 4f-уровень.
Причина наибольшей устойчивости соединений РЗЭ со степенью окисления металла +3 состоит в том, что в изолированном атоме РЗЭ всегда есть неспаренный (n-1)d1- или (n-2)f14-x электрон, связанный не очень прочно (x – число ē, недостающих до 14). В IIIВ3-подгруппе Периодической (полу- длинная форма) системы при движении сверху вниз заполнение электронных оболочек может быть выражено как (n-1)d1ns2, что строго вписывается в клас- сическое определение переходных элементов.
При этом следует указать, что La (6s2 5d1) не имеет f-электронов, од- нако является родоначальником ряда и проявляет единственную и устойчивую степень окисления La3+; Lu (6s2 5d1 4f14) имеет завершенную f-оболочку. Кроме того, к группе РЗЭ, на основании близости свойств (ионный радиус Y3+, устой- чивая степень окисления 3+, совместное нахождение в рудах и т.д.) относят 39Y (5s2 4d1) и, иногда, 21Sc (4s2 3d1), хотя его химию и технологию правомернее рассматривать отдельно.
d-Металлы IIIB-подгруппы, будучи полными электронными аналога- ми с электронной конфигурацией (n-1)d1ns2 (21Sc 3d14s2; 39Y 4d15s2; 57La 5d16s2; 89Ac 6d17s2), имеют много общего в химических свойствах.
Хотя формально эти элементы относят к переходным элементам (d-оболочка заполнена частично), в соединениях, в которых они проявляют положительную степень окисления (3+), d-электроны отсутствуют и практически не влияют на их химию. Именно поэтому свойства соединений элементов третьей группы значительно отличаются от химии переходных металлов.
«Аномальные», отличные от 3+, степени окисления РЗЭ
-
Sm
Eu
Gd
Tb
6s
2
2
2
2
5d
0
0
1
0
4f
6
7
7
9
используют в технологии – товарными формами являются CeO2, Pr6O11, Tb4O7. Наличие у церия соединений, в которых степень окисления металла 4+, позво- ляет в технологических процессах выделить его на начальных этапах. Суще-ствование дихлоридов самария и европия не позволяет получать металлы вос- становлением трихлоридов – восстановление идет только до дихлоридов.
2.Химические свойства РЗЭ и их основных соединений.
Электродные потенциалы РЗЭ и Sc имеют отрицательные значения.
Металлические Ln взаимодействуют с:
Ln + H2O → Ln(OH)3 + H2
Ln + HCl → LnCl3 + H2
Ln + HF ⇏
Ln + H3PO4 ⇏
Ln + NaOH ⇏
Ln + O2 → Ln2O3
La, Сe, Pr, Nd – окисляются при 20-25°С
Sm – Lu – окисляются при 200°С Y – устойчив до 1000°С
Редкоземельные элементы образуют три ряда оксидов:
Ln2O3 (Ln = 57La … 71Lu, кроме Ce, Pr, Tb), LnO и CeO2-x, Pr6O11 и Tb4O8
 Оксиды
Ln2O3 получают термическим
разложением:
Оксиды
Ln2O3 получают термическим
разложением:
Свойства получаемых таким образом Ln2O3 зависят от температуры процесса – чем она выше, тем труднее они растворяются в HNO3, HCl.
Ln2O3 – типичные основания, основной характер которых ослабевает с увеличением порядкового номера РЗЭ.
Ln2O3, прежде всего цериевой подгруппы, на воздухе медленно поглощают пары воды с образованием последовательно гидратированных оксидов, гидроксид-оксидов, а при кипячении в воде – в гидроксидов. (уравнение 13):
Ln2O3 + nH2O → Ln2O3·nH2O → LnO(OH)·mH2O → Ln(OH)3. (13)
Ln2O3 плохо (10-5÷10-6 моль/л) растворяются в воде.
Наименьшая скорость гидратации (и карбоназации) характерна для Yb и Lu, т. к. они имеют наименьшие ионные радиусы. Реакционная способность Ln2O3 тем меньше, чем прочнее кристаллическая структура Ln2O3. При ионном типе связи в Ln2O3 это определяется кулоновским взаимодействием Ln3+ и O2-, которое тем сильнее, чем меньше размеры взаимодействующих ионов.
Термическое разложение на воздухе Ln2(CO3)3, Ln2(C2O4)3 ведет к образованию CeO2-x, Pr6O11 и Tb4O7. Близкие к стехиометрическим оксиды LnO2 (Ln = Pr, Tb) получают обработкой Pr6O11 и Tb4O7 кислородом под давлением > 10 мПа при 500–600°C в течение 8–10 часов. Кристаллическая структура PrO2 и TbO2 подобна структуре CeO2.
Монооксиды LnO наиболее устойчивы для Sm, Eu, и Yb. Их получают восстановлением соответствующих Ln2O3 в вакууме или аргоне при > 1000°C:
Eu2O3 + R (La, LiH, C) → EuO + … . (14)
EuO – фиолетово-черный порошок, структура NaCl, по свойствам очень близок к оксидам щелочноземельных элементов.
Нестехиометрия CeO2-x, PrOx (x < 2), TbOx (x < 2).
Кислород-дефицитные нестехиометрические фазы, существующие в широком интервале концентраций, найдены в системах Ln-O (Ln = Ce, Pr, Tb). Нестехиометрические фазы образуются при высоких температурах. При низких температурах образуется серия (гомологический ряд) дискретных фаз с общей формулой LnO2n-2 (Ce190O378, Ce100O198, Ce78O150, Ce68O134, Ce56O110).
Гидроксиды РЗЭ
Ln(OH)3·nH2O образуются в виде гелеобразных осадков при взаимодействии хорошо растворимых (Ln(NO3)3, LnCl3) солей РЗЭ с растворами аммиака. При этом вначале образуется гидроксосоли. При стоянии под маточником – «старение» осадков – образуются Ln(OH)3. Для членов цериевой подгруппы время «старения» измеряется часами, для
«тяжелых» элементов – месяцами.
В состав гидроксосолей LnA3-x(OH)x (A = NO3-, Cl- и т. д.) входят посторонние ионы, которые трудно отмываются, т. к. они связаны с Ln3+ связями, энергии которых сопоставимы со связями Ln-OH. Процесс «старения» состоит в замене «оловых» мостиков на оксо-мостики. Этот процесс называется оксоляцией:
-

(16)
Ln(OH)3·mH2O плохо растворимы в воде, что объясняется и их цепочечным строением – ионы гидроксила образуют «оловые» мостики, сшивающие Ln(OH)3 в полимер [Ln(OH)3]n.
В ряду Ln3+ pH осаждения уменьшается от 7,82 для 57La до 6,83 для 64Gd и 6,30 для 71Lu. Общее уменьшение значения pH осаждения составляет 1,5–2,0 единицы. Эту разницу пытались использовать для разделения РЗЭ методом
«возникающего» реагента (гомогенного осаждения). В качестве осадителя использовали амид угольной кислоты – мочевину (O=C(NH2)2), которая в водном растворе при нагревании гидролизуется:
-

(17)
H2CO3 = H2O + CO2 (18)
Образующийся аммиак обеспечивает плавное и равномерное в объеме раствора повышение pH. Даже в этих щадящих условиях разделение не достигается. Причиной потери индивидуальности отдельных членов ряда РЗЭ являются процессы оляции и оксоляции.
Гидроксид Ce4+ – Ce(OH)4·mH2O – осаждается при pH = 0,7÷1,0, т. е. в условиях, близких к осаждению Ti(OH)4 (строже TiO2·H2O – гидратированный оксид Ti4+).
Гидроксиды лантанидов, как исходные вещества для синтеза других соединений:
позволяют снизить температуру синтеза различных оксидных соединений;
позволяют уменьшить продолжительность синтеза.
Соли кислородсодержащих кислот
РЗЭ в степени окисления Ln3+, Ln4+ и Ln2+ образуют соли с кислородосодержащими кислотами. Их получают взаимодействием Ln2O3, Ln(OH)3 с кислотами. В этом разделе рассмотрены соли, которые играют важную роль в технологии РЗЭ: сульфаты, нитраты, карбонаты, оксалаты, фосфаты.
Сульфаты (Ln2(SO4)3·8H2O) довольно хорошо растворимы (S моль/л) в воде. Зависимость S от порядкового номера Ln выявить не удалось. Простые сульфаты имеют отрицательный температурный коэффициент растворимости: При повышении температуры от 25°C до 75°C растворимость уменьшается в 2÷2,5 раза. Двойные сульфаты РЗЭ и щелочных металлов xLn2(SO4)3·yM2SO4·nH2O (x:y = 1:1, 1:5, 2:3) демонстрируют четкую зависимость растворимости от порядкового номера Ln: xLn2(SO4)3·yM2SO4 (Ln = La …, Eu) плохо растворимы в воде (для Sm растворимость при 25°C составляет 0,5 г/л). Ln2(SO4)3·K2SO4 (Ln = Gd … Lu) хорошо растворимы в воде (для Gd растворимость равна 7,7 г/л). Отличия в растворимости используют для грубого разделения РЗЭ на подгруппы. В этом случае технологическая концепция предполагает вначале разделение на подгруппы, а затем тонкое разделение.
При обработке CeO2 или Ce(OH)4 концентрированной H2SO4 получают Ce(SO4)2. Из раствора он выделяется в виде кристаллогидрата Ce(SO4)·4H2O, изоморфного M(SO4)2·4H2O (M = Ti, Zr).
Sm и Eu образуют LnSO4 при восстановлении соответствующих сульфатов в степени окисления 3+ в ацетатных растворах электрохимически, амальгамой натрия или цинковой пылью в случае европия. Это имеет технологические приложения.
 Нитраты
РЗЭ – наиболее широко используемые
хорошо растворимые (до ~300 г/л) соединения
РЗЭ. Их получают при взаимодействии
Ln2O3,
Ln(OH)3, Ln2(C2O4)3 с HNO3. По ряду РЗЭ температура разложения
уменьшается. Процесс разложения
описывается схемой:
Нитраты
РЗЭ – наиболее широко используемые
хорошо растворимые (до ~300 г/л) соединения
РЗЭ. Их получают при взаимодействии
Ln2O3,
Ln(OH)3, Ln2(C2O4)3 с HNO3. По ряду РЗЭ температура разложения
уменьшается. Процесс разложения
описывается схемой:
В водных растворах ионы Ln3+ образуют с ионами NO3- малоустойчивые анионные и катионные комплексы [Ln(NO3)n]3-n, где n = 1–6.
Карбонаты РЗЭ – практически нерастворимы в воде. Их получают осаждением (pH = 4,7÷5,6) из растворов солей Ln3+ карбонатами: (NH4)2CO3, Na2CO3 или K2CO3. В зависимости от условий проведения процесса – соотношения реагентов, температуры, концентрации исходного раствора и т. д. – могут быть получены средние карбонаты Ln(CO3)3·xH2O, гидроксокарбонаты Ln(OH)CO3·xH2O (pH ≥ 12) и двойные карбонаты.
В технологическом плане существенно важны различия в свойствах карбонатов РЗЭ и карбонатов тория и урана, которые постоянно сопутствуют РЗЭ в первичных сырьевых источниках. Уран и торий образуют прочные, хорошо растворимые комплексы [UO2(CO3)n]2-2n и [Th(CO3)n]4-2n, где n = 1÷5. Эти различия в растворимости используют в технологии для отделения Th и U от РЗЭ.
При нагревании Ln2(CO3)3·xH2O разлагаются по схеме:
![]()
Церий образует CeO2.
Соединения с карбоновыми кислотами
РЗЭ взаимодействуют с карбоновыми кислотами: муравьиной (HCOOH), уксусной(CH3COOH) и щавелевой (H2C2O4) с образованием соответствующих солей. Наибольшее технологическое значение имеют оксалаты (производные щавелевой кислоты) РЗЭ. Им посвящено дальнейшее изложение.
При добавлении к растворам солей РЗЭ H2C2O4 при pH 2–3, осаждается Ln2(C2O4)3·mH2O (m = 6÷10 зависимости от условия осаждения). Растворимость (S, г/л в пересчете на Ln2O3) составляет:
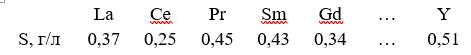
Растворимость Ln2(C2O4)3·mH2O уменьшается при добавлении избытка осадителя, но увеличивается в присутствии (NH4)2C2O4 за счет образования комплексных ионов [Ln(C2O4)n]3-2n, где n = 2, 3. С увеличением порядкового номера Ln рост растворимости увеличивается симбатно с ростом комплексообразующей способности РЗЭ.
Осаждение Ln2(C2O4)3·mH2O и их дальнейшая термическая обработка (T>750°C) – финальная стадия многих технологических процессов.
Фосфаты РЗЭ. Фосфорные кислоты образует с РЗЭ очень большое число соединений, имеющих широкий набор областей применения. С технологической точки зрения наиболее важны ортофосфаты – аналоги природных минералов монацита (La.…Gd)PO4 и ксенотима (Y.…)PO4. Ортофосфаты LnPO4·xH2O плохо растворимы в воде (S = 3÷4·10-4 моль/л). Лучший осадитель из нитратных растворов – Na3PO4. Растворимость в концентрированной H3PO4 несколько увеличивается с увеличением порядкового номера Ln. При pH = 2÷3 и комнатной температуре LnPO4 переходят в кристаллическое состояние, образуя два изоструктурных ряда: с тетрагональной решеткой (Ln = Ho, ..., Lu, Y) – аналоги ксенотима и с гексагональной решеткой (Ln = La, ..., Gd) – аналоги монацита. При нагревании LnPO4·xH2O до ~450–600°C образуются безводные соли.
Конденсированные фосфаты, т. е. соли фосфорных кислот, содержащих связи P–O–P (простейший пример – соли H4P2O7), в природе не встречаются.
Галогениды РЗЭ
Галогениды РЗЭ играют важную роль в технологии РЗЭ и, особенно, в технологиях материалов на их основе, где служат предшественниками. Роль LnHal3 (Hal – галоген) в технологических процессах показана на схеме:
 Бромиды
выраженных областей применения не
имеют и далее не рассматриваются.
Химия фторидов отлична от химии остальных
галогенидов. Причина состоит в том, что
у фтора (1s2 2s2 2p5), в
отличие от хлора (1s2 2s2 2p6
3s2 3p53d0), а тем более
брома и йода, нет d-орбиталей, или
d-электронов. Это определяет отличия
LnF3 от других галогенидов.
Бромиды
выраженных областей применения не
имеют и далее не рассматриваются.
Химия фторидов отлична от химии остальных
галогенидов. Причина состоит в том, что
у фтора (1s2 2s2 2p5), в
отличие от хлора (1s2 2s2 2p6
3s2 3p53d0), а тем более
брома и йода, нет d-орбиталей, или
d-электронов. Это определяет отличия
LnF3 от других галогенидов.
Хлориды РЗЭ образуют три ряда соединений и фаз: LnCl3, LnCl2 (Sm, Eu, Yb) и субгалогениды LnClx (x < 3) (например, PrCl2,3, который существует в системе PrCl3–Pr в интервале температур 659–594°C).
Безводные трихлориды РЗЭ получают различными методами:

Метод позволяет получать трихлориды для всех членов ряда. Его применение ограничено лабораторной практикой: использование CCl4 в качестве хлоробразующего агента запрещено парижскими соглашениями. Продукты термического разложения CCl4 – сильные канцерогены.
3. Ln2O3 + C + Cl2 → LnCl3 + CO/CO2↑. (21)
Скорость процесса зависит от природы углерода (древесный уголь, антрацит и т. д.). Для «легких» РЗЭ в продуктах всегда присутствует примесь оксохлоридов Ln (Ln = La, …, Eu) – LnOCl.

Процесс проводят при 10-кратном избытке NH4Cl. В продуктах могут содержаться комплексные хлориды (NH4)2LnCl5 (Ln = La, Ce) или (NH4)3LnCl6. Метод применим для получения хлоридов «легких» РЗЭ и носит препаративный характер.
Безводные LnCl3 хорошо растворимы в воде. Если при растворении в растворе появляется опалесценция, это свидетельствует о присутствии нерастворимого в воде LnOCl. В таблице 6 представлены термические и термодинамические свойства LnCl3.
Безводные LnCl3 кристаллизуются в гексагональной решетке (La, ..., Gd) и в моноклинной решетке (Ho, ..., Lu). Tb и Dy диморфные – у них есть обе модификации. LnCl3 (Ln = La, ..., Lu) испаряются конгруэнтно, в парах мономерны. LnCl3(тв) взаимодействуют с газообразным кислородом и парами воды с образованием оксохлоридов:
LnCl3(тв) + O2 → LnOCl + Cl2
Из водного или слабокислого раствора выделяются кристаллогидраты LnCl3·nH2O (n = 6 или 7 в зависимости от порядкового номера Ln). Термическое разложение LnCl3·nH2O проходит ступенчато и на конечной стадии сопровождается внутренним гидролизом с образованием LnOCl (по одним данным) или получением LnCl3 (по другим данным).
Интересен в химическом отношении и важен в технологии переработки лопаритового концентрата хлорным методом процесс выделения Ce из раствора, получаемого при растворении плава хлоридов РЗЭ. Это яркий пример использования «аномальных» степеней окисления РЗЭ для создания технологических процессов. В процессе хлорирования лопаритового концентрата [Ca(Na, La, Ce, ..., Eu)]·[Ti(Nb, Ta)]O3 РЗЭ образуют плав хлоридов, который растворяют в слабой HCl и получают раствор, содержащий 36–38 % в пересчете на Ln2O3 суммы РЗЭ. Если принять суммарное содержание РЗЭ в растворе за 100 %, то содержание отдельных элементов (в пересчете на оксиды) составит (масс. %): La2O3 – 25,5; Ce2O3 – 52,4; Pr6O11 – 4,97; Nd2O3 – 15,4; Sm2O3 – 1,21. Одна из возможных технологически оправданных концепций состоит в выделении на стартовых этапах переработки церия, содержание которого максимально. В основе лежит способность церия образовывать соединения, содержащие Ce4+. Процесс описывается реакциями:

В качестве окислителя можно использовать и NaOCl:
2CeCl3 + NaOCl + 7H2O → 2CeO2·2H2O + NaCl + 6HCl
Комплексные хлориды РЗЭ
Фазовые диаграммы систем LnCl3 – MCl (M = Na, K, Rb, Cs) приведены в таблице 7. В общем виде процессы получения комплексных хлоридов РЗЭ отражаются схемами:
LnCl3 + 3NaCl → Na3LnCl6 (Ln = Eu, Ho, Er)
LnCl3 + 3MCl → M3LnCl6 (Ln = Pr …Lu) (M = Na, K, Rb, Cs)
Количество, состав и температуры плавления промежуточных фаз в системах LnCl3 – MCl (M = Na, K, Rb, Cs) иллюстрируюся в таблице 7. Анализ фазовых отношений в этих системах позволяет выделить закономерности. Образование фаз M3[LnC16] является общей правильностью практически для всех членов ряда. Она позволяет выявить и сформулировать некоторые общие положения:
Зависимость Тпл (термическая стабильность) M3[LnC16] в случае, когда внешнесферный катион щелочного металла постоянен, а Ln меняется по ряду.
Зависимость термической стабильности в случае когда Ln постоянен, а меняется щелочной металл.
Все дальнейшие обсуждения выполнены в рамках ионной модели.
Будем называть в М3[LnCl6] Ln – катионом комплексообразователем, М – внешнесферным, ионогенно связанным катионом. С ростом порядкового номера Ln термическая стабильность K3[LnCl6] имеет тенденцию к росту. Ионный радиус Ln3+ уменьшается, и кулоновское взаимодействие растет. В случае, когда Ln постоянен, а М меняется по ряду K – Rb – Cs термическая стабильность растет. С увеличением порядкового номера щелочного металла радиус иона М+ растет, он легче поляризуется и, следовательно, сильнее взаимодействует с анионом. Численно это выражается обобщенным моментом μ = z/ri. Существует предельное значение μ, ниже которого комплексообразование отсутствует. Именно поэтому в рассмотрение не включен литий, который не поляризуется. Указанные закономерности справедливы для описания процессов комплексообразования многих хлоридов переходных элементов TiCl4, ZrCl4, HfCl4, NbCl5, TaCl5 с хлоридами щелочных металлов.
Дихлориды Sm, Eu и Yb – LnCl2 – получают восстановлением LnCl3.
Процесс описывается реакциями:
LnCl3 + R → LnCl2 + RCl3,
R – восстановитель: одноименный металл, водород, металл- восстановитель.
Выбор восстановителя с термодинамической точки зрения определяется величиной ΔG°T(r) – чем она более отрицательна, тем сильнее восстановитель, т. к. ΔG°T(r) = -RTlnKp. С технологических позиций следует учитывать схемы разделения продуктов, конструкцию и материал аппарата восстановления. Метод металлотермии трихлоридов Sm, Eu и Yb не позволяет получать металлы – восстановление идет только до образования дихлоридов, что показывает важность роли «аномальных» степеней окисления в технологии.
Фториды РЗЭ
Все РЗЭ образуют фториды LnF3. Они термически и термодинамически устойчивее хлоридов: имеют более высокие температуры плавления и кипения, они менее гигроскопичны. Свойства LnF3 суммированы в таблице 8. LnF3 можно получать прямым фторированием металлов или карбидов. Метод со специальными мерами безопасности осложнен выбором конструкционного материала (сплавы на основе никеля) и не имеет практического значения.
Безводные LnF3 получают фторированием оксидов газообразным HF при Т ≥ 700°C и избытке HF:
Ln2O3 + 6HF → 2LnF3 + 3H2O
или бифторидом аммония:
![]() Гидратированный
фторид РЗЭ – LnF3∙xH2O (x = 0,5÷1)
– обезвоживаются в вакууме или потоке
HF при повышенных температурах:
Гидратированный
фторид РЗЭ – LnF3∙xH2O (x = 0,5÷1)
– обезвоживаются в вакууме или потоке
HF при повышенных температурах:
