
диссертации / 102
.pdf
|
|
|
31 |
|
|
|
|
|
|
|
Таблица 5 |
Распределение по возрасту и полу в общей выборке больных |
|||||
|
|
|
|
|
|
|
Возраст, пол |
|
n=345 (100%) |
||
|
|
|
|
|
|
0 до 1 года |
|
|
|
85 (25%) |
|
|
|
|
|
|
|
|
|
новорожденные |
|
|
5 |
из них: |
|
|
|
|
|
|
1-3 мес. |
|
|
9 |
|
|
|
|
|
|
|
|
|
4-6 мес. |
|
|
30 |
|
|
|
|
|
|
|
|
7-12 мес. |
|
|
41 |
|
|
|
|
|
|
1-3 года |
|
|
|
117 |
(34%) |
|
|
|
|
|
|
|
дети 0-3 года |
|
202 |
(59%) |
|
|
|
|
|
|
|
4-7 лет |
|
|
|
42 (12%) |
|
|
|
|
|
|
|
8-11 лет |
|
|
|
31 |
(9%) |
|
|
|
|
|
|
12-18 |
|
|
|
70 (20%) |
|
|
|
|
|
||
|
11-18 лет |
|
80 (23%) |
||
|
|
|
|
|
|
Мальчики |
|
|
|
215 |
(62%) |
|
|
|
|
|
|
Девочки |
|
|
|
130 |
(38%) |
|
|
|
|
|
|
Всем пациентам была выполнена лапароскопическая фундопликация по Ниссену в двух различных методиках. В зависимости от методики операции больные общей выборки были разделены на две группы. У детей,
прооперированных с 2010 по 2013 гг., применялась разработанная нами модифицированная методика ЛФН. Эти пациенты вошли в группу I (n=181, Nопераций=197). У детей, прооперированных в период с 2005 по 2009 гг., использовалась традиционная методика операции. Эти пациенты составили контрольную группу II (n=164, Nопераций=199).
В каждой из вышеуказанных двух групп были выделены дети с рецидивом желудочно-пищеводного рефлюкса, которым выполнялась повторная лапароскопическая фундопликация. В группе I nрец=14, в группе II nрец= 29.

32
Для проведения сравнительного анализа в зависимости от методики второй операции все пациенты с рецидивами (n=43) были также разделены на две группы.
В группу IР вошли дети, у которых повторная ЛФН была выполнена по модифицированной методике и в группу IIР – дети, повторно прооперированные по традиционной методике. Повторный рецидив (более 2 операций) имел место у
6 детей, см таблицу 6.
Таблица 6
Распределение больных по группам в зависимости от методики операции
Лапароскопическая фундопликация по Ниссену
Модифицированная методика |
Традиционная методика |
Рецидивы |
||
|
|
|
|
|
Группа I |
n=181 |
Группа II |
n=164 |
n=43 |
|
|
|
|
|
Группа IР |
n=22 |
Группа IIР |
n=21 |
n=6 |
|
|
|
|
|
Клиническое обследование для всех пациентов выполнялось по единому протоколу.
В ходе общего осмотра и сбора анамнеза фиксировали жалобы и симптомы желудочно-пищеводного рефлюкса. По нашим данным, у детей младшей возрастной группы преобладали срыгивания, рвоты, плохая прибавка и дефицит массы тела, стридор, аспирационный синдром, эпизоды апноэ. У детей старших возрастных групп – изжога, отрыжка, боль за грудиной и в эпигастральной области, рвоты. Респираторные проявления ЖПР у детей всех возрастных групп проявлялись как периодический кашель, усиливающийся в ночное время, частые и резистентные к терапии бронхиты, рецидивирующие пневмонии, астматический статус.
Все дети были осмотрены педиатром, неврологом и генетиком.
Инструментальные методы диагностики включали рентгеноскопическое исследование пищевода, желудка, двенадцатиперстной кишки с контрастированием, фиброэзофагогастродуоденоскопию, ультразвуковое исследование органов брюшной полости.
33
В рамках предоперационной подготовки всем пациентам выполняли лабораторное обследование (общий анализ крови, общий анализ мочи,
биохимический анализ крови, коагулограмма, определение группы крови и резус-
фактора, анализ крови на ВИЧ, HBsAg, HCV).
Накануне операции все пациенты были осмотрены врачом-анестезиологом.
2.2. Инструментальные методы диагностики
При диагностике всем первичным больным и пациентам с рецидивами выполняли рентгеноскопическое исследование пищевода, желудка,
двенадцатиперстной кишки с контрастированием. Использовали рентгеновский аппарат с электронно-оптическим преобразователем. В качестве контрастного вещества применяли сульфат бария в виде жидкой смеси на основе питьевой воды,
сока или детского питания. Объем контрастного вещества не превышал объем разового кормления. После дачи контраста через рот ребенку проводили рентгеноскопию пищевода, желудка, двенадцатиперстной кишки. В ряде случаев у детей до 3 лет в связи с отказом от питья контраста выполняли введение сульфата бария по назогастральному зонду под рентгеноскопическим контролем.
Исследование проводили в горизонтальном положении. В качестве провоцирующей пробы ребенку давали выпить несколько глотков воды. В ходе исследования оценивали наличие или отсутствие заброса контрастного вещества из желудка в пищевод. Высоту заброса определяли в трех степенях: до нижней,
средней или верхней трети пищевода. Также оценивали положение и форму желудка, смещение последнего выше диафрагмы расценивали как признак грыжи пищеводного отверстия диафрагмы. Эвакуацию контраста из желудка оценивали в конце исследования. При задержке пассажа – выполняли отсроченную обзорную рентгенографию органов брюшной полости с периодичностью через 15, 30, 60 и 90 минут от момента начала исследования.
У детей с подозрением на пептический стеноз пищевода, а также на вторичный рефлюкс и рубцовый стеноз пищевода после ожога пищевода, первым этапом проводили рентгеноскопию в вертикальном положении на фоне
34
одновременной дачи контрастного вещества через рот. Этап позволял выявить наличие или отсутствие сужения просвета пищевода.
Фиброэзофагогастродуоденоскопию выполняли всем детям фиброэндоскопами с торцевой оптикой (“Olympus”, Япония) под местной анестезией или под аппаратно-масочным наркозом. Во время исследования оценивали состояние слизистой пищевода (гиперемия, эрозии, язва, метаплазия слизистой), наличие стеноза, локализацию зубчатой линии, состояние кардии,
признаки грыжи пищеводного отверстия диафрагмы. При наличии стеноза пищевода определяли его характер (воспалительный, рубцовый), степень сужения,
протяженность. Также оценивали слизистую желудка и двенадцатиперстной кишки. При подозрении на метаплазию выполняли биопсию выявленных очагов с последующим морфологическим исследованием по стандартной методике.
В ряде случаев у детей с ПСП, с рубцовым стенозом после ожога пищевода, а
также у детей, оперированных по поводу атрезии пищевода и с наличием стеноза эзофагоэзофагоанастомоза, эндоскопическую диагностику дополняли бужированием по струне-проводнику. Для проведения струны выполняли
«жесткую» эзофагоскопию (эзофагоскопы Karl Storz).
Также всем пациентам было выполнено ультразвуковое исследование органов брюшной полости (ультразвуковой аппарат Acuson Sequoia 512).
2.3. Показания к хирургическому лечению
Все дети до этапа хирургического лечения наблюдались у гастроэнтеролога и прошли несколько курсов консервативной терапии, которая не имела терапевтического эффекта. В течение 6-12 месяцев после отмены препаратов симптомы возобновились у 100% больных. Показанием к операции почти у половины детей явилась несостоятельность нижнего пищеводного сфинктера
(46%, n=157) и почти у каждого третьего – грыжа пищеводного отверстия диафрагмы (29%, n=101) или осложненные формы рефлюкса (30%, n=105).
В группе детей с пептическим стенозом (8%, n=28) фундопликацию выполняли после устранения стеноза пищевода методом бужирования на фоне
35
консервативной антирефлюксной терапии (прием комбинации из трех препаратов: антисекреторный препарат, прокинетик и антацидное средство)
продолжительностью 2-6 месяцев.
Дети с рубцовым стенозом пищевода после ожога (5%, n=17) и дети с атрезией пищевода и стенозом эзофагоэзофагоанастомоза (15%, n=51) также проходили курс бужирования до фундопликации (см. таблицу 4).
2.4. Методы хирургического лечения
Методом хирургического лечения явилась лапароскопическая фундопликация по Ниссену в двух модификациях: традиционная ЛФН и ее модифицированная методика, разработанная на базе отделения торакальной хирургии и хирургической гастроэнтерологии ДГКБ №13 им. Н.Ф.Филатова (г.Москва).
В брюшную полость вводили 5 троакаров и располагали их следующим образом: троакар для проведения оптики трансумбиликально; рабочие троакары в правом и левом подреберьях по передней подмышечной линии; троакар для ретракции печени под мечевидным отростком и дополнительный троакар в левой подвздошной области. Интраоперационно выполняли мобилизацию дна желудка с пересечением коротких желудочных артерий. Затем формировали тоннель позади пищевода с последующим ушиванием дна желудка вокруг пищевода узловыми швами в виде фундопликационной манжеты. Фундопликационную манжету формировали двумя рядами экстракорпоральных узловых швов в два этажа.
Отличие модифицированной ЛФН состояло в техническом приеме, который использовали при создании фундопликационной манжеты. По традиционной ЛФН манжету сшивали при помощи серозно-мышечных узловых швов в два этажа. В соответствии с модифицированной ЛФН на этом этапе операции в первом ряду вместо серозно-мышечных швов выполняли прошивание стенок желудка через все слои. Второй ряд швов накладывали с захватом только серозно-
мышечных слоев стенок желудка, погружая (укрывая) первый ряд швов (рисунок
4).
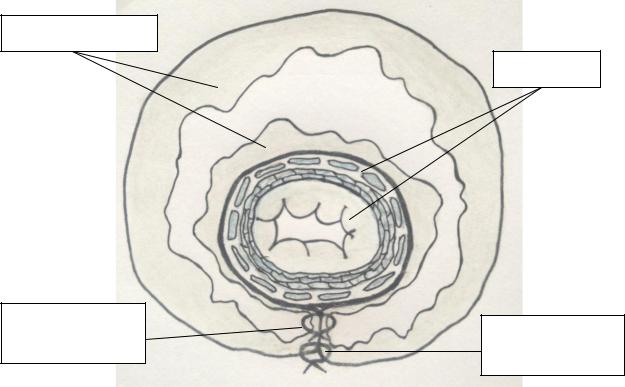
36
Независимо от методики операции при расширенном пищеводном отверстии и расхождении ножек диафрагмы выполняли ушивание ножек и фиксировали сформированную манжету к ножкам узловыми швами. При грыже пищеводного отверстия дополнительно выполняли низведение органов брюшной полости из средостения и иссечение грыжевого мешка.
стенки желудка
1-ый ряд узловых швов
пищевод
2-ой ряд узловых швов
Рисунок 4. Модифицированная методика лапароскопической фундопликации по Ниссену: схематичное изображение фундопликационной манжеты с наложением узловых швов на стенки желудка в первом ряду через все слои, во втором ряду наложены серозно-мышечные узловые швы.
37
2.5. Методы статистической обработки
Статистический анализ подразумевал исследование следующих групп
пациентов:
сравнение двух групп первичных больных в зависимости от методики операции (группа I и группа II);
сравнение двух групп больных с рецидивами в зависимости от методики
второй операции (группа IР и группа IIР).
Обработку данных проводили по частоте развития рецидивов и по времени от момента операции до момента развития рецидива.
Перед проведением сравнительного анализа по частоте рецидивов в каждой паре исследуемых групп был проведен их сравнительный анализ по основным клиническим признакам. Данный анализ выполнен с использованием критерия χ-
квадрат с поправкой Йейтса или двустороннего точного критерия Фишера.
Сравнение в двух парах групп по частоте развития рецидивов также проведено с использованием критерия χ-квадрат с поправкой Йейтса.
Сравнительный анализ по времени от момента операции до развития рецидива выполнен с использованием логрангового теста. Кривые по длительности безрецидивного периода построены по методу Каплана-Майера.
Для исключения влияния на возникновение рецидива прочих других факторов помимо предполагаемых в рамках данного исследования были проведены однофакторные логистические регрессионные анализы с каждым из указанных нами потенциальных факторов риска рецидива. Методика операции также включена в регрессионный анализ.
Факторы риска, которые статистически значимо предсказывали рецидивирование желудочно-пищеводного рефлюкса по данным однофакторных регрессионных анализов, статистически обработаны при помощи многофакторного логистического регрессионного анализа. Данный метод позволил определить независимые предикторы рецидива желудочно-пищеводного рефлюкса в общей выборке больных.
38
Статистический анализ проведен с использованием программы Microsoft Excel 2007, статистического пакета Statistica StatSoft 8.0, а также SPSS 17.0.
Различия между группами считались статистически значимыми при значении р<0,05.
39
ГЛАВА 3
РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
3.1. Результаты хирургического лечения в общей выборке больных
Всем 345 пациентам была выполнена лапароскопическая фундопликация по Ниссену (396 операций). Средняя продолжительность операции варьировала от 25
до 90 минут.
По нашим данным, у 88% отмечено полное излечение желудочно-
пищеводного рефлюкса. Повторно было прооперировано 43 пациента, что составило 12%. Из них повторный рецидив имел место у 6 детей (3-я операция) и
в2 случаях была выполнена четвертая операция.
Удетей со вторичным рефлюксом число повторных операций значимо не отличалось от показателя для общей выборки: 12% – среди пациентов с атрезией пищевода и 18% – у детей с ожогами пищевода, см. таблицу 7.
Таблица 7
Рецидивы желудочно-пищеводного рефлюкса в общей выборке больных
Пациенты |
Первичные больные |
Рецидивы |
||
|
|
|
|
|
Общая выборка |
n=345 |
n=43 |
12% |
|
|
|
|
|
|
|
Атрезия |
n=51 |
n=6 |
12% |
Вторичный |
пищевода |
|
|
|
рефлюкс |
|
|
|
|
Ожоги |
n=17 |
n=3 |
18% |
|
|
пищевода |
|
|
|
|
|
|
|
|
Повторные рецидивы (3-я и 4-я операции) |
n=6 |
14% |
||
|
|
|
|
|
Полученные нами результаты показали, что у первичных пациентов преобладала неосложненная форма рефлюкса (несостоятельность нижнего пищеводного сфинктера). Второе место занимали анатомические аномалии – грыжа пищеводного отверстия диафрагмы (включая скользящую грыжу). Следует

40
отметить, что у детей с рецидивами ГПОД встречалась в 2 раза чаще по сравнению с общей выборкой. При этом, также почти в 2 раза чаще было выявлено одновременное сочетание ГПОД с эрозивным рефлюкс-эзофагитом,
ПСП или пищеводом Барретта. Два последних осложнения среди больных с рецидивами преобладали в аналогичной пропорции: частота встречаемости пептического стеноза и пищевода Барретта удваивалась среди повторно оперированных детей. Результаты суммированы в таблице 8.
|
|
|
|
|
Таблица 8 |
|
Результаты хирургического лечения в общей выборке больных |
||||||
|
|
|
|
|
||
Клинические параметры |
Первичные больные |
Рецидивы |
|
|||
|
|
|
|
|
|
|
|
|
|
n=345 (100%) |
n=43 (100%) |
|
|
|
|
|
|
|
|
|
Несостоятельность нижнего |
157 (46%) |
10 |
(23%) |
|
||
пищеводного сфинктера |
|
|
|
|
||
|
|
|
|
|
|
|
Грыжа |
пищеводного |
101 (29%) |
25 |
(58%) |
|
|
отверстия диафрагмы |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Эрозивный |
70 (20%) |
9 (21%) |
|
|
|
|
рефлюкс- |
|
|
|
|
|
|
эзофагит |
|
|
|
|
Осложненные |
|
|
|
|
|
|
|
Пептический |
28 (8%) |
7 (16%) |
|
||
формы |
|
стеноз |
|
|
|
|
|
|
пищевода |
|
|
|
|
|
|
|
|
|
|
|
|
|
Пищевод |
7 (2%) |
2 |
(5%) |
|
|
|
Барретта |
|
|
|
|
|
|
|
|
|
|
|
Грыжа пищеводного отверстия |
52 (15%) |
11 |
(26%) |
|
||
диафрагмы в |
|
сочетании с |
|
|
|
|
осложненными формами |
|
|
|
|
||
|
|
|
|
|
|
|
