
диссертации / 61
.pdf51
исследования в лабораторию клинической иммунологии ФГБУ Научного центра акушерства, гинекологии и перинаталогии им. В.И. Кулакова МЗ РФ (Директор Академик РАН, доктор медицинских наук, профессор Сухих Г.Т), на кафедру патологической анатомии Первого московского государственного медицинского университета имени И. М. Сеченова (ГБОУ ВПО Первый МГМУ), кафедра патологической анатомии им. И.М. Струкова (зав. кафедрой, профессор Пауков В.С.). Все пациентки заполняли информированное добровольное согласие на участие в исследовании.
Материал фиксировали в 10% нейтральном формалине с фосфатным буфером,
обрабатывали в аппарате гистологической проводки тканей фирмы «Pool Scientific Instruments» (Швейцария) и заливался в парафин. Суммарное время фиксации, проводки и заливки материала, как правило, не превышало 48 часов.
Затем готовили серийные парафиновые срезы (не менее 12 серийных срезов),
толщиной 4–5 микрон. Срезы фиксировали на предметные стекла, покрытые адгезивом (полилизин, APES) и инкубировали в термостате при 370С в течение 12
часов. Далее срезы депарафинировали и обезвоживали в батарее из 3-х ксилолов,
2-х абсолютных спиртов, 95%-х спиртов, 80% и 70% спирта и дистилированной воды. По стеклу от каждого случая окрашивали гематоксилин-эозином.
Иммуногистохимическое (ИГХ) исследование выполняли на биоптатах передней и задней стенки влагалища от 168 пациенток с пролапсом и без пролапса гениталий.
ИГХ реакции проводили на депарафинированных срезах толщиной 4-5 мкм расположенных на стеклах, покрытых APES – слоем (Janice A., 1983).
Неокрашенные срезы от каждого случая обрабатывали с помощью стандартного микроволнового метода иммуногистохимии. Демаскировку антигенов для ИГХ проводили в микроволновой печи. Стекла погружали в цитратный буфер (рН 6,0)
и нагревали в микроволновой печи в течение 15 минут при мощности 600 Вт.
Далее стекла остывали 20 минут при комнатной температуре. Остывшие стекла помещали во влажные камеры (для предотвращения высыхания срезов) и
52
инкубировали 15 минут с 3% раствором Н2О2. После обработки перекисью стекла ополаскивали в фосфатном буфере (рН7,0-7,6). Далее стекла инкубировали с 1%
раствором альбумина во влажных камерах в течение 30 минут. По окончании инкубации излишки альбумина аккуратно стряхивали со стекол и наносили первичные антитела при помощи микропипетки. В качестве первичных антител использовали моноклональные антитела к фибулину 5 (Abbiotec, 1:100),
лизилоксидазаподобного белка 1 (LOXL1) (Abbiotec, 1:100), ММP-2 (LabVision, ready-to-use), МMP-9 (LabVision 1:50) и ТIMP-2(LabVision, ready-to-use). Срезы инкубировали с первичными антителами от 30 минут до 1 часа, в зависимости от времени воздействия, предусмотренного в спецификации к антителу от фирмы производителя. Далее срезы отмывали в фосфатном буфере (рН 7,0-7,6) от первичных антител, не связавшихся с эпитопами и обрабатывали вторичными антителами. Срезы инкубировали с вторичными антителами во влажных камерах в течение 1 часа, затем ополаскивали в фосфатном буфере (рН 7,0-7,6). Для метки вторичных антител использовали стрептовидин-биотиновый комплекс (SВК KIT,
DAKO). Для визуализации места связывания антитела с антигеном использовали метку – фермент, пероксидазу хрена, в присутствии субстрата – перекиси водорода – и колориметрического реактива с 3,3-диаминобензидином (ДАБ), (LSAB, Dako Cytomation). В результате образовывался нерастворимый в органических растворителях конечный продукт реакции, который визуализировался в виде коричневого окрашивания структур клеток. Далее стекла ополаскивали в дистиллированной воде и подкрашивали ядра гематоксилином.
Затем стекла проводили по батарее из дистиллированной воды, 70% спирта, 80%
спирта, 2-х 95% спиртов, 2-х абсолютных спиртов и 3-х ксилолов. После чего срезы заключали в синтетическую среду, используя покровные стекла.
Для ИГХ реакций ставили положительные и отрицательные контроли. В
качестве отрицательных контролей брали образцы исследуемых срезов, которые подвергались стандартной процедуре иммуногистохимии, но без добавления
53
первичных антител. Положительные контроли для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя.
Проводилась полуколичественная и количественная оценка результатов реакций. Результаты ИГХ реакции для исследуемых антител оценивали полуколичественным методом в баллах по количеству позитивно окрашенных клеток, причем отдельно оценивали эпителиальные клетки, фибробласты,
эндотелий сосудов и строма, если продукт реакции выявлялся в указанных выше структурах. Оценку интенсивности реакции проводили по 6-ти балльной системе: 2 балла – до 20% окрашенных клеток; 4 балла – от 20 до 40% окрашенных клеток; 6 баллов – более 40% окрашенных клеток.
2.3. Генетические методы исследования − генотипирование по генам
|
кандидатам |
|
|
|
Генотипирование |
выполнялось |
в |
лаборатории |
экологической |
генетики Федерального |
государственного бюджетного учреждения науки, |
|||
институте общей генетики им. Н.И. |
Вавилова Российской |
академии наук. |
||
(директор ИОГен РАН − член-корр. РАН, д.б.н., проф. Янковский Н.К.),
заведующий лабораторией экологической генетики − д.б.н. Рубанович А.В.).
Образцы крови собирали в вакутейнеры, содержащие ЭДТА, и хранили при
-20-80°С до выделения ДНК. Для генотипирования мы выделяли ДНК из цельной крови с помощью наборов Diatom DNA Prep 200, основанных на использовании гуанидинтиоционата и Nucleus-сорбента (Isogene Lab.Ltd,
Россия). Для проведения ПЦР реакции использовали лиофилизированные готовые наборы Master Mix (Фирма Изоген), в которые добавляли 10 мкл ПЦР-
растворителя (Фирма Изоген), 3 мкл праймеров (оптическая плотность 3-4 о.е.), 2 мкл деионизованной воды, 5 мкл исследуемой ДНК.
Амплификацию проводили в амплификаторе Applied Biosystems 9700 (GeneAmp® PCR System 9700). Визуализацию результатов осуществляли в 2%
агарозном геле с добавлением бромистого этидия. Праймеры и условия амплификации представлены в приложении 3.
54
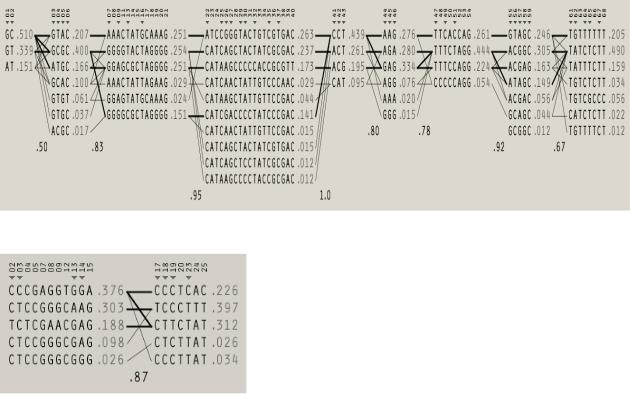
Выбор сайтов для генотипирования был основан на использовании ресурса
HaploView (version 4.2) для подбора таргетных SNP с целью покрытия всего гена.
На рисунке 2.3.1 показана гаплотипическая структура гена FBLN5 (алгоритм Solid Spine). Таргетные SNP из каждого блока сцепления были выбраны для генотипирования. Дополнительно были изучены полиморфные сайты,
отобранные по литературным данным (rs929608 и rs2430347). На рисунке 2.3.2
показана гаплотипическая структура гена LOXL1 (алгоритм Solid Spine);
дополнительно к двум таргетным SNP в каждом из двух блоков сцепления для генотипирования по литературным данным был отобран еще один SNP (rs3825942).
Рисунок 2.3.1 Гаплотипическая структура гена FBLN5
Рисунок 2.3.2 Гаплотипическая структура гена LOXL1
2.4.Методики хирургического лечения пролапса тазовых органов
Впериод с 2001-2012г.г. нами проведено обследование и хирургическое лечение
486 пациенток с ПТО и дисфункцией тазового дна (ДТД) (мочевая, ректальная). Для достижения результата хирургического лечения мы использовали различные методики в собственной модификации: ВГ, манчестерской операции, а также
55
применяли синтетические наборов первого поколения (троакарные системы) и
бестроакарные.
2.4.1 Влагалищная гистрэктомия c импровизированным слингом
(в собственной модификации), манчестерская операция (в собственной
модификации)
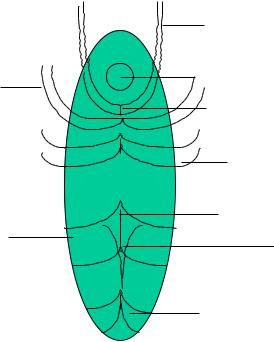
Оперативную коррекцию пролапса гениталий у женщин со стрессовым недержанием мочи и без него мы выполяли в собственной модификации (Макаров О.В. и соавт., патент на изобретение № 2248187 от 24.03.03), которая заключалась в следующем (рис. 2.4.1): проводили ВГ в сочетании с укорочением и фиксацией круглых связок к сводам влагалища и их ушивание под уретрой в виде импровизированного слинга, подшивании к куполу влагалища собственных связок яичников, укорочении кардинальных связок и их фиксацией к средней части стенки влагалища, иссечении треугольного лоскута из задней стенки влагалища между крестцово-маточными связками, ушивании их между собой и подшиваниии их к боковым стенкам влагалища [238].
|
Фиксация круглых связок к |
|
|
сводам влагалища под |
|
|
уретрой |
|
Подшивание к |
Уретра |
|
куполу влагалища |
||
|
||
собственных связок |
Ушитые круглые связки |
|
яичников |
под уретрой |
|
|
Фиксация кардинальных |
|
|
связок к стенкам влагалища |
|
Крестцовома- |
Ушивание крестцовоматочных |
|
связок после иссечения треуголь- |
||
точные связки |
||
ного лоскута |
||
|
Леваторы
Рисунок 2.4.1 Схематическое изображение влагалищной экстирпации матки в сочетании с
импровизированным слингом При проведении пластики задней стенки влагалища проводили максимальную
56
её отсепаровку от прямой кишки с целью создания дупликатуры из стенок влагалища, леваторопластика выполнялась типичным способом.
Пациенткам с сохранённой менструальной функцией, с элонгацией шейки матки проводили манчестерскую операцию в нашей модификации (Камоева С.В. и соавт., Патент на изобретение №2464946 от 27.10.12г.). Данный вид операции заключался в следующем: после гидропрепаровки и выкраивания полуовального лоскута из передней стенки влагалища с продолжением разреза циркулярно вокруг шейки матки, которую укорочивали, затем фиксировали кардинальные связки к шейке матки и ушивали стенки влагалища. При этом укорочение шейки матки выполняли следующим образом. После расширения цервикального канала рассекали шейку матки на две губы: переднюю и заднюю, оставив длину нерассеченной шейки матки 3,5-4,0см (нормальная длина). Ампутировали переднюю губу шейки матки. После чего фиксировали кардинальные связки к передне-боковым поверхностям шейки матки. Затем накладывали непрерывный шов снизу вверх на один из краев влагалищной стенки, образованный после выкраивания полуовального лоскута, оставляя первый конец нити свободным. При этом иглу вкалывали снаружи внутрь, до границы между нижней и средней третями прошиваемого края стенки влагалища, где выкалывали иглу изнутри кнаружи, переходя на второй край влагалищной стенки и прошивали его аналогично, начиная от границы между нижней и средней его третями. Второй конец нити оставляли свободным. Затем первый конец нити проводили через наружный зев цервикального канала, шейку матки между кардинальными связками на 1,5см выше ее ампутированного края и первый край стенки влагалища на границе между нижней и средней его третями. Второй конец нити также проводили через наружный зев цервикального канала, шейку матки между кардинальными связками на 1,5см выше ее ампутированного края и второй край стенки влагалища на границе между его нижней и средней третями. Затем связывали первый и второй концы нити между собой, подворачивая края стенки влагалища внутрь цервикального канала. Ампутировали заднюю губу шейки
57
матки. На край влагалищной стенки, отсепарованный от задней поверхности шейки матки, накладывали непрерывный шов. Каждый конец нити шва поочередно проводили через наружный зев цервикального канала, заднюю губу шейки матки на 1,5см выше ее ампутированного края и заднюю стенку влагалища. Затем концы нити связывали между собой на задней стенке влагалища, подворачивая край стенки влагалища внутрь цервикального канала.
Завершали операцию ушиванием оставшегося дефекта стенки влагалища,
восстанавливая его целостность. При необходимости операция завершалась выполнением кольпоперинеолеваторопластики типичным способом.
2.4.2 Влагалищные методики коррекции дефектов тазового дна с применением троакарных синтетических систем, технологии TVM (Perigee, Apogee, AMS Ink.), в том числе для коррекции стрессового недержания мочи
(Monarc, AMS Ink.)
1. Троакарная (с рукавами) трансвагинальная система Периджи (Perigee AMS Ink.).
К инновационным, постоянно совершенствующимся методам хирургической коррекции дисфункции тазового дна, относятся операции с использованием технологии TVM (Tension – free vaginal MESH или «трансвагинальное проведение сетки без натяжения»). Принцип этой технологии заключается в формировании искусственной тазовой фасции вместо разрушенной эндотазовой фасции, что позволяет создать прочный каркас для мочевого пузыря, стенок влагалища (II
уровень поддержки) и прямой кишки. Уже точно известно, что данный вид операций является целесообразным, патогенетически обоснованным при необходимости создания фасций взамен разрушенных (лобково-шеечной и прямокишечно-влагалищной). При этом не только ликвидируются имеющиеся фасциальные дефекты, но и восстанавливается фиксация фасций к стенкам
(костным структурам) таза.
Периджи (Perigee AMS), является средством в лечении переднего вагинального пролапса с применением трансобтураторного доступа (out in –снаружи-внутрь).

58
Технология Периджи позволяет корригировать все типы передних дефектов – центральный, латеральный, проксимальный и дистальный, с проведением рукавов в 4-х точках между сухожильными дугами через arcus tendineus f. pelvis
билатерально.
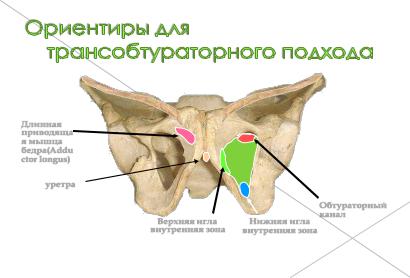
Набор состоит из 4-х маркированных игл (троакаров) . Верхние иглы (розовые)
проходят на уровне шейки мочевого пузыря. Нижние иглы (серые) проходят на уровне седалищной ости (Ischial spine) ( Рис. 2.4.2.1).
Рисунок 2.4.2.1 Периджи (Perigee AMS)
Сетчатый материал ИнтеПро Лайт (Inte Pro Lait) имеет свойства:
1)Крупнопористый (размер )>1000 микрон
2)Промежутки более 80 микрон
3)Монофиламентные волокна уменьшенного сечения
4)Сетка имеет открытые края для улучшенной интеграции фиброзной ткани Технология RivFix – это соединение «рукавов» с самой сеткой (рис. 2.4.2.2 ).
Рисунок 2.4.2.2 Технология RivFix – соединение «рукавов» с самой сеткой
59
Ориентиры для проведения игл трансобтураторным доступом, методом снаружи-внутрь (out in), наглядно показаны на рисунках 2.4.2.3. Минимальный,
но адекватный общий размер сетки, её структура снижают возможность отторжения и реакции со стороны собственных тканей.
Показанием для установки являлись любые пациентки с симптомами переднего вагинального пролапса (от 2 до 4 степени по классификации POP-Q).
Противопоказанием для установки системы Периджи являются:
-Беременность
-Некроз ткани (декубитальная язва)
-Возможно пациентки с поливалентной аллергией в анамнезе.
Длинная
приводяща я мышца бедра(Addu ctor longus)
уретра
|
|
Обтураторный |
Верхняя игла |
Нижняя игла |
канал |
|
||
внутренняя зона |
внутренняя зона |
|
Рисунок 2.4.2.3 Ориентиры для проведения игл трансобтураторным доступом, методом снаружи внутрь
Этапы установки (размещения) сетки Периджи:
Пациентка находилась на операционном столе в положении дорзальной литотомии с немного согнутыми к животу бёдрами. В мочевой пузырь вводили катетер Фолея. Предварительно проводили маркировку для верхних и нижних кожных разрезов на внутренней стороне бедра. Понятие верхние и нижние мы использовали в отношении запирательного отверстия. Для определения верхних разрезов пальпировали начало отхождения сухожилия длинной приводящей мышцы бедра приблизительно на уровне клитора. В этом
60
положении сразу под сухожилием и латеральнее лонной кости производим небольшой кожный разрез. Повторяли аналогичную манипуляцию на противоположной стороне пациентки. Нижние разрезы производили на внутренней поверхности бедра приблизительно на 3 см ниже и на 2 см латеральнее относительно верхнего разреза. Это место соответствует самой нижней части запирательного отверстия. Производили разрез слизистой передней стенки влагалища по средней линии, начиная от уровня шейки мочевого пузыря по направлению к верхушке влагалища, приблизительно длиной 4-5 см. Затем проводили латерально диссекцию сзизистой влагалища до белой линии (Arcus tendineus f. pelvis) для лучшей пальпации конца иглы.
Верхние иглы проводили по задней поверхности седалищно-лобковой ветви и выходили на уровне шейки мочевого пузря. Во влагалище вводили палец для пальпации иглы и контроля за её прохождением через леваторы. Игла проходит приблизительно в 2-3см медиальнее от нейро-сосудистого пучка обтураторного канала. Стержень иглы располагали под углом в 45 градусов к срединной оси пациентки и вводился внутрь при помощи большого пальца другой руки,
находящейся во влагалище. Указательный же палец этой руки контролировал конец иглы, как только тот проходил через обтураторную мембрану. Иглу продвигали во влагалище через вагинальный разрез. Затем рукава присоединяли к игле и проводили в обратном направлении через ранее выполненный паховый разрез. После присоединения коннекторы уже не могут быть отсоединены от конца иглы. Передняя лента (рукав) шейки мочевого пузыря обозначена двумя синими точками около зажимов. После прохождения рукава вместе с чехлами отрезали от иглы и ленту вместе с чехлом захватывали зажимом. Аналогичную манипуляцию осуществляли на противоположной стороне пациентки. Затем рукава подтягивали, свободно, без излишнего натяжения, позиционируя имплантат под шейку мочевого пузыря. Нижняя или апикальная игла имеет спиралевидную форму, которая позволяет ей пройти через белую линию приблизительно на 1,5-2см дистальнее седалищной ости.
