
диссертации / 35
.pdfФНО человека представляет собой белок с молекулярной массой около
18 kD, является, в основном, эндогенным медиатором воспалительной реакции организма и относится к группе цитокинов и синтезируется в первую очередь макрофагами в ответ на стимуляцию широким кругом объектов [100]. По функциональной активности ФНО, в значительной степени, подобен таким цитокинам, как интерлейкин-1β и интерлейкин-6 [188]. Увеличение уровня ФНО, как правило, связано с воспалительными процессами, при которых задействованы клетки мононуклеарного ряда [45].
Высокие концентрации фактора обнаруживаются при инфицировании организма патогенными вирусами, бактериями и при паразитарных инвазиях
(Granfeld C., 1991). Кроме того, доказано участие фактора в патогенезе септического шока, реакции отторжения трансплантатов и некоторых аутоиммунных заболеваниях [10,31,119]. Нормальный уровень ФНО в сыворотке крови здоровых людей, как правило, не превышает 50 пкг/мл.
ФНО-α продуцируется лимфоцитами, моноцитами, тканевыми макрофагами в ответ на внешний, внеклеточный стимул. ФНО-α обладает широким спектром регуляторной активности и определяется в крови на самых разных этапах воспалительного процесса [45,52]. Ключевыми функциями ФНО-α являются усиление экспрессии молекул адгезии,
индукция синтеза цитокинов эндотелием, прокоагулянтная активность
(Gerbod-Giannone M.S.,2006).
Биологические эффекты ФНО-α зависят от его концентрации. В
сыворотке крови здоровых людей ФНО-α практически не определяется. В
низких концентрациях он действует как пара- и аутокринный регулятор иммуновоспалительной реакции. В средних концентрациях указанный цитокин оказывает пирогенный эффект, стимулируя образование фагоцитов,
усиливает свёртывание крови, снижает аппетит, являясь важным фактором развития кахексии. Наконец, высокие концентрации ФНО-α, способствуют колебаниям артериального давления, возникновению внутрисосудистого тромбоза, изменению концентрации глюкозы в крови [64,32,202].
21

Продукция цитокина ФНО-α напрямую связана с геном ФНО-α. В
генетических исследованиях показано, что в промоторной зоне гена ФНО-α
определяется несколько полиморфизмов [135]. Наиболее часто встречаются три однонуклеотидных полиморфизма: G A 308, G A 238, G A 863.
Наличие гуанина (G) в данных нуклеотидных позициях и его замена на аденин (А) определяет часто встречающиеся аллели и характеризуется как полиморфизм гена ФНО-α. Предшествующие исследования показали, что повышенная продукция ФНО-α ассоциирована с полиморфизмом именно G- 308A [40,44,64]. У носителей данного полиморфизма синтез белка происходит в 3 раза быстрее, вследствие этого увеличивается продукция цитокина ФНО-α [46].
В одном из крупнейших исследований Т. Skoog et. al. (2002) установил взаимосвязь уровня ФНО- в плазме крови с развитием артериальной гипертензии (АГ), атерогенной дислипидемиии и нарушениями углеводного обмена. Позднее было показано, что полиморфизм гена ФНО-α именно в положении G-308A определяет формирование гиперинсулинемии, АГ и ожирения [118,171]. Таким образом, ФНО-α обладает цитотоксическим действием, иммуномодулирующим и провоспалительным эффектом. В
в плазме крови с развитием артериальной гипертензии (АГ), атерогенной дислипидемиии и нарушениями углеводного обмена. Позднее было показано, что полиморфизм гена ФНО-α именно в положении G-308A определяет формирование гиперинсулинемии, АГ и ожирения [118,171]. Таким образом, ФНО-α обладает цитотоксическим действием, иммуномодулирующим и провоспалительным эффектом. В
высокой концентрации ФНО-α способен повреждать клетки эндотелия и увеличивать микроваскулярную проницаемость, он вызывает активирование системы гемостаза и комплемента, за которым следует аккумуляция нейтрофилов и внутрисосудистое микротромбообразование [26,50,75,153].
1.1.ФНО-α и передача инсулинового сигнала
При ИР клетки-мишени периферических тканей (скелетные мышцы,
жировая ткань, печень, гладкомышечные и эндотелиальные клетки кровеносных сосудов) теряют способность адекватно отвечать на воздействие инсулина, несмотря на его высокий уровень в крови
(компенсаторная гиперинсулинемия).
Выявление основных этапов внутриклеточной передачи инсулинового сигнала и изучение белков, являющихся регуляторными факторами для этого
22
пути, представляет не только академический интерес для широкого круга исследователей в области биохимии и молекулярной биологии, но имеет и клиническое значение. Одним из таких белков является ФНО-α, роль которого в развитии ИР доказана [145]. Понимание тонких механизмов нарушения передачи инсулинового сигнала позволяет найти новые подходы к разработке профилактических мероприятий и лечению у пациентов с нарушенной чувствительностью к инсулину.
Инсулин
GLUT 4
Инсулиновый рецептор
TNF-α |
|
ras raf |
|
ИРС-1 |
|
|
|
|
Протеинкиназа |
|
МАР-К |
Протеинкиназа |
|
|
В |
PI-3 киназа |
|
В |
|
|
|
|
|
Метаболические эффекты |
Митогенные эффекты |
|
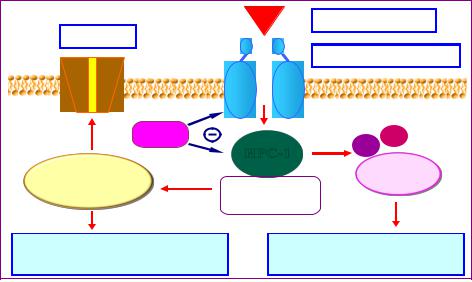
Рисунок 2. ФНО-α и белки внутриклеточной передачи инсулинового сигнала.
В передаче инсулинового сигнала внутрь клетки можно выделить пять основных этапов (Рис.2.):
1.Связывание инсулина с инсулиновым рецептором и активация рецепторной молекулы.
2.Фосфорилирование белков семейства субстратов инсулинового рецептора (ИРС-белками) и их связывание с белками внутриклеточной передачи инсулинового сигнала.
3.Активация фосфатидилинозитол-3-киназы (PI3-киназы)
4.Активация протеинкиназы В (Akt/PKB).
5.Активация каскада внутриклеточных белков, которые принимают участие в реализации метаболических эффектов инсулина.
23
Данные о молекулярном механизме действия ФНО-α на передачу
инсулинового сигнала получили Kroder et al. (1996) на культуре клеток мышей [32]. Позже были получены более точные сведения о механизме
взаимодействия |
ФНО-α |
с ИРС-белками и инсулиновым |
рецептором. |
|||
Оказалось, что ФНО-α |
стимулирует фосфорилирование |
ИРС –1 (и, |
||||
возможно, других ИРС белков) по серину/треонину [102]. |
|
|
||||
Предполагается, |
что |
эффект ФНО-α |
на |
фосфорилирование |
||
осуществляется |
через |
протеинкиназу С, а ключевую |
роль |
в нарушении |
||
функции белка ИРС-1 |
играет фосфорилирование серина в 307 положении |
|||||
[104,204,195]. После фосфорилирования по серину/треонину ИРС-белки
теряют свою способность связываться с инсулиновым рецептором,
вследствие чего проведение инсулинового сигнала блокируется на одной из самых ранних стадий – на стадии взаимодействия инсулинового рецептора с ИРС-белками [104]. Подобный процесс имеет место во многих тканях,
включая жировую. Более того, после фосфорилирования ИРС-1 по серину нарушает тирозиновое фосфорилирование самого инсулинового рецептора
[20,172].
Была предложена гипотеза, согласно которой фосфорилирование ИРС-
1 по серину под воздействием ФНО-α приводит к связыванию дополнительных ингибирующих факторов с инсулиновым рецептором. В
этот процесс могут быть вовлечены также другие механизмы, включая
усиленную деградацию ИРС-белков; их дефосфорилирование |
и |
фосфорилирование по серину-треонину, опосредованное киназами [184]. |
|
1.2.ФНО-α и нарушения углеводного обмена
Накопленные зарубежные и отечественные исследования позволяют
рассматривать ФНО-а как медиатор ИР. В целом ряде исследований было показано, что высокий уровень этого белка в плазме крови коррелирует с выраженностью ИР. В исследованиях in vivo, выполненных на макрофагах,
было обнаружено, что инсулин стимулирует экспрессию гена ФНО-α и
секрецию макрофагами этого белка [113]. Hotasmisligi G.S. et al. (1999г.)
24

показали прямую взаимосвязь между уровнем ФНО-α и уровнем гиперинсулинемии: в исследованиях на грызунах с генетически обусловленной ИР было отмечено двукратное увеличение этого белка крови
[111,183]. Bronwen D. et al. также обнаружили, что повышение в плазме крови уровня ФНО- ассоциировано с более высоким уровнем инсулина натощак.
ассоциировано с более высоким уровнем инсулина натощак.
Механизм влияния ФНО-α на развитие ИР опосредуется несколькими путями. С одной стороны, он ингибирует активность тирозинкиназы инсулинового рецептора и усиливает фосфорилирование серина в субстрате инсулинового рецептора-1, что в свою очередь сопровождается снижением функции рецептора, нарушением трансдукцию гормонального сигнала и биологического действия инсулина [110]. Кроме того, ФНО-α тормозит экспрессию гена, ответственного за синтез внутриклеточных переносчиков глюкозы (ГЛЮТ-4) в мышечной и жировой ткани. Влияние ФНО-α на повышение инсулиновой резистентности потенцируется также через увеличение скорости липолиза и повышение уровня СЖК в крови
[114,124,137]. В экспериментальном исследовании при инфузии ФНО- в
в
систему кровообращения наблюдается ингибирование инсулиноопосредованного распределения глюкозы в организме, включая угнетение образования глюкозы в печени. Таким образом, ФНОреализует свой эффект в отношении инсулиновой резистентности как путем типичного классического эндокринного влияния, т.е. на расстоянии (мышцы, печень,
мозг), так и посредством паракринного или аутокринного механизма
(например, воздействием на липолиз). Поэтому некоторые авторы называют ФНОиндуктором инсулинорезистентности [77].
Представленные в литературе данные позволяют говорить о связи полиморфизма гена ФНО- с развитием ИР. По данным мета-анализа,
с развитием ИР. По данным мета-анализа,
проведенного Sookoian S.C. et al в 2005 году, у носителей генотипа G-308A
риск развития инсулинорезистентности увеличивается на 23% . Dalziel В. et al. исследовали G-308A полиморфизм и обнаружили, что гомозиготы по А-
25
аллелю имеют более высокий уровень инсулина натощак, чем носители G-
аллеля . Nicaud et al. также выявили, что носители А-аллелей в гомозиготной форме имеют большую площадь под инсулиновой кривой Zinman В. et al.
выявили, что высокий уровень ФНО- в плазме крови связан с формированием не только ИР, но и с развитием нарушения толерантности к глюкозе [216]. При исследовании углеводного обмена Kirwan J.P. et al.
в плазме крови связан с формированием не только ИР, но и с развитием нарушения толерантности к глюкозе [216]. При исследовании углеводного обмена Kirwan J.P. et al.
показали, что повышение уровня ФНО- в плазме крови у беременных является специфическим маркером развития гестационного диабета, и
в плазме крови у беременных является специфическим маркером развития гестационного диабета, и
данный показатель может быть использован для ранней профилактики и прогноза развития заболевания [127].
По данным исследования Finnish Diabetes Prevention Study, в которое вошли около 500 человек, носительство А-аллеля ФНОувеличивает риск развития СД 2 типа в 2 раза (J.Lindstrom,2013)
Bronwen et al. исследовали G-308A полиморфизм гена ФНО-α и
обнаружили, что гомозиготы по А-аллелю имеют более высокий уровень инсулина натощак, чем гомозиготы по G-аллелю [121]. Cseh K, et al. при анализе взаимосвязей между уровнем ФНО-α в плазме крови и углеводными показателями была установлена прямая высокодостоверная взаимосвязь между уровнем ФНО-α и содержанием HbA1с и глюкозы , и более тесная с высоким коэффициентом корреляции связь между уровнями ФНО-α и
инсулина, ФНО-α и HOMA.
В исследованиях Kubaszek A. et al., было показано, что нарушения секреции гормонов жировой ткани у больных СД типа 2 характеризуется повышением концентрации ФНО-α, лептина при одновременном снижении уровня адипонектина, сопровождающееся нарастанием инсулинорезистентности и повышением риска развития сосудистых осложнений при этом заболевании [131,164].
Seeley RJ., (2006) были получены данные о взаимосвязи содержания ФНО-α с массой тела и индексом массы тела у больных СД типа 2, а также
26

цитокин, называемый ФНО-α, также значимо коррелирует с ИР и может быть ранним маркером развития СД 2 типа.
Анализ литературы позволяет расценивать ФНО- как один из значимых факторов возникновения и прогрессирования ИР. При этом аллель А рассматривается как прогностически неблагоприятный фактор формирования нарушений углеводного обмена, перехода от нарушенной толерантности к глюкозе к СД 2 типа [106,114].
как один из значимых факторов возникновения и прогрессирования ИР. При этом аллель А рассматривается как прогностически неблагоприятный фактор формирования нарушений углеводного обмена, перехода от нарушенной толерантности к глюкозе к СД 2 типа [106,114].
1.3.ФНО-α и нарушения липидного обмена
Наиболее частым вариантом дислипидемии является липидная триада,
включающая в себя сочетание гипертриглицеридемии, низкого уровня ХС ЛПВП и повышения фракции мелких плотных частиц ХС ЛПНП [101].
Исследования Quebec Cardiovascular Study показали, что наличие такой триады увеличивает риск развития сердечно-сосудистых заболеваний в 20
раз.
Проведенные исследования представляют данные о проатерогенных свойствах ФНО- , его участии в формировании нарушений метаболизма липидов и развитии атерогенной дислипидемии [29,51]. Было показано, что пациенты с высоким уровнем ФНО- в плазме крови имели большую толщину комплекса интима-медиа (ТКИМ) в общей сонной артерии
в плазме крови имели большую толщину комплекса интима-медиа (ТКИМ) в общей сонной артерии
[189,198,182]. По данным Zinman В. установлено, что уровень ФНО-
ассоциирован с развитием дислипидемии, так как высокий уровень этого белка положительно коррелирует с повышенным содержанием триглицеридов (ТГ) в плазме крови [56]. При этом показано, что повышенная продукция ФНО- in vitro ассоциирована с полиморфизмом G-308A гена ФНО- . Имеются данные, что ФНОопределяет концентрацию ТГ в плазме крови, особенно в постпрандиальный период, способствуя понижению уровня ХС ЛПВП и образованию мелких плотных частиц ХС ЛПНП
in vitro ассоциирована с полиморфизмом G-308A гена ФНО- . Имеются данные, что ФНОопределяет концентрацию ТГ в плазме крови, особенно в постпрандиальный период, способствуя понижению уровня ХС ЛПВП и образованию мелких плотных частиц ХС ЛПНП
[51,61,197]. Введение ФНО-α резко повышало концентрацию ТГ в плазме до
85% [211,29].
27

По данным литературы показано, что ФНО- усиливает процессы липолиза в адипоцитах и гепатоцитах, увеличивает концентрацию свободных жирных кислот как в жировой, так и в печеночной ткани. Сами свободные жирные кислоты являются субстратами для синтеза ТГ [57,191]. Другой механизм, через который ФНОувеличивает уровень ТГ плазмы крови – это торможение распада и элиминации ХС ЛПНП и ХС ЛПНП, что способствует повышению указанных фракций холестерина в крови и развитию дислипидемии [23,148,42]. Кроме изменений метаболизма самих ТГ цитокин ФНОвлияет на обмен ОХ. Было показано в экспериментах, что ФНО-
усиливает процессы липолиза в адипоцитах и гепатоцитах, увеличивает концентрацию свободных жирных кислот как в жировой, так и в печеночной ткани. Сами свободные жирные кислоты являются субстратами для синтеза ТГ [57,191]. Другой механизм, через который ФНОувеличивает уровень ТГ плазмы крови – это торможение распада и элиминации ХС ЛПНП и ХС ЛПНП, что способствует повышению указанных фракций холестерина в крови и развитию дислипидемии [23,148,42]. Кроме изменений метаболизма самих ТГ цитокин ФНОвлияет на обмен ОХ. Было показано в экспериментах, что ФНО-
увеличивает синтез ОХ в печени, стимулируя активность гидроксиметилглутарового кофермента А, при этом наблюдается снижение уровня ХС ЛПВП и меняется качественный состав аполипопротеинов:
уменьшается концентрация Апо-А1 и увеличение Апо-В, что характерно для прогрессирования атеросклеротического процесса (Grunfeld C., 1991).
Предполагается, что ФНО-α влияет на катаболизм ХС ЛПНП, который осуществляется несколькими путями: 1) внепеченочными паренхиматозными клетками посредством взаимодействия с ХС ЛПНП-рецептором (основной путь); 2) системой фагоцитирующих макрофагов-«скевенджеров»
(мусорщиков), которые связавшись с ХС ЛПНП превращаются в пенистые клетки и, как известно, играют ключевую роль в атерогенезе; 3) печенью – с
образованием желчных кислот [198,163].
Накопленные зарубежные и отечественные исследования показали, что при развитии атеросклеротического повреждения и риске острых кардиоваскулярных состояний уровень ФНО-α может повышаться
[9,129,40,47,56,168].Представленные данные позволяют прийти к заключению о связи полиморфизма гена ФНО- с риском развития атерогенной дислипидемии и атеросклероза.
с риском развития атерогенной дислипидемии и атеросклероза.
28
1.4.ФНО-α и ожирение
Как показали исследования последних лет, жировая ткань обладает
ауто-, пара- и эндокринной функцией и секретирует большое количество веществ, обладающих различными биологическими эффектами, которые могут вызвать развитие сопутствующих ожирению осложнений, в том числе и инсулинорезистентности [87,199]. Важную роль в развитии и прогрессировании инсулинорезистентности играет сама висцеральная жировая ткань [215]. Экспериментальные и клинические исследования с использованием клэмп-метода показали прямую зависимость между степенью развития абдоминально-висцеральной жировой ткани и выраженностью инсулинорезистентности [74].
Интенсивный липолиз в висцеральных адипоцитах приводит к выделению большого количества свободных жирных кислот (СЖК),
преимущественно в портальную циркуляцию и печень. В печени СЖК препятствуют связыванию инсулина гепатоцитами, обусловливая развитие инсулинорезистентности на уровне печени, снижение секреции инсулина печенью и развитие системной гиперинсулинемии [124,208].
В последние годы интенсивно изучается роль цитокина ФНО-α в
патогенезе ожирения. Известны два вида связанных с жировой тканью адипоцитокинов: истинные – адипонектин и лептин, и неспецифичные для жировой ткани цитокины, такие как интерлейкин-6, трансформирующий фактор роста-β, ингибитор-1 активатора плазминогена, ангиотензиноген и ФНО-α [114,146].
C современных позиций ФНО-α рассматривается как биологически активный цитокин, который координирует функциональные взаимосвязи между жировой тканью и инсулиночувствительными органами и тканями
[130,70]. ФНО-α стимулирует липолиз в жировой ткани, продукцию свободных жирных кислот, регулирует экспрессию генов ферментов и гормонов, которые индуцируют медиаторные сигналы инсулина [121,171].
29
Многие исследователи рассматривают ФНО-aльфа, как медиатор инсулинорезистентности при ожирении [170]. Экспрессия ФНО-a более всего выражена в адипоцитах висцеральной жировой ткани. ФНО-a снижает активность тирозинкиназы инсулинового рецептора и фосфорилирование тирозина субстрата инсулинового рецептора, а также тормозит экспрессию внутриклеточных переносчиков глюкозы ГЛЮТ-4 в мышечной и жировой ткани [152,174]. Как показано in vivo, ФНО-a может действовать в синергизме с другими цитокинами, секретируемыми адипоцитами -
интерлейкинами-1 и 6, а также стимулировать секрецию лептина [212].
В культуре клеток адипоцитов было показано, что длительная инкубация с ФНО-α снижает уровень мРНК на 85-90 %, а уровень мРНК инсулиновых рецепторов снижается на 50 % (Stephens et al., 1994).
Возможно, важную роль в этом процессе играет один из транскрипционных факторов. Guo, Donner et al. (1996) обнаружили двойственность эффектов ФНО-α на адипоциты в культуре клеток. При кратковременной инкубации ФНО-α потенциирует эффекты инсулина: усиливается фосфорилирование ИРС-1, облегчается связывание с р85 регуляторной субъединицей PI-3
киназы и ее фосфорилирование. Однако при инкубации адипоцитов в течение 5 дней с 0,1 нМ ФНО-α эффекты этого белка становятся прямо противоположными: происходит уменьшение фосфорилирования β-
субъединицы инсулинового рецептора и ИРС-1 [104]. Изучая влияние ФНО-
α на инсулиновые рецепторы в адипоцитах, Gual, Valverde et al. показали,
что инкубация с ФНО-α негативно отражается на процессах фосфорилирования инсулинового рецептора, но никак не влияет на общее число рецепторов и их молекулярную массу [162,181,102].
Большую роль в развитии ожирения отводят локальному повышению уровня ФНО-α. Адипоциты у пациентов с ожирением продуцируют избыточное количество ФНО-α, и его уровень положительно коррелирует с индексом массы тела (ИМТ) и гиперинсулинемией [94,171]. Князева Л.И. и
др., выявили, что у пациентов с ИМТ более 30 кг/м2 по сравнению с
30
