
диссертации / 21
.pdf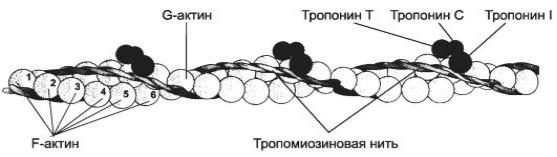
около миозинового филамента и помогает удерживать его в центре саркомера.
Нити титина присоединены к толстым филаментам по всей длине и, продолжаясь в I-диски, прикрепляют концы толстых филаментов к Z-линиям, образуя тайтин-
телетониную связь. Титин прикреплен С-концом к М-диску, а N-концом - к Z-
линии. Таким образом, нити титина связывают М - и Z-линии, и, благодаря своей эластичности, препятствуют перерастяжению мышцы. Они образуют внутри саркомера решетчатую структуру, и поддерживают упорядоченное взаимное расположение системы толстых и тонких миофиламентов. Молекулы титина в районе полосы-I гибкие и функционируют в качестве «эластичных тяжей»,
которые противодействуют пассивному сокращению мышцы и влияют на скорость ее укорачивания [Benichou, Givli, 2011; Зильбернагль, Деспопулос, 2013].
Рис.4. Строение тонкой нити (актинового филамента) [Улумбекова, Челышева, 2009].
Сарколемма формирует Т-систему поперечных трубочек (впячиваний),
которые расположенных перпендикулярно миофибриллам (рис.5).
Саркоплазматический ретикулум образует закрытые полости, несвязанные с внеклеточным и внутриклеточным пространствами. Большинство этих полостей располагается вдоль миофибрилл и разделяется на два отдела: терминальные цистерны (ТЦ), контактирующие с трубочками Т-системы (ТТ), и продолговатые трубочки, расположенные в центральной части саркомеров (рис.5) [Рубцов, 2000].
Конечные участки Т-трубочек проникают в промежуток между двумя терминальными цистернами саркоплазматической сети, формируя вместе с ними особые структуры - триады (рис.5) [Хэм, Кормак, 1983]. Структурная гетерогенность саркоплазматического ретикулума определяется различными функциями его отделов: продольные цистерны поглощают Са2+, а терминальные
21
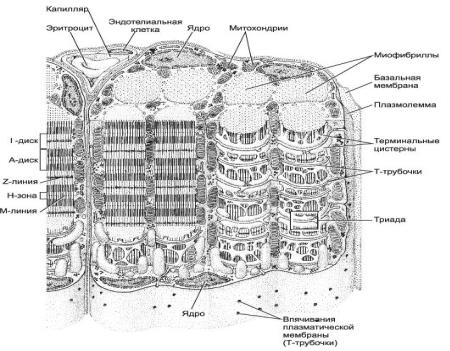
цистерны способны к выбросу Са2+ в ответ на деполяризацию сарколеммы.
Мембраны терминальных цистерн саркоплазматического ретикулума непосредственно соединены с мембранами Т-трубочек посредством, так называемых соединительных ножек (СН) [Рубцов, 2000].
Рис. 5. Схема строения мышечного волокна [Рубцов , 2000].
Выделение Са2+ происходит после того, как волна деполяризации с поверхности сарколеммы по Т-трубочкам распространяется вглубь волокна. В
области триад возбуждение передается на мембрану саркоплазматической сети и вызывает повышение ее проницаемости. Это приводит к быстрому выделению из ее элементов ионов кальция. Обратный транспорт Са2+ осуществляется благодаря деятельности кальциевых насосов в мембране саркоплазматической сети,
уменьшение концентрации кальция приводит к расслаблению мышечного волокна
[Рубцов, 2000].
Энергетический аппарат мышечных волокон представлен митохондриями и трофическими включениями, содержащими вещества, расщепление которых служит источником энергии. Энергия, необходима для осуществления мышечной работы запасается в мышечных волокнах в виде АТФ и фосфокреатинина–
22
энергоемких фосфатных соединений.
1.1.2Митохондриальная сеть скелетных мышечных волокон
1.1.2.1Строение митохондрий
Известно, что митохондрии играют ключевую роль в энергообеспечении всех клеток организма человека и участвуют в различных метаболических процессах.
Митохондрии выполняют жизненно важные для каждой клетки функции, однако,
их основная роль - образование молекул АТФ в биохимических циклах клеточного дыхания. Накопленная энергия в последующем трансформируется в меха-
ническую (в мышечной ткани), в биоэлектрическую (в нервной и мышечной тканях) и другие виды энергии.
Для полноценного функционирования митохондрии необходимо около 3000
генов, только 37 из них кодируется мтДНК, остальные ядерной. Примерно 3% из необходимых митохондрии генов (около 100) задействованы для генерирования АТФ, более 95% (около 2900) – вовлечены в другие функции, необходимые для роста, развития и созревания тканей, в частности в процессы дифференцировки клетки [Dabke et.al. 2012]. Также основными биохимическими процессами,
происходящими в митохондриях, являются: цикл трикарбоновых кислот,
карнитиновый цикл, окисление жирных кислот, транспорт электронов в дыхательной цепи и окислительное фосфорилирование [Дадали, 1996].
Митохондрии играют определенную роль в регуляции апоптоза, образовании стероидов, регуляции внутриклеточного распределения кальция [Scheffler, 2001].
В последнее время стало известно, что митохондрии играют важную роль в метаболизме железа [Richardson et al., 2010], участвуют в сигнальных путях клетки [Tait, Green, 2012], а также в передаче сигналов к клеточной гибели и аутофагии.
Ограниченный внутренней мембраной матрикс митохондрий представляет собой относительно гомогенную структуру с умеренной электронной плотностью.
Содержимое матрикса – это субстраты и ферменты цикла Кребса и некоторых
23
других этапов энергетического метаболизма (цитратсинтетаза, изоцитратдегидро-
геназа, фумараза, малатдегидрогеназа, аконитаза и др.), (от 2 до 10) копий митохондриальной дезоксирибонуклеиновой кислоты (мтДНК), митохондриаль-
ные рибосомы, рибонуклеиновая кислота (РНК) и ферменты, участвующие в экспрессии митохондриального генома. Каждая молекула мтДНК содержит около
17000 пар нуклеотидов [Naviaux, 2003]. Генетический код мтДНК отличен от ядерного кода всех млекопитающих, так и бактериального. Так кодон АУА
(аденин-урацил-аденин) кодирует метионин вместо изолейцина; кодоны АГА
(аденин-гуанин-аденин) и АГГ (аденин-гуанин-гуанин), обычно кодирующие аргинин, в митохондриях являются стоп-кодонами; кодон УГА (урацил-гуанин-
аденин), стандартно являющийся стоп-кодоном, кодирует триптофан. Все белки,
синтезируемые митохондриальной трансляционной системой, локализованы на внутренней мембране митохондрий [Литвинова и др., 2014].
Внутренняя мембрана митохондрий – уникальная структура, определяющая выполнение всех основных митохондриальных функций. Толщина внутренней мембраны около 7 нм для нее характерно наличие крист, обращенных в матрикс,
поэтому общая поверхность внутренней мембраны в несколько раз превышает поверхность наружной мембраны [Palade, 1953]. Кристы необходимы для регулирования динамического распределения белков и липидов, а также растворимых метаболитов между отдельными митохондриальными субкомпартментами. Морфология крист связана с митохондриальными функциями [Nabi, 2011]. Более 10% всех фосфолипидов внутренней мембраны составляет кардиолипин. Важнейшей специфической составляющей внутренней мембраны являются ферментные комплексы дыхательной цепи и метаболизма АТФ, состоящие, по меньшей мере, из 60 полипептидных цепей [Hatefi, 1985].
Молекулы дыхательных ферментов свободно передвигаются в плоскости мембраны, поэтому нет необходимости в их структурно упорядоченной цепочке.
Межмембранное пространство имеет ширину 10-20 нм. По составу малых молекул его содержимое близко содержимому гиалоплазмы. Здесь находятся несколько ферментов, использующих выходящей из матрикса АТФ для
24
фосфорилирования других нуклеотидов. Наружная мембрана имеет толщину около 7 нм. Мембрана содержит большое количество молекул транспортного белка порина и благодаря этому почти свободно пропускает молекулы массой до
5000 дальтон, в том числе и белки [Ernster, Schatz, 1981].
Количество и размеры митохондрий, как и их крист, варьируют в разных клетках и тканях [Fawcett, 1966; Munn, 1974]. Митохондрии подразделяются на два ультраструктурных типа: митохондрии с ламеллярными (пластинчатыми)
кристами, характерные для большинства тканей, и с тубуловезикулярными кристами, характерные для стероид-продуцирующих клеток. Количество крист зависит от интенсивности тканевого энергообмена. Вариабельность митохондриальной ультраструктуры отражает вариабельность состояния энергетического обмена в этих органеллах [Hackenbrock,1966; Green, 1973].
1.1.2.2 Роль митохондрий в регуляции миогенеза
Недавние исследования показали, что митохондрии могут участвовать в регуляции миогенеза [Wagatsuma, Sakuma, 2013]. Во время миогенеза увеличивается митохондриальная масса, объём, количество мтДНК и активность митохондриальных ферментов. В различных тканях было выявлено, что функции митохондрий и их активность тесно связаны с клеточной дифференцировкой
[Brunk, Yaffe, 1976; Hamai,et al., 1997; Seyer et al., 2011]. Недавно было показано,
что при дифференцировке миобластов, активность митохондриальных ферментов резко возрастает [Moyes et al., 1997; Barbieri et al., 2011]. Кроме того, регенерация мышц сопровождается повышением активности митохондриальных ферментов
[Duguez et al., 2002; Wagatsuma et al., 2011]. Митохондриальный биогенез – жизненно важный процесс в образовании и деградации органелл [Hood, 2001; Terman et al., 2010], охватывает синтез липидов и белков в митохондриях, сборку дыхательной цепи, репликацию мтДНК [Kim et al., 2007; Hock, Kralli, 2009]. Этот сложный процесс требует координированной экспрессии ядерных и митохондриальных геномов [Ryan, Hoogenraad, 2007].
В настоящее время известно более 1000 различных белков в митохондриях
25
млекопитающих [Calvo, Mootha, 2010]. Большинство митохондриальных белков кодируется ядерным геномом и синтезировано на цитоплазматических рибосомах
[Goffart, Wiesner, 2003; Ryan, Hoogenraad, 2007]. В то время как меньшая часть их кодируется и синтезируется в митохондриях. Митохондриальный геном содержит
37 генов, кодирующих 13 генов (иРНК), участвующих в окислительном фосфорилировании, 22 гена транспортные РНК (тРНК) и 2 гена рибосомальные РНК (рРНК) (по одному гену для 12S и 16S рРНК), которые необходимы для синтеза митохондриальных белков [Anderson et al., 1981; Shanske, 1992]. В клетке человека около 10 000 копий мтДНК [Сухоруков, 2011].
Митохондриальный биогенез контролируется коактиваторами митохондрий: рецептором гена коактиватор-1 альфа (PGC-1a), PGC-1β [Lin et al., 2002] и КНР [Anderson et al., 1981; Lin et al., 2002]. Эти коактиваторы регулируют экспрессию митохондриальных генов. Авторы экспериментально показали, что митохондриальный биогенез стимулирует регенерацию мышц [Duguez et al., 2002]. Активация митохондриального биогенеза происходит за счет скоординированной экспрессии транскрипционных коактиваторов PGC-1a,
транскрипционных факторов и ядерных рецепторов [Duguez et al., 2002].
Благодаря современным методам было выявлено, что митохондрии играют существенную роль в регуляции миогенеза и регенерации мышц. Миогенин, c- Myc, кальценеврин были идентифицированы, как молекулы митохондриальной мишени, которые регулируются активностью ферментов митохондрий. Известно,
что именно эти гены играют ключевую роль в регулировании миогенеза [Yeilding et al.,1998].
Новый взгляд на роль митохондрий в регуляции миогенеза инициировал новое представление об этих органеллах. В экспериментальных работах на трансгенных мышах было показано, что экспрессия PGC-1a в скелетных мышцах сохраняет функции митохондрий, нервно-мышечные синапсы и целостность мышц при старении [Wenz et. Al, 2009], митохондриальная генная терапия может эффективно применяться при лечении травм и патологии мышц [Jash, Adhya, 2012].
26
1.1.2.3 Митохондрии мышечного волокна
Структура митохондрий отличается тканевой специфичностью, которая в первую очередь зависит от метаболических особенностей конкретных клеток.
Морфологические различия касаются внутренней организации органелл - формы и числа крист, плотности матрикса и т.д. [Kuznetsov, 2009]. Кроме того,
морфология митохондрий изменяется и в ходе клеточной дифференцировки.
Размеры митохондрий, как и форма, тоже очень непостоянны. Поэтому нужно с осторожностью относиться к прямой экстраполяции результатов, полученных в клеточных культурах, на зрелые специализированные клетки in vivo, а также с одних клеточных типов на другие. Это обстоятельство приобретает особую важность, когда речь идет о высокоспециализированных мышечных тканях.
Например, для большинства метаболически активных клеток выявлена тенденция к объединению митохондрий [Skulachev, 2001], а для метаболически неактивных клеток характерны фрагментированные органеллы [Collins, 2002]. Миобласты и зрелые мышечные волокна демонстрируют существенные различия, как в организации митохондрий, так и в уровнях экспрессии и функциях белков митохондриальной динамики [Bloemberg, 2012].
1.1.2.4 Особенности структурной организации митохондрий в мышечных
волокнах
Зональная гетерогенность
В зависимости от локализации митохондрий в мышечных волокнах человека принято выделять три популяции митохондрий: субсарколеммальную,
околоядерную и межмиофибриллярную, которые отличаются по уровню ключевых ферментов и морфологии [Picard et al., 2012]. Межмиофибриллярные митохондрии специализированы на энергоснабжении миозина и АТФазы саркоплазматической сети. Здесь самая строгая пространственная организация митохондрий. В субсарколеммальной и перинуклеарной участках митохондриальная сеть менее упорядочена и ее элементы, помимо основной
27
функции, вовлечены во внутриклеточные сигнальные пути. Субсарколеммальные митохондрии также участвуют в поддержании ионного гомеостаза, а
перинуклеарные – в процессах транскрипции и трансляции [Долгов и др., 2007].
Субсарколеммальные и околоядерные популяции имеют более низкий окислительный потенциал, производят больше активных форм кислорода и более устойчивы к повышению концентрации ионов кальция, чем межмиофибрил-
лярные митохондрии [Adhihetty, 2005].
В сердечной мышце человека субсарколлемальные митохондрии содержат пластинчатые кристы, а межмиофибриллярные митохондрий в основном трубчатые кристы [Hoppel et al., 2009]. Субсарколеммальные митохондрии более чувствительны к изменениям генома, чем межмиофибриллярные [Barbieri et al., 2014].
Межмитохондриальные контакты
Функциональное и структурное единство митохондриальной системы жизненно необходимо для мышечных волокон, которые отличаются высоким энергопотреблением, и в момент сокращения требуют предельной синхронизации в работе всего многоядерного симпласта. Между митохондриями в поперечно-
полосатых мышечных тканях были обнаружены соединения, названные межмитохондриальными контактами. Они функционируют по принципу клемм-
контактов, превращая митохондриальный ретикулум в кооперативную сеть
«электрических кабелей», которые обеспечивают синхронное поступление АТФ ко всем саркомерам мышечного волокна [Skulachev, 2001; Bakeeva et al., 1978].
28
1.2 МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ ПРИ ВРОЖДЕННОЙ МИОПАТИИ ЦЕНТРАЛЬНОГО
СТЕРЖНЯ И МИТОХОНДРИАЛЬНОЙ МИОПАТИИ
1.2.1 Ультраструктурные изменения скелетных мышечных волокон при врожденной миопатии центрального стержня
Нервно-мышечные заболевания, в частности, обусловленные генетическими дефектами миопатии являются наиболее частыми и нередко фатальными наследственными заболеваниями человека. Только при одном заболевании – врожденной миопатии центрального стержня заболеваемость составляет от 3 до 6
на 100000 человек. Врожденные структурные миопатии являются группой редких, клинически и генетически гетерогенных заболеваний скелетномышечной ткани, с разными типами наследования и многообразия вариантов течения.
Общими клиническими проявлениями, как правило, являются мышечная гипотония, атрофия мышц, структурные аномалии скелета [Сухоруков, Харламов, 2010]. Мышечная гипотония обычно преобладает в мышцах тазового пояса и проксимальных отделах ног. Мышцы плечевого пояса и рук поражаются в меньшей степени [Shy, Magee, 1956; Dubowitz, 1986]. Среди них первое место по частоте занимает врожденная миопатия «центрального стержня», наследуемая по доминантному типу и аллельная по отношению к злокачественной гипертермии,
впервые описана Shy и Magee в 1956 году. Она вызывается мутацией в гене рианодинового рецептора (RYR1) на 19 хромосоме (локус q13.1). Диагноз врожденной миопатии центрального стержня ставится на основании мышечной биопсии в сочетании с характерными клиническими чертами [Quinlivan et al., 2003]. Существенным отличием патологических изменений при этом является отсутствие в группе врожденных структурных миопатий изменений, характерных для миодистрофии – в первую очередь, некрозов мышечных волокон с замещением их соединительной тканью. Мышечная ткань при неспецифических методах гистологической окраски может выглядеть практически нормальной. Тем не менее, важно отметить, по крайней мере, один неспецифический признак,
29
очень характерный для большинства структурных миопатий – миогенную атрофию мышечных волокон, при которой внутри каждого пучка определяется различие их размеров [Сухоруков, Харламов 2010].
Для миопатии центрального стержня характерной особенностью является наличие в скелетном мышечном волокне так называемых «стержней» -
функционально обособленных зон в центре мышечных волокон, в которых отмечается резкое снижение или отсутствие практически всех видов ферментной активности. При этом периферическая зона волокна остается относительно нормальной и функционирует [цит. по Engel, Franzini-Armstrong, 2004]. Как правило «стержни» единичны и встречаются в центре мышечного волокна, но иногда их может быть несколько в пределах одного волокна. Помимо
«стержневых» участков, часто наблюдается изменение размера миофибрилл и увеличение размеров ядер в мышечном волокне. «Стержневые» участки,
содержащие плотно упакованные и дезорганизованые миофибриллы лишены нормальных митохондрий и саркоплазматического ретикулума, а так же в них изменена система Т-трубочек и понижено содержание гликогена [Hayashi, Miller, 1989].
Центральные участки («стержни») скелетных мышечных волокон были разделены на два типа. Структурированные «стержни», в которых сохраняются основные черты саркомеров, хотя они и не характеризуются обычными соотношениями с нормальными саркомерами за пределами «стержневой» зоны и друг с другом. В частности, они укорочены, по сравнению с периферическими саркомерами. Миофибриллы в них более плотно упакованы, а Z-полоски могут быть утолщены или могут быть волнистыми. Неструктурированные «стержни» характеризуются утратой основных черт саркомеров в результате дегенерации миофибрилл. Структурированные и неструктурированные «стержни» при данной патологии могут быть одновременно обнаружены в скелетномышечной ткани
[Engel, Franzini-Armstrong, 2004].
Пока не ясно, на какой стадии заболевания появляются «стержни» и от чего зависит скорость развития данного патологического процесса. В доступной
30
