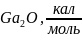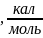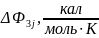- •Аннотация
- •Содержание
- •Введение
- •1. Химическое осаждение арсенида галия из газовой фазы в системе GaAs – h2o – h2
- •Расчет констант равновесия
- •Расчёт состава газовой фазы
- •Определение области стехиометричности твердой фазы
- •2. Диффузионное легирование полупроводников
- •Заключение
- •Список использованных источников
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра ФЭТ
Курсовая РАБОТА
по дисциплине «Физико-химические основы технологии изделий электроники и наноэлектроники»
Тема: Расчёт газотранспортных и диффузионных процессов в технологии электронных приборов
Вариант №2
Студент гр. 9201 |
|
Рауан М. |
Преподаватель |
|
Зубко С.П. |
Санкт-Петербург
2021
ЗАДАНИЕ
на курсовую работу
Студент Рауан Мирас |
||
Группа 9201 |
||
Часть 1. Химическое осаждение арсенида галлия из газовой фазы в системе GaAs – H2O – H2.
Исходные данные: - Температурный интервал Т = (700 …. 1300 ) К - Относительная влажность водорода: 7103…. 101 . - Суммарное давление в системе 5103 Па 1. Рассчитать и построить kp1(T); kp2(T); kp3(T). 2. Определить степень превращения в химической системе. 3. Рассчитать и построить зависимости pH2O(T,a); pGa2O(T,a); pAs2(T,a). 4. Рассчитать и построить температурные зависимости G2(T,a) ; G3(T,a) для заданных a. 5. Определить область равновесия газовой фазы и требуемой стехиометричной твердой фазы.
Часть 2 Диффузионное легирование полупроводников
Рассчитать профиль распределения концентрации примеси в n-p-n-структуре, полученной последовательной диффузией бора и фосфора в кремнии.
Исходное удельное сопротивление в полупроводнике n-типа 0,15 Омсм. Режимы диффузии : 1. Ta = 1200С, ta = 1 ч, Tд = 1100С, tд = 2 ч. 2. Ta = 1100С, ta = 2 ч, Tд = 1250С, tд = 1 ч Поверхностная плотность атомов бора Na = 510 14 см – 2 , диффузия фосфора ведётся из неограниченного источника примеси с поверхностной концентрацией, равной предельной растворимости.
Работа должна содержать выводы и технологические рекомендации
|
||
Содержание пояснительной записки: «Содержание», «Введение», «Химическое осаждение арсенида галия из газовой фазы в системе GaAs – H2O – H2», «Диффузионное легирование полупроводников», «Заключение», «Список использованных источников»
Предполагаемый объем пояснительной записки: Не менее 25 страниц. |
||
Дата выдачи задания: 01.11.2021 |
||
Дата сдачи реферата: 17.11.2021 |
||
Дата защиты реферата: 00.00.2000 |
||
Студент |
|
Рауан М. |
Преподаватель |
|
Зубко С.П. |
Аннотация
В данной курсовой работе будут рассчитаны параметры производственных процессов. Полученные результаты позволят оценить производительность процессов при заданных условиях.
Summary
In this course work, the parameters of production processes will be calculated. The results obtained will make it possible to assess the performance of the processes under the given conditions.
Содержание
|
Введение |
6 |
1. |
Химическое осаждение арсенида галлия из газовой фазы в системе GaAs – H2O – H2. |
7 |
1.1. |
Расчет констант химического равновесия |
7 |
1.2. |
Расчет состава газовой фазы |
13 |
1.3. |
Определение области стехиометричности твердой фазы |
15 |
2. |
Диффузионное легирование полупроводников |
18 |
2.1. |
1-й режим диффузии |
18 |
2.2. |
2-й режим диффузии |
21 |
|
Заключение |
23 |
|
Список использованных источников |
24 |
|
|
|
|
|
|
|
|
|
|
|
|
Введение
Целью данной курсовой работы является анализ таких технологических процессов, как химическое осаждение из газовой фазы и диффузионное легирование полупроводников. Для данных процессов будут рассчитаны основные термодинамические параметры и определены технологические особенности – определена область стехиометричности твердой фазы, область равновесия газовой фазы и условия их реализации, будет рассчитан профиль распределения концентрации примеси в n-p-n-структуре, полученной последовательной диффузией.
1. Химическое осаждение арсенида галия из газовой фазы в системе GaAs – h2o – h2
Расчет констант равновесия
Основная газотранспортная реакция:
2 InAsтв + H2Oгаз ↔ H2газ + In2Огаз + As2газ
Конкурирующие реакции:
 InAsтв
+ H2Oгаз
↔ H2газ +
InAsтв
+ H2Oгаз
↔ H2газ +
 In2О3тв
+
As2газ
In2О3тв
+
As2газ
2InAsтв ↔ 2In + As2газ
Таблица
1 – Заданные значения относительной
влажности
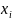
|
|
|
|
|
0,007 |
0,01 |
0,03 |
0,07 |
0,1 |
Таблица
2 – Заданные значения температуры

|
|
|
|
|
|
|
700 |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
Таблица 3 – Заданные значения стандартного термодинамического потенциала для компонентов реакций
|
|
|
|
33,15 |
47,41 |
59,6 |
80,34 |
33,72 |
48,09 |
60,29 |
81,88 |
34,25 |
48,75 |
60,95 |
83,34 |
34,76 |
49,38 |
61,58 |
84,76 |
35,24 |
49,99 |
62,17 |
86,11 |
35,69 |
50,58 |
62,74 |
87,35 |
36,13 |
51,14 |
63,28 |
88,36 |
Продолжение таблицы 3
|
|
|
|
73,03 |
25,63 |
19,9 |
16,27 |
74,07 |
27,38 |
20,79 |
16,76 |
75,08 |
29,07 |
21,57 |
17,2 |
76,04 |
30,71 |
22,27 |
17,65 |
76,96 |
32,3 |
22,9 |
18,1 |
77,83 |
33,82 |
23,48 |
18,43 |
78,66 |
35,24 |
24,01 |
18,88 |
Таблица 4 – Заданные значения энтальпии для компонентов реакций
ΔH298_ |
0 |
ΔH298_ |
|
ΔH298_ |
|
ΔH298_ |
|
ΔH298_ |
|
ΔH298_ |
|
ΔH298_Ga |
|
ΔH298_GaAs |
|
Расчет величин:



Таблица 5 – Полученные значения термодинамического потенциала реакций
|
|
|
85,83 |
3,303 |
66,86 |
86,47 |
3,68 |
68,35 |
87,13 |
4,04 |
69,69 |
87,7 |
4,377 |
70,82 |
88,18 |
4,673 |
71,77 |
88,82 |
5,01 |
72,84 |
89,17 |
5,243 |
73,54 |
 ΔH298_
ΔH298_

 ΔH298_
ΔH298_






Первая реакция
Изобарный потенциал основной реакции:

С помощью полученного изобарного потенциала рассчитаем константу равновесия:

R
=
1,987


Рисунок 1 – Зависимость константы равновесия первой реакции от температуры
Вторая реакция
Аналогично первой реакции:


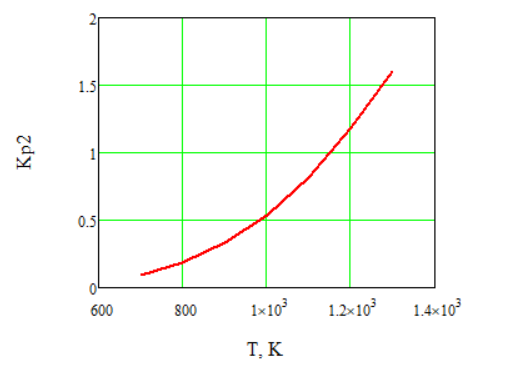
Рисунок 2 – Зависимость константы равновесия второй реакции от температуры
Третья реакция



Рисунок 3 – Зависимость константы равновесия третьей реакции от температуры
Для основной реакции рассчитаем степень превращения и построим график:
Суммарное
давление в системе

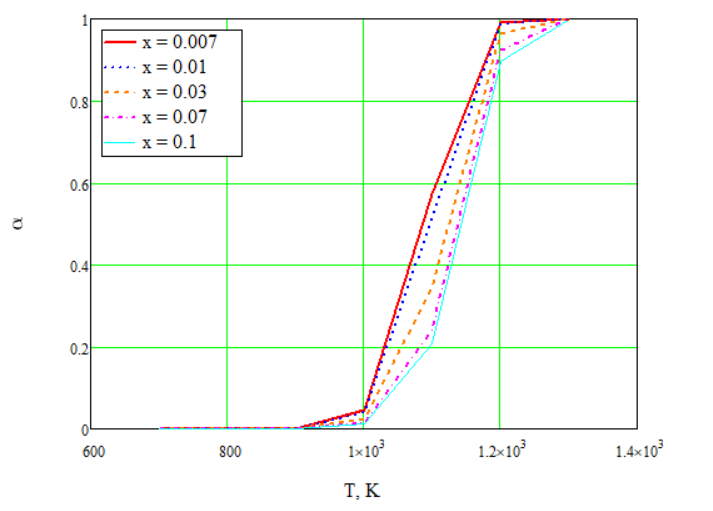
Рисунок 4 – Зависимость степени превращения от температуры