
Вороненко Т. І. Розв’язування задач з хімії. 10-11 класи
.pdf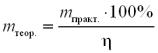
Крок 3. Записуємо рівняння хімічної реакції і встановлюємо
співвідношення фенолу і смоли:
nС6Н5ОН + |
nН2СО → (С6Н3ОНСH2)n + nН2О |
n моль |
n моль |
n (С6Н5ОН) : n (С6Н3ОНСH2)n = 1 : 1. Крок 4. Обчислюємо масу фенолу.
З рівняння реакції випливає, що з n моль фенолу утворюється n моль
смоли. Отже для отримання 283 моль смоли необхідно 283 моль фенолу.
m (фенолу) = n (фенолу) · M (фенолу)
m (фенолу)= 283 · 94 = 26602 (г) = 26,602 (кг) ≈ 26,6 (кг).
Відповідь: m(фенолу) = 26,6 кг.
Задача 3. Негашене вапно СаО широко використовують в будівництві.
Кальцій оксид одержують при прожарюванні вапняку. Обчисліть, яка маса (т)
вапняку, що містить 20% домішок необхідна для одержання 22,4 т кальцій оксиду? Вихід продукту реакції від теоретично складає 80%.
Дано: |
Допоміжні дані |
|
|
η = 80% |
М (CаО) = 56 г/моль |
ω (домішок) = 20% |
М (СаСО3) = 100 г/моль |
m (СаО)практ = 22,4 т = 2,24·107 г |
|
|
|
m (CаСО3) – ? |
|
|
Розв’язання |
|
Крок 1. Обчислюємо теоретичний вихід маси кальцій оксиду за формулою:
m (СаО)n теор = 2,24·107 · 100 / 80 = 2,8·107 (г).
Крок 2. Обчислюємо кількість речовини СаО (теоретичний вихід).
За формулою:
n = m / M
n (СаО) = 2,8·107 / 56 = 0,05·107 (моль);
141
Крок 3. Записуємо рівняння хімічної реакції і встановлюємо
співвідношення сполук.
СаСО3 → СаО + СО2
1 моль |
1 моль |
|
n (СаСО3) : n (СаО) = |
1 : 1. |
|
Крок 4. Обчислюємо масу кальцій карбонату. |
|
|
З рівняння реакції випливає, що з 1 моль кальцій карбонату утворюється 1 |
||
моль кальцій оксиду. Отже для отримання 0,05·107 |
моль СаО необхідно 0,05·107 |
|
моль СаСО3. |
|
|
m (СаСО3) = n (СаСО3) · M (СаСО3) m (СаСО3) = 0,05·107 · 100 = 5·107 (г).
Крок 5. Обчислюємо масову частку кальцій карбонату у вапняку.
За формулою:
ω(суміші) = ω (речовини) + ω (домішок) = 100%
ω(р-ни) = 100% – ω (домішок)
ω (СаСО3) = 100% – 20% = 80% (0,8).
Крок 6. Обчислюємо масу вапняку за формулою:
ω (р-ни) = m (р-ни) / m (сум.) m (сум.) = m (реч.) / ω (реч.)
m (вапняку) = 5·107 / 0,8 = 6,25·107 (г) = 6,25 (т).
Відповідь: m (вапняку) = 6,25 т.
Заняття 17. ЗАКЛЮЧНЕ ЗАНЯТТЯ
Задачі для самостійного розв’язування.
Задача 1. На теплоелектростанціях, як паливо використовують (природний газ) метан, кокс, торф. Встановіть, тепловий ефект горіння якого з палив є найбільш ефективним, якщо при спалюванні 4 л метану виділяється 159 кДж, 5
кг вугілля (С) – 170833 кДж, 10 кг торфу (С) – 96000кДж.
142
Задача 2. До водного розчину масою 8 г з масовою часткою етаналю 22%
прилили надлишок аміачного розчину оксиду срібла. Обчисліть масу утвореного осаду.
Задача 3. Обчисліть вміст метану (%) в суміші з киснем, якщо відомо, що 9
мл газової суміші після спалювання метану зменшилась в об’ємі на 0,45 мл. Вважати,
що пара води сконденсувалася повністю.
Задача 4. До суміші 2 л метану й ацетилену добавлено 2 л водню. Після того, як уся суміш була пропущена над нагрітим платиновим каталізатором, її об’єм зменшився до 3,2 л, а продукти реакції не містили ненасичених вуглеводнів. Визначити об’ємні частки вуглеводнів у вихідній суміші якщо всі об’єми газів виміряні за однакових умов.
143
Додатки
Додаток 1
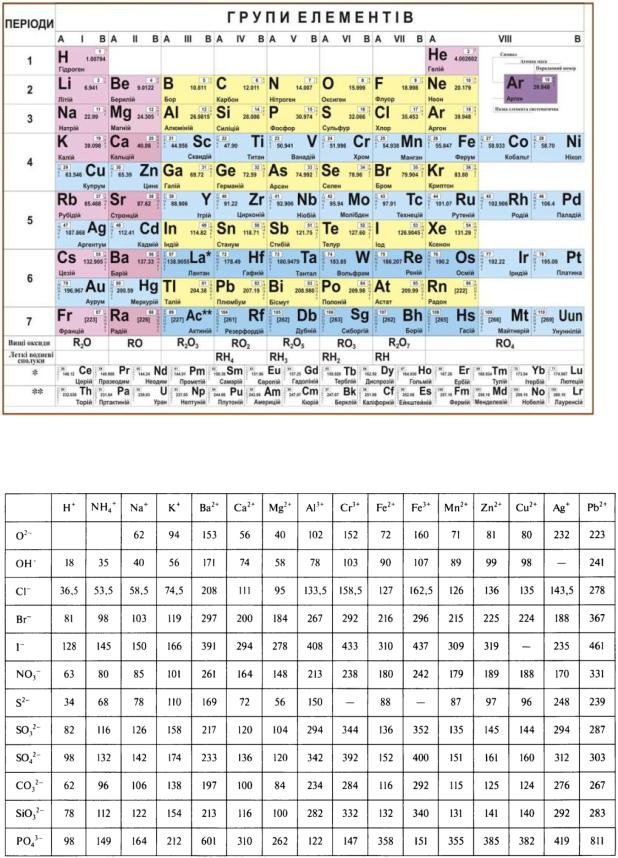
Періодична система хімічних елементів
Додаток 2
Таблиця відносних молекулярних мас неорганічних сполук
144
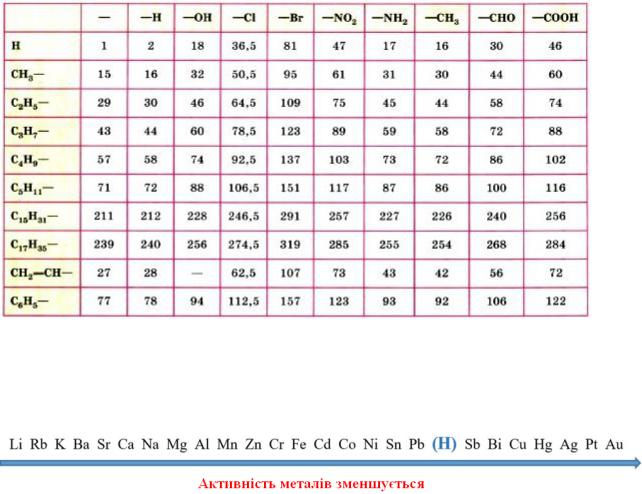
Додаток 3
Таблиця відносних молекулярних мас органічних сполук
Додаток 4
Ряд активності металів (електрохімічний ряд напруг)
145
НАВЧАЛЬНЕ ВИДАННЯ
Вороненко Тетяна Іванівна
Розв’язування задач з хімії. 10-11 класи
навчальний посібник
(Електронне видання)
Обсяг вид. 4,0 авт. арк.
Видавництво «Педагогічна думка» 04053, м. Київ,
вул. Січових Стрільців, 52-а, корп. 2; тел./факс: (044) 481-38-85
e-mail: book-xl@ukr.net
Свідоцтво про внесення суб’єкта видавничої справи до Державного реєстру видавців, виготовлювачів
і розповсюджувачів видавничої продукції Серія ДК № 3563 від 28.08. 2009 р.
