
Molekuljarnaja Biologija Kletki v2
.pdf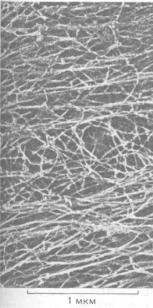
321
азатем и сократимое кольцо, и все это происходит как единая контролируемая цепь событий.
Вэтом разделе мы рассмотрим взаимодействия между главными системами филаментов цитоскелета в связи с тремя его функциями. Сначала мы выясним, каким образом цитоскелет организует содержимое цитоплазмы, включая те ее компоненты, которые обычно считают свободно растворенными. Затем мы перейдем к вопросу о том, как координированная работа цитоскелета обеспечивает направленное передвижение животной клетки по твердому субстрату. И наконец, мы обсудим, как цитоскелет порождает те многочисленные морфологические изменения, которые происходят в процессе развития зародыша. В результате этого рассмотрения станет ясно, насколько фрагментарны пока наши представления о молекулярных механизмах этих фундаментальных процессов.
11.6.1. В цитоплазме имеется сложная трехмерная сеть белковых нитей [58]
Мы уже знаем, что кортикальная цитоплазма многих животных клеток содержит сети из поперечносшитых актиновых филаментов. Подобные же сети, но образованные взаимодействующими актиновыми филаментами, микротрубочками и промежуточными филаментами, пронизывают всю цитоплазму. Наиболее отчетливо они видны после экстракции клеток неионным детергентом, которая удаляет фосфолипиды и растворимые белки. Если обработанные таким образом клетки быстро заморозить и подвергнуть глубокому травлению, то металлическая реплика с полученного препарата выявит поразительную картину цитоскелета (рис. 11-78). Различные типы белковых филаментов можно распознать по их толщине, а в некоторых случаях и по расположению их белковых субъединиц. Часто бывает видно, что соседние филаменты соединены более тонкими нитями, белки которых тоже были в ряде случаев идентифицированы с помощью антител. Это оказались различные виды белков, ассоциированных с микротрубочками, и длинные гибкие боковые отростки, отходящие от субъединиц промежуточных филаментов некоторых типов (см. рис. 11-77, А). Однако в большинстве случаев белки, образующие поперечные сшивки, пока не известны.
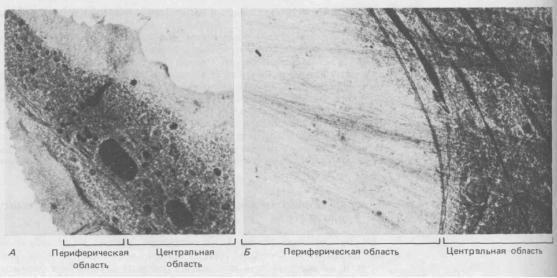
В клетках, не обработанных детергентом, структура цитоплазмы еще сложнее. Пространство между филаментами цитоскелета заполнено зернистым «основным веществом» ("ground substance"), которое, как считают, представляет собой очень концентрированную смесь «растворимых» белков, имеющихся в живой клетке. Разнообразные мембранные органеллы тоже погружены в этот плотный матрикс и соединены с филаментами цитоскелета тонкими белковыми нитями. И гранулярного материала, и органелл тем больше, чем ближе к центральной области клетки, где сосредоточены микротрубочки и промежуточные филаменты и где, как можно увидеть при помощи светового микроскопа с видеоприставкой, происходит большая часть процессов цитоплазматического транспорта. В более периферийных участках значительно гуще сеть актиновых филаментов, которые как бы вытесняют оттуда большую часть мембранных органелл, а возможно, и какую-то долю гранулярного материала (рис. 11-79). Эта густая сеть прикреплена к плазматической мембране и соответствует богатому актином кортексу клетки, о котором уже говорилось ранее (разд. 11.2).
Рис. 11-78. Цитоплазма фибробласта, экстрагированного неионным детергентом (электронная микрофотография, глубокое травление). Большинство тянущихся слева направо прямых волокон, образующих рыхлые пучки, - это актиновые филаменты, а перепутанные волокна в
середине фото - в основном промежуточные филаменты. (С любезного разрешения John Heuser и Marc Kirschner.)
322
Рис. 11-79. Трансмиссионная электронная микрофотография фибробласта, замороженного «живьем», выявляет на периферии клетки участок, свободный от органелл, а ближе к центру-наоборот, богатую органеллами область (А). Граница между этими двумя областями при сильном
увеличении видна более отчетливо (Б). (Р. С. Bridgman, В. Kachar, Т. S. Reese, J. Cell Biol. 102: 1510-1521, 1986. С разрешения Rockefeller Univ. Press.)
11.6.2. Насколько упорядочена организация цитоплазмы? [59]
Когда мембранные органеллы цитоплазмы быстро перемещаются с места на место, они движутся по белковым «дорожкам», с которыми соединены специальными мостиками. Как мы уже говорили, движение вдоль микротрубочек осуществляется с помощью кинезина и динеиноподобных белков (разд. 11.4.9), а вдоль актиновых филаментов с помощью миозиноподобных белков (разд. 11.2.4). Кластеры рибосом в цитозоле тоже нередко находятся в ассоциации с филаментами; при экстрагировании клеток неионными детергентами значительная часть аппарата белкового синтеза остается связанной с цитоскелетом. Даже растворимые ферменты, в том числе некоторые ферменты гликолиза, по-видимому, «сидят» на специфических участках миофибрилл в мышечных клетках и стрессовых волокон в фибробластах, и здесь их можно выявить с помощью флуоресцентных антител.
Степень структурной организованности цитозоля в настоящее время является предметом споров. Источник наших знаний об идущих в цитозоле процессах - это в основном биохимические исследования, а они начинаются с гомогенизации клетки, так как только после этого можно определять активность ферментов и выделять их в очищенном виде. Успехи такого подхода привели многих биохимиков к представлению о цитозоле как о простом растворе ферментов. Однако другие исследователи склонны полагать, что едва ли не большинство ферментов цитозоля собрано в группы по принадлежности к тому или иному биохимическому пути и прикреплено к цитоскелету так, чтобы обеспечить более быстрое и эффективное прохождение метаболитов по каждому из таких путей. Поскольку это прикрепление, вероятно, непрочно и связи легко разрушаются, для его убедительной демонстрации могут потребоваться новые методы - такие, например, как инъекции в живые клетки белков с флуоресцентными метками (разд. 4.2.3).
323
11.6.3. Растягивание актинового кортекса способно вызывать поляризацию клетки, необходимую для ее направленного движения [60]
Цитоскелет не только служит каркасом для прикрепления и перемещения питоплазматических компонентов, но и обеспечивает возможность миграции клеток. Несмотря на новейшие успехи в выяснении структуры и функции цитоскелета, механизм, с помощью которого животные клетки ползают по поверхности субстрата, пока еще плохо изучен. Для эффективного передвижения необходимо, чтобы клетка была поляризована: нужно, чтобы вся ее плазматическая мембрана находилась в относительном покое, за исключением переднего края, где клетка периодически выпускает ламеллоподии и микрошипы, когда движется вперед.
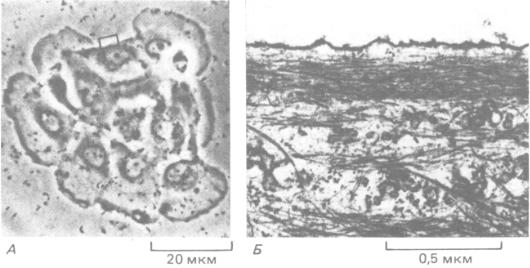
Когда неполяризованная мигрирующая клетка первоначально прикрепляется к поверхности культуральной чашки, микрошипы и ламеллоподии выдвигаются во всех направлениях и тянут клетку в разные стороны, в результате чего она остается на месте. Но, если случайно две противоположно направленные ламеллоподии достаточно прочно прикрепятся к субстрату, мы увидим, что растягивание клеточного кортекса между ними подавляет дальнейшее образование микрошипов и ламеллоподии в растянутой области-вероятно, потому, что актиновые филаменты в этом участке лежат параллельно плазматической мембране (рис. 11-80), а не перпендикулярно к ней, как нужно для возникновения ламеллоподии и микрошипов (разд. 11.2.11). Таким образом, тот факт, что в растянутых участках выступы цитоплазмы не образуются, можно объяснить чисто механическими причинами.
Дальнейшая «борьба» между ламеллоподиями похожа на перетягивание каната: те, что тянут клетку слабее, отрываются от субстрата и становятся частью пассивного растянутого кортекса. В конце концов останется только один активный участок плазматической мембраны; он и будет передним краем теперь уже поляризованной клетки, которая начнет движение в одном направлении (рис. 11-81).
Когда клетка находится на ровной плоской поверхности, выбор направления движения (т. е. «победа» каких-то ламеллоподии) будет делом непредсказуемым, зависящим от случайных вариаций в организации цитоскелета. Однако на неоднородной поверхности, например на культуральном субстрате с градиентом вещества, способствующего адгезии, «отбор» ламеллоподии и микрошипов будет направляться факторами внешней среды; эти выступы будут работать как щупальца, которые определяют, куда клетке двигаться.
Рис. 11-80. Организация актиновых филаментов в зоне растянутого клеточного кортекса. Тянущее действие противоположных ламеллоподии в группе из восьми эпителиальных клеток, показанных на световой микрофотографии (А), создает в одной из клеток покоящийся участок, где образование выступов подавлено (показан прямоугольником). При исследовании этого участка в электронном микроскопе (Б) в нем можно видеть пучки актиновых филаментов, идущих параллельно плазматической мембране, т. е. перпендикулярно к той ориентации, которая
нужна для образования ламеллоподии и микрошипов. (John Kolega, i. Cell Biol. 102: 1400-1411, 1986. С разрешения Rockefeller Univ. Press.)

324
Рис. 11-81. Возникновение полярности у мигрирующей клетки. Хотя здесь изображена клетка в культуре, сходные процессы, вероятно, играют фундаментальную роль в морфогенезе многих тканей. Прикрепившись к поверхности культуральной чашки, клетка выбрасывает
ламеллоподий во всех направлениях. По мере того как они растягивают клетку, возникают участки, где кортекс растянут и дальнейшее образование ламеллоподий подавлено (см. рис. 11-80). «Перетягивание каната» продолжается до тех пор, пока не возьмет верх какая-то одна ламеллоподия - вероятно, случайно, например потому, что субстрат под ней оказался более «липким», или благодаря небольшому хемотаксическому градиенту, который благоприятствует движению вперед одной из сторон клетки (разд. 11.2.13). Теперь клетка становится униполярной и перемещается в направлении «удачливой» ламеллоподий. С помощью подобного механизма клетки в развивающихся тканях будут двигаться в сторону тех клеток или элементов внеклеточного матрикса, к которым они прикрепляются наиболее прочно, зачастую делая выбор между субстратами, лишь слегка различающимися по адгезивности (разд. 14.3.9).
11-34
11.6.4. Относительная роль актиновых филамептов и микротрубочек в миграции зависит от типа клеток [61]
При миграции клеток микротрубочки и актиновый цитоскелет обычно работают совместно, так что вклад их разделить трудно. Степень участия микротрубочек в направленном движении клетки у разных типов клеток различна. Если деполимеризовать микротрубочки фибробласта колхицином, он перестает двигаться в определенную сторону и начинает выпускать ламеллоподии в случайных направлениях. С другой стороны, на направленное движение нейтрофила колхицин практически не влияет. Более того, если нейтрофил кратковременно прогреть до 42 "С, значительная часть его кортикальной цитоплазмы отделяется от остальной клетки и начинает двигаться сама по себе. Хотя эти подвижные фрагменты клеток лишены микротрубочек и ядра, они способны ползать по культуральной чашке в течение дня и дольше, прежде чем подвергнутся распаду (рис. 11-82). Поначалу фрагменты обладают такой же способностью к хемотаксису, как и исходные нейтрофилы; например, они направленно движутся «вверх» по градиенту концентрации N-формилированных пептидов (разд. 11.2.13). Однако миграция прекращается, если актиновые нити в нейтрофилах (или в образовавшихся из них фрагментах) деполимеризовать цитохалази-ном. По-видимому, этим клеткам для направленной миграции необходимы актиновые филаменты, но не микротрубочки.
Однако движение конусов роста нервных клеток, судя по всему, зависит и от микротрубочек, и от актиновых филаментов. В аксонах и дендритах (обобщенно называемых нейритами) содержатся необычайно упорядоченные пучки микротрубочек. Каждый нейрит «вытягивается» из тела нервной клетки под действием тянущей силы, создаваемой конусом роста на его кончике. Если нервные клетки в культуре обработать колхицином, рост нейритов останавливается, что указывает на участие микротрубочек в продвижении конуса роста. Конус роста эквивалентен переднему краю нейтрофила или фибробласта, и формирование на нем ламеллоподий и микрошипов тоже зависит от актиновых филаментов и подавляется при обработке цитохалазином. Тем не менее у нервных клеток, растущих на высокоадгезивной поверхности (например, на культуральной чашке, покрытой поликатионом полилизином), нейриты будут расти и в присутствии цитохалазина, хотя направление их

325
Рис. 11-82. Нейтрофил, нз которого в результате кратковременной тепловой обработки (42°С) был получен большой фрагмент, способный к непрерывному движению и хемотаксису, хотя в нем не было ядра и митохондрий. Микрофотография, полученная с помощью
сканирующего электронного микроскопа. (S. R. Malawista и A. DeBoisfleury Chevance, J. Cell Biol. 95: 960-973. 1982; с разрешения Rockefeller Univ. Press.)
роста будет меняться неупорядоченным образом. По-видимому, ламеллоподии и микрошипы нужны для того, чтобы направлять конус роста и позволять ему преодолевать слабоадгезивные поверхности. Организация микротрубочек и актиновых филаментов в конусе роста и в переднем крае фибробласта для сравнения показана на рис. 11-83.
11.6.5. Натяжение актинового кортекса, возможно, помогает управлять движением животных клеток [62]
Каков молекулярный механизм продвижения клетки вперед? Ответа на этот ключевой вопрос пока нет. Одна из гипотез, отводящая главную роль актиновому кортексу, представлена на рис. 11-84. Есть четкие свидетельства того, что кортекс в животных клетках находится в натянутом состоянии. Это натяжение кортекса, которое удалось измерить в очень крупных клетках, например в яйцеклетках морского ежа, стремится придать клеткам суспензии сферическую форму (т.е. такую, при которой их поверхность минимальна). Кроме того, клетки, видимо, способны «расслаблять» кортекс в определенных участках своей поверхности, например в переднем крае, хотя механизм этого расслабления неизвестен. В результате на переднем крае периодически образуются ламеллоподии - предположительно вследствие активации в плазматической мембране специальных кэпирующих белков, которая позволяет субъединицам актина присоединяться к плюс-концам актиновых филаментов в этом участке (разд. 11.2.15). Те ламеллоподии, которым не
Рис. 11-83. Организация микрогрубочек и актиновых филамектов в подвижных клетках двух типов. Окраска антителами к тубулину, меченными флуоресцеином (А), выявляет микротрубочки в виде тонкой сети во всей цитоплазме фибробласта и в виде плотного пучка, идущего по
оси аксона. При окраске тех же клеток родамин-фаллоидином (Б) видны актиновые филаменты как пучки, которые в фибробласте тянутся к переднему краю, а в аксоне концентрируются в микрошипах конуса роста. (С любезного разрешения Peter Hollenbeck.)

326
Рис. 11-84. Одна из моделей, показывающая, как богатый актином кортекс мог бы продвигать клетку вперед. Полимеризация актина ведет к вытягиванию ламеллоподии на переднем крае; прикрепившись к субстрату, ламеллоподия растягивает актиновый кортекс, и в результате его натяжения тело клетки продвигается вперед, частично ослабляя это натяжение. Такой цикл может повторяться снова и снова, шаг за шагом
продвигая клетку.
удалось прочно прикрепиться к субстрату, оттягиваются назад за счет кортикального натяжения, и это приводит к «раффлингу» (см. рис. 11-42). Но если какая-нибудь ламеллоподия прочно прикрепится, то ее актиновые филаменты будут связаны с субстратом при помощи трансмембранных соединительных белков (см. рис. 11-43); теперь то самое натяжение кортекса, которое оттягивало свободную ламеллоподию назад, будет двигать всю клетку вперед к новой точке прикрепления (см. рис. 11-84).
По аналогии с мышцей - наиболее изученной двигательной системой на основе актина - можно было бы ожидать, что вызывающие сокращение силы в кортексе создаются при взаимодействии актиновых и миозиновых филаментов. Однако против этой возможности говорят эксперименты с клеточным слизевиком Dictyostelium discoideum (разд. 14.3.1). Удалось получить таких мутантов этого слизевика, у которых нормальный ген фибриллярного миозина был заменен искусственно модифицированным геном. В этом гене был вырезан длинный участок, кодирующий белок (см. разд. 4.6.14), и в результате эти мутанты были лишены миозиновых нитей. Неудивительно, что у мутантных клеток не могло формироваться сократительное кольцо, и поэтому они превращались в гигантские многоядерные клетки, которые лишь изредка делились, просто разрываясь надвое. Тем не менее эти клетки сохраняли способность к миграции и даже к хемотаксической реакции на сАМР (разд. 14.3.2), хотя оба процесса были заметно нарушены. По-видимому, координированное перемещение клетки, так же как и натяжение кортекса, не зависит всецело от биполярных миозиновых филаментов; возможно, что натяжение может создаваться эластичной сетью актиновых филаментов (действующей подобно резиновой пленке) или другими стягивающими силами, источником которых могли бы быть, например, процессы разборки актиновых филаментов или мини-миозин.

327
11.6.6. Движению переднего края мигрирующей клетки может способствовать эндоцитозный цикл [63]
Как уже говорилось в гл. 6, все животные клетки непрерывно «заглатывают» небольшие участки своей плазматической мембраны и возвращают их обратно на клеточную поверхность в процессе, получившем название эндоцитозного цикла (разд. 6.5), Есть данные о том, что у ползущих по субстрату поляризованных клеток кусочки мембраны переходят внутрь со всей поверхности клетки, а возвращаются главным образом на передний край. По-видимому, такая асимметрия эндоцитозного цикла мигрирующей клетки помогает продвижению переднего края (разд. 6.5.13). Вероятно, возврат перешедших в цитоплазму участков мембраны на передний край поляризованной клетки зависит от ориентированных микротрубочек и актиновых филаментов: те и другие способны при участии вспомогательных белков направлять активный транспорт мембранных пузырьков в сторону своих плюс-концов (разд. 11.1.10 и 11.4.9). Таким образом, в мигрирующей клетке есть по меньшей мере два типа направленных «движителей», обеспечивающих ее локомоцию: 1) механизм на основе актиновых филаментов в клеточном кортексе - он выдвигает ламеллоподии и создает кортикальное натяжение; и 2) механизм, находящийся в глубине клетки, для которого нужны ориентированные микротрубочки или актиновые филаменты (или те и другие),- он обеспечивает активный транспорт мембранных пузырьков к переднему краю клетки (рис. 11-85).
11.6.7. Общими организаторами цитоскелета могут быть микротрубочки
Помимо участия в движении клеток микротрубочки играют также ключевую роль в определении их формы. Всем эукариотическим клеткам свойственна определенная геометрия, которая проявляется как во внешней структуре клетки, так и в расположении органелл. В то время как все другие компоненты цитоскелета лишь отражают эту геометрию, микротрубочки, по-видимому, часто играют уникальную роль в ее создании. Хорошо известно, например, что микротрубочки обычно располагаются вдоль длинной оси клетки и что во многих случаях их присутствие необходимо для поддержания удлиненной формы клетки в целом.
Как уже упоминалось, микротрубочки определяют положение аппарата Гольджи и эндоплазматического ретикулума в каждой клетке (разд. 11.4.10), а также влияют на распределение промежуточных филаментов, которые спадаются в околоядерную шапку при обработке клетки колхицином (разд. 11.5.3); кроме того, от них может зависеть и распределение актиновых нитей. Сократимое кольцо, которое постро-
Рис. 11-85. Два направленных «двигателя» в мигрирующей клетке: в основе одного лежат актиновые филаменты кортекса, а другой основан на переносе мембранных пузырьков к переднему краю вдоль микротрубочек (и, возможно, актиновых филаменюв). Вероятно, эти
механизмы совместно обеспечивают движение клетки в одном направлении.
328
ено из актиновых филаментов и перетягивает клетку пополам при завершении клеточного деления, всегда образуется в плоскости, перпендикулярной оси митотического веретена. Если образующееся веретено механически сместить, то соответственно изменится и место, где образуется затем сократимое кольцо; значит, положение этого кольца определяется положением веретена (разд. 13.5.13).
Механизмы, с помощью которых микротрубочки влияют на положение актиновых филаментов кортекса и промежуточных филаментов, неизвестны, хотя предположительно в них участвуют белки, образующие связи между белковыми нитями разных типов.
11.6.8. Структурная организация цитоскелета одной клетки может передаваться соседним клеткам [64]
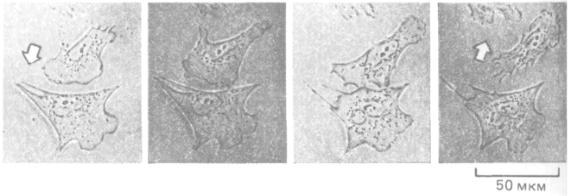
Цитоскелет данной клетки может влиять на цитоскелет ее соседей. Как полагают, этот способ межклеточной коммуникации играет важную роль в определении морфологии тканей и органов. Один из простейших видов взаимодействия между цитоскелетами можно наблюдать, когда передние края двух мигрирующих клеток касаются друг друга. У клеток большинства типов это вызывает немедленный «паралич» переднего края у той и другой клетки - феномен, известный как контактное ингибирование движения. В результате два столкнувшихся in vitro фибробласта перестают вытягивать микрошипы и ламеллоподии в зоне соприкосновения и начинают выпускать их повсюду, кроме этого места, так что постепенно клетки «уходят» друг от друга, меняя направление движения (рис. 11-86). По-видимому, такая реакция связана с быстрыми изменениями в кортикальном актиновом цитоскелете в зоне контакта, но молекулярные механизмы этих изменений не выяснены.
Контактное ингибирование движения не следует смешивать с контактным ингибированием (торможением) клеточного деления',
последнее наблюдается у клеток в культуре, которые делятся до тех пор, пока не покроют всю поверхность культуральной чашки. Как мы увидим в гл. 13, остановка роста и пролиферации в этих условиях зависит не только от контакта между клетками; она зависит также от той формы, которую клетки вынуждены принимать в условиях скученности, и от возрастающего дефицита питательных веществ (разд. 13.3.5).
Контактное ингибирование движения играет важную роль в заживлении ран. Пласты эпителиальных клеток на краях раны, вытягивая ламеллоподии, начинают быстро двигаться, стремясь «наползти» на поврежденную поверхность; это движение прекращается, как только клетки различных краев вступают в контакт, закрыв щель раны. Теперь. когда непрерывный пласт клеток восстановлен, между новыми соседями образуются межклеточные соединения, которые становятся точками прикрепления для белковых филаментов, соединяющих цитоскелеты всех клеток пласта (разд. 14.1.2). Контактное ингибирование движения может
Рис. 11-86. Контактное торможение движения фибробластов. Если два ползущих по поверхности культуральной чашки фибробласта сталкиваются, их ламеллоподии в точке контакта парализуются. Спустя 10-15 мин клетки обычно начинают двигаться в разные стороны друг от
друга. (С любезного разрешения Graham Dunn.)

329
также способствовать избирательному объединению аксонов в пучки в развивающейся нервной системе: конусы роста центральных нейронов останавливаются и даже втягиваются обратно, если сталкиваются с аксонами нейронов периферической нервной системы, хотя вдоль аксонов других центральных нейронов они продолжают охотно расти.
Еще один механизм, с помощью которого цитоскелет одной клетки может оказывать влияние на цитоскелет ее соседей, обусловлен взаимодействием между цитоскелетом и секретируемым клеткой внеклеточным матриксом. Как выяснилось (см. гл. 14), клетка с ориентированным цитоскелетом нередко образует сходным образом ориентированный внеклеточный матрикс, а это в свою очередь влияет на ориентацию цитоскелетов в других клетках, соприкасающихся с таким матриксом (см. рис. 14-84). Так благодаря межклеточным взаимодействиям через места соединения клеток и внеклеточный матрикс организация цитоскелета отдельной клетки часто определяется не автономно самой этой клеткой, а организацией ткани в целом.
11.6.9. В основе изгибания эпителиальных слоев у зародыша лежат координированные сокращения цитоскелета
[65]
Взаимодействие между цитоскелетами соседних клеток лежит в основе изгибания клеточных пластов - одного из фундаментальных морфогенетических процессов у животных. Как реализуется это взаимодействие? Возможно, оно передается с помощью механических стимулов, передающихся от клетки к клетке. Представьте себе, например, слой эпителиальных клеток, в которых кратковременное натяжение всего слоя ведет к сокращению апикальных пучков актиновых филаментов, расположенных в опоясывающих десмосомах (разд. 14.1.3). Если в одной
Рис. 11-87. Компьютерная модель гаструляции, в основу которой положена волна сокращений цитоскелета, распространяющаяся от клетки к клетке. Каждая клетка эпителиального пласта имеет опоясывающую десмосому (межклеточное соединение с сократительным пучком
актиновых филаментов, который, как было постулировано, сокращается в ответ на растяжение). А так как опоясывающая десмосома расположена в апикальном конце клетки, сокращение изменяет форму последней с цилиндрической на коническую. В пласте, состоящем из соприкасающихся клеток, сокращение одной из них будет растягивать соседние, заставляя их в ответ тоже сокращаться (А). Если такой принцип будет действовать в сферическом или цилиндрическом слое клеток, это приведет к инвагинации (Б). Точная геометрическая форма этой инвагинации будет зависеть от механических свойств модельной системы клеток; система, представленная справа (Б), рассчитана на моделирование гаструляции у эмбриона морского ежа. (G. Odell st al., Dev. Biol. 85: 446-462, 1981.)
330
клетке такой пучок сократится, то в соседних с ней клетках возникнет натяжение, которое может заставить сократиться аналогичные структуры и в этих клетках, и тогда волна сокращения распространится по всему клеточному пласту. Созданные на основе этого простого механизма компьютерные модели дают большое разнообразие конечных форм, зависящих от первоначальной геометрии пласта. Например, слой эпителиальных клеток, окружающих сферическую полость, будет впячиваться, образуя двуслойную структуру, что весьма напоминает гаструляцию у зародышей морского ежа (рис. 11-87).
Хотя эти модели полностью умозрительны, нет сомнений, что цитоскелет играет фундаментальную роль в формообразовании тканей. Сложная форма и организация клеток в тканях и органах позвоночных зависит от белков цитоскелета в их разнообразных структурных сочетаниях. Часто тем элементом, который, видимо, управляет морфогенетическими движениями, бывают микротрубочки. В других случаях ведущую роль играют актиновые филаменты, как, например, при развитии волосковых клеток в ухе позвоночных.
11.6.10. Развитие волосковых клеток в улитке внутреннего уха зависит от точного контроля полимеризации актина [66]
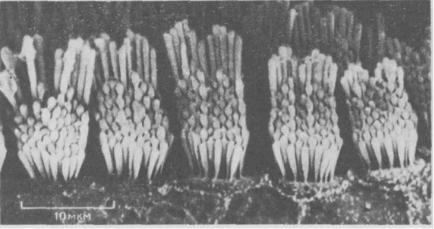
Волосковые клетки - это специализированные эпителиальные клетки, находящиеся в улитке и преддверии внутреннего уха. Эти клетки чрезвычайно чувствительны к малейшему движению, будь то вибрация, вызываемая звуковыми волнами, или перемещение жидкости в полукружных каналах при изменении положения головы. Эти движения детектируются с помощью пучков стереоцилий, расположенных на поверхности каждой волосковой клетки в гексагональном порядке; в каждом таком пучке стереоцилий расположены рядами «по росту», подобно трубам органа (рис. 11-88). Едва заметные колебания стереоцилий, вызываемые звуками, преобразуются в волосковой клетке в электрические сигналы, которые затем передаются в мозг (разд. 19.6.2).
Тонкость структурной организации стереоцилий выражается не только в их строго упорядоченном расположении на поверхности волосковой клетки, но и в закономерном изменении их размеров, числа и ориентации от одного конца улитки к другому. У кур каждая волосковая клетка на проксимальном конце улитки несет более 250 стереоцилий со средней длиной 1,7 мкм, тогда как на противоположном конце каждая клетка имеет только 50 стереоцилий, средняя длина которых 5,2 мкм. Эти и другие градации в структуре отражают функциональную организацию волосковых клеток, которые «настроены» в одном конце улитки на
Рис. 11-88. Стереоцилий расположены на поверхности волосковых клеток наподобие органных труб. Микрофотография получена с помощью сканирующего электронного микроскопа. (С любезного разрешения Lewis Tilney.)
