
ConspectMolPhizikaLekzii2013
.pdf
Молекулярно-кинетическое толкование термодинамической температуры
Учитывая, что
n = N/V = NA (m/M)/V, где V - объем газа, получим из (14)
(15).
Согласно уравнению Клапейрона-Менделеева
,
и тогда
(16).
Таково молекулярно-кинетическое толкование
термодинамической температуры.
Учитывая, что
,
где
средний квадрат скорости молекул газа, с учетом (16), получим
11

 ,
,
откуда находим среднюю квадратичную скорость
Закон Дальтона
Если в сосуде находится i сортов газа, то общее давление в сосуде будет определяться, как известно, соотношением
 .
.
Тогда, если
,
где  – парциальное давление.
– парциальное давление.
12

Барометрическая формула. Распределение Больцмана
Рисунок 3.
Рассмотрим газ в сосуде. Если атмосферное давление на высоте h равно  , то на высоте h+dh оно равно
, то на высоте h+dh оно равно  (при
(при
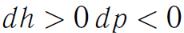 , т.к. давление с высотой убывает).
, т.к. давление с высотой убывает).
Разность давлений  и
и  равна весу газа, заключенного в объеме цилиндра высотой
равна весу газа, заключенного в объеме цилиндра высотой  с основанием 1 м2:
с основанием 1 м2:
,
где  - плотность газа.
- плотность газа.
Следовательно,
(17).
Воспользовавшись уравнением
13

,
находим, что
.
Подставив это выражение в (17), получим
Или
(18).
Интегрируя (18) от  до
до  находим,
находим,
.
Проведя потенцирование получим барометрическую формулу.
(19),
где
.
Формулу (19) можно преобразовать, если воспользоваться выражением (9)
14

 :
:
(20),
где
- потенциальная энергия молекулы в поле тяготения
(21).
Больцман доказал, что формула (21) справедлива в случае потенциального поля любой природы.
15

Закон Максвелла о распределении молекул по скоростям
В газе, находящемся в состоянии равновесия, установится некоторое стационарное распределение молекул по скоростям, которое подчиняется статистическому закону. Закон был теоретически выведен Максвеллом в 1859 г.
Рисунок 4.
При выводе этого закона Максвелл предполагал, что газ состоит из
очень большого числа N тождественных молекул, находящихся в состоянии теплового движения при одинаковой температуре.
Закон Максвелла описывается некоторой функцией  , называемой функцией распределения молекул по скоростям (без вывода):
, называемой функцией распределения молекул по скоростям (без вывода):
(22)
16
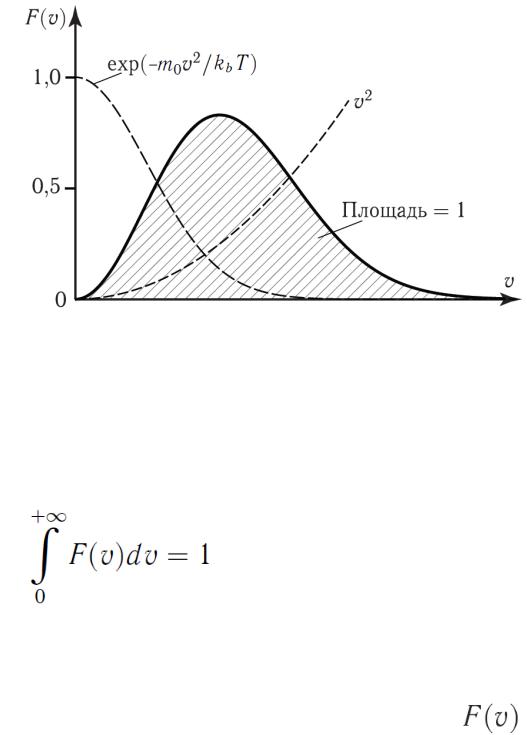
Рисунок 5.
Функция  характеризует плотность вероятности того, что
характеризует плотность вероятности того, что
скорость молекулы равна  и поэтому эта функция удовлетворяет условию нормировки
и поэтому эта функция удовлетворяет условию нормировки
(23)
Анализ показывает, что вид функции (22) зависит от массы
молекулы m0 и от температуры Т. Характерно, что |
, |
начинаясь от нуля, достигает максимума при  и затем стремится к нулю.
и затем стремится к нулю.
17
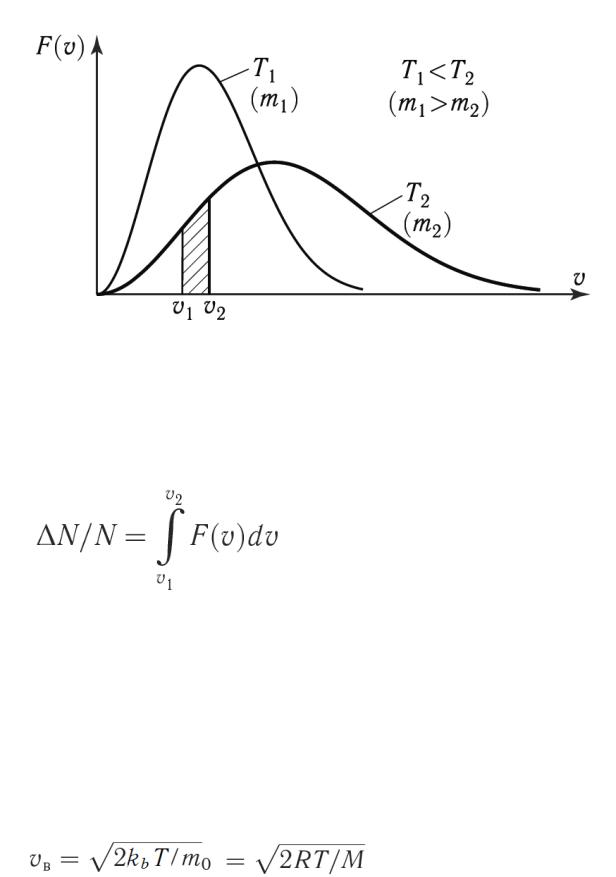
Рисунок 6.
Используя функцию распределения, можно найти число молекул
 , скорости которых лежат в интервале от
, скорости которых лежат в интервале от  до
до 
(24)
которое находится как площадь dS полоски (рисунок 6).
Скорость, при которой функция распределения молекул по скоростям максимальна, называется наиболее вероятной
скоростью  .
.
Исследование (22) на максимум позволило найти наиболее вероятную скорость молекул
(25).
18

Кроме наиболее вероятной и средней квадратичной скорости
молекул газа, используется также средняя скорость молекул 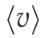 или средняя арифметическая скорость.
или средняя арифметическая скорость.
Она определяется по формуле
Подставляя  [cм. соотношение (22)] и интегрируя, получим
[cм. соотношение (22)] и интегрируя, получим
(26).
Можно показать, что значения этих скоростей относятся друг к другу как:
.
Эти значения на графике функции распределения молекул по скоростям могут быть схематически обозначены как (рисунок 7):
Рисунок 7.
19

Средняя и средняя квадратичная скорости превышают наиболее вероятную скорость на 13 и 22 % соответственно.
Исходя из распределения молекул по скоростям (22), можно найти
распределение молекул газа по кинетическим энергиям
поступательного движения молекул
 .
.
Это распределение характеризуется функцией  , которая вводится аналогично
, которая вводится аналогично  (без вывода)
(без вывода)
(27).
20
