
Підручники з Хімії / Хімія 9 клас / Гранкіна Хімія 9 клас. 2017
.pdf
Розчини 101
Якісними називають такі реакції, з допомогою яких можна визначити, атоми або групи атомів яких елементів входять до складу речовини.
Для електролітів це визначення буде звучати так:
Якісними називають такі реакції, з допомогою яких можна визначити, які йони входять до складу речовини.
У результаті якісної реакції повинна утворюватися речовина зі специфічними властивостями, не схожа на інші. Наприклад, для якісного визначення йонів Cl− використовують йони Ag+ , тому що осад AgCl, який утворюється, досить специфічний, не схожий на інші: це білий сирнистий (або пластівчастий) осад. Жодний інший осад так не виглядає.
Розберемо деякі якісні реакції на йони, які містяться у водному розчині.
ВИЗНАЧЕННЯ ЙОНІВ H+ І OH–
Ці йони, як ви знаєте, утворюються в результаті дисоціації кислот або лугів відповідно.
Наявність у розчині йонів Гідрогену, які обумовлюють кислотне середовище, та гідроксид-іонів, які обумовлюють лужне середовище, можна виявити з допомогою індикаторів — речовин, що змінюють забарвлення залежно від кислотності й лужності середовища (табл. 8).
|
|
|
|
Таблиця 8 |
|
Зміна кольору індикаторів у різних середовищах |
|||||
Середо- |
Фенол- |
Фіоле- |
|
Універсаль- |
|
товий |
Метилоранж |
ний індика- |
|||
вище |
фталеїн |
||||
лакмус |
|
торний папір |
|||
|
|
|
|||
Кислотне |
Безбарвний |
Червоний |
Червоний |
Червоний |
|
|
|
|
|
|
|
Нейтральне |
Безбарвний |
Фіоле- |
Жовто-гаря- |
Жовтий |
|
|
|
товий |
чий (помаран- |
|
|
|
|
|
чевий) |
|
|
|
|
|
|
|
|
Лужне |
Малиновий |
Синій |
Жовтий |
Синій |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
102 Тема 2
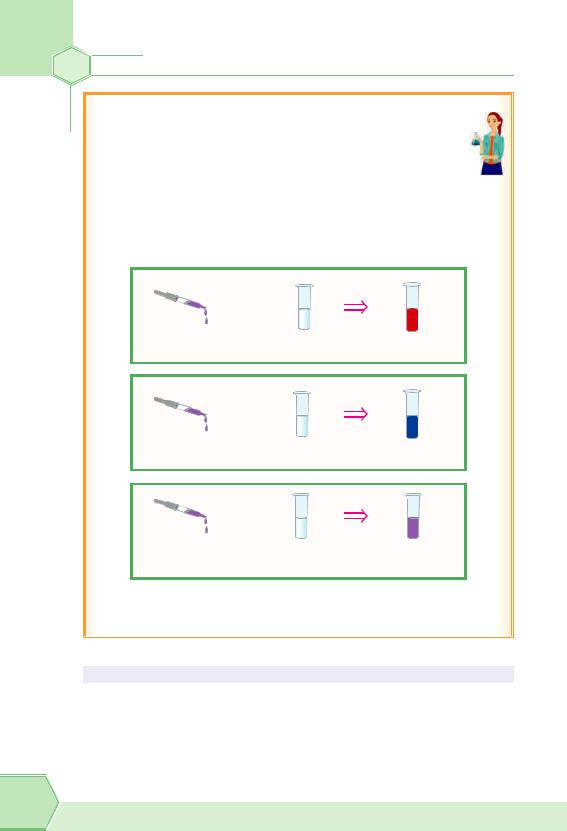
Лабораторний дослід «Виявлення йонів Гідрогену та гідроксид-іонів у розчинах»
Візьмемо три пробірки. У першу наллємо 1–2 мл розчину кислоти, у другу — стільки ж розчину лугу, у третю — води.
Додамо в кожну пробірку по кілька крапель розчину лакмусу. Спостерігаємо зміну кольору розчинів: лакмус у кислотному середовищі стає червоним, у лужному — синім, а в нейтральному середовищі забарвлення лакмусу залишається фіолетовим.
+
Лакмус кислота
+
Лакмус луг
+
Лакмус |
нейтральне |
забарвлення |
|
середовище |
не змінює |
||
|
Поясніть зміну кольору. Чому неважливо, розчин якої кислоти й лугу ми використовуємо?
ВОДНЕВИЙ ПОКАЗНИК рН
Для кількісного визначення кислотності (або лужності) розчину (часто говорять «середовища») використовують водневий показник — pH («пе аш»). Кожне значення pH відповідає певному вмісту катіонів Гідрогену в 1 л розчину.
Розчини 103
Урозчинах кислот уміст катіонів Гідрогену збільшується,
авміст гідроксид-іонів зменшується, у розчинах лугів спостерігається зворотна картина. Відповідно до цього змінюється й значення
водневого показника (pH).
За кімнатної температури в нейтральних розчинах pH = 7, в кислотних розчинах pH < 7, а в лужних pH > 7. Приблизно значення pH водного розчину можна визначити з допомогою індикаторів.
кислотне |
нейтральне |
|
лужне |
||||||
середовище |
середовище |
середовище |
|||||||
|
|
|
|
|
|
|
|
|
|
|
Н+ |
|
|
Н |
О |
|
|
ОН– |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
pH < 7 |
|
|
pH = 7 |
|
|
pH > 7 |
|
|
|
|
|
|
|
|
|
|
|
|
Наприклад, метиловий оранжевий за pH < 3,1 має червоний колір, а за pH > 9,4 — жовтий; лакмус за pH < 6,1 — червоний, а за pH > 8 — синій і т. д.
Спробуйте самі визначити середовище за таких значень pH. Більш точно (до сотих часток) значення pH можна визначити з допомогою спеціальних приладів — pH-метрів.
Дізнайтеся більше
Значення pH часто вказують на етикетках мийних косметичних засобів. Це важливо, тому що в нас на шкірі й волоссі в нормі дуже слабкокисле середовище, тому постійне використання мийних засобів з pH >7 (лужне середовище) призводить до погіршення стану шкіри й волосся. А от прати сильно забруднені речі краще в слабколужному середовищі.
Укислому середовищі гірше розвиваються гнильні бактерії, тому під час консервування овочів у банки додають оцтову кислоту.
Унашому організмі різні тканини мають різне значення pH. Це необхідна умова для нормальної роботи організму.

104 Тема 2
Лабораторний дослід «Встановлення приблизного значення pH води і різних розчинів з допомогою універсального індикатора»
Підготуйте пробірки: з дистильованою водою, з розчинами натрій гідроксиду, хлоридної кислоти, харчової соди, мийного засобу для посуду, господарського й дитячого
мила, засобу для прання. Усі розчини з масовою долею розчиненої речовини — приблизно 10 %. Опустіть у кожну пробірку смужку індикаторного паперу, вийміть його й порівняйте отриманий колір зі зразком на упакуванні паперу.
Визначте приблизне значення pH, укажіть середовище кожного розчину.
Дізнайтеся більше
Для дощової води середнє значення pH дорівнює 5,6. У випадку, коли pH опадів менше 5,6, говорять про кислотні дощі. Сполуками, що призводять до зниження рівня pH в опадах, є оксиди Сульфуру, Нітрогену, гідроген хлорид і леткі органічні сполуки.
Підвищена кислотність опадів призводить до пригнічення життя рослин і тварин, руйнування ґрунтів, а також будівель.
ВИЗНАЧЕННЯ ЙОНІВ Cl–, Br–, I–
Для якісного визначення цих трьох йонів необхідний реагент, який містить йони Ag+.
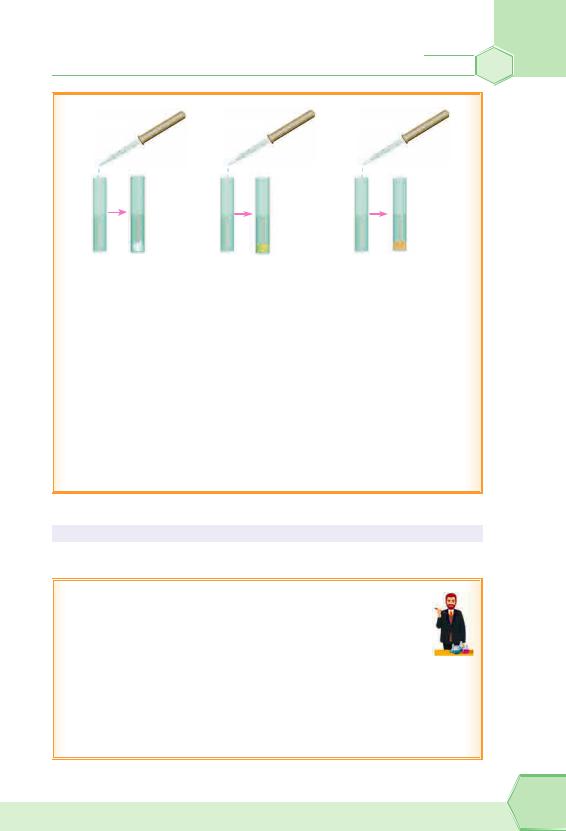
Лабораторний дослід «Виявлення хлорид-іонів, бромід-іонів і йодид-іонів у розчині»
Візьміть 3 пробірки й налийте: в першу — 1–2 мл розчину хлориду, наприклад натрій хлориду або хлоридну кислоту, у другу — розчин броміду, наприклад калій броміду,
у третю — йодиду, наприклад калій йодиду. У кожну пробірку додайте по декілька крапель розчину арґентум(І) нітрату. Що спостерігаєте?
Розчини 105
gNO3 |
AgNO3 |
AgNO3 |
KCl AgCl |
KBr AgBr |
KI AgI |
Чи можна було взяти інші розчинні хлориди, броміди, йодиди? Чому?
Додайте в кожну пробірку по кілька крапель розчину нітратної кислоти.
Зверніть увагу: осади не розчиняються.
Як ви вже помітили, характерною рисою є структура осадів — вони сирнисті, пластівчасті.
А от колір змінюється зі зміною йона галогену: AgCl — білий, AgBr — жовтуватий, AgІ — жовтувато-коричневий.
Напишіть молекулярні, повні й скорочені йонні рівняння реакцій, які були здійснені в цьому досліді.
ВИЗНАЧЕННЯ ЙОНІВ SO42– У РОЗЧИНІ
Якісним реактивом на йони SO42– є йони Ba2+.
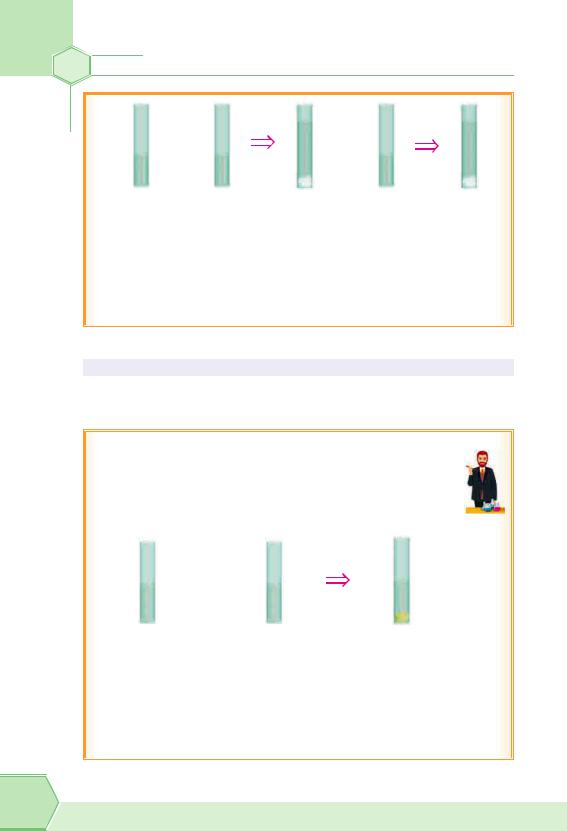
Лабораторний дослід «Виявлення сульфат-іонів у розчині»
У пробірку налийте 1–2 мл розчину сульфатної кислоти або будь-якого сульфату. Додайте трохи розчину
солі Барію або барій гідроксиду. Розчин відразу стає білим, як молоко. Це утворився білий порошкоподібний осад BaSO4. Він досить швидко осідає на дно пробірки.
Додамо в пробірку розчин нітратної кислоти. Осад не розчиняється.
106 Тема 2
+ +
H2SO4 |
BaCl2 BaSO4↓ + HCl HNO3 |
На перший погляд, утворення білого порошкоподібного осаду можливе в різних реакціях. Що ж тут незвичайного? Чому ця реакція якісна? Виявляється, BaSO4 не розчиняється в кислотах (ми це перевірили). От такий цей осад.
Напишіть молекулярні, повні й скорочені йонні рівняння реакції, яку було здійснено в цьому досліді.
ВИЗНАЧЕННЯ ЙОНІВ PO43– У РОЗЧИНІ
Для визначення цих йонів потрібен якісний реактив, який містить йони Ag+ .
Лабораторний дослід «Виявлення ортофосфат-іонів у розчині»
У пробірку налийте 1–2 мл розчину ортофосфатної кислоти або будь-якого ортофосфату. Додайте трохи розчину арґентум(І) нітрату. Випадає красивий жовтий осад.
+
Na3PO4 |
AgNO3 |
Ag3PO4↓ + NaNO3 |
Йони Ag+ , як ми вже знаємо, утворюють жовтуватий осад з йонами Br− . Але в цьому випадку осад не пластівчастий, а порошкоподібний, та й колір інший — яскравіший.
Напишіть молекулярні, повні й скорочені йонні рівняння реакції, яку було здійснено в цьому досліді.

Розчини 107
ВИЗНАЧЕННЯ ЙОНІВ CO32– У РОЗЧИНІ
Для визначення цих йонів якісним реактивом може бути розчин будь-якої сильнішої кислоти.
Лабораторний дослід «Виявлення карбонат-іонів у розчині»
У пробірку налийте 1–2 мл розчину будьякого карбонату. Додайте акуратно трохи
хлоридної кислоти. Активно виділяються бульбашки газу.
Що це за газ? Як він утворився?
Карбонатна кислота, яка утворює карбонати, дуже нестійка й під час виділення моментально розкладається на вуглекислий газ і воду. У такому випадку ми спостерігаємо виділення CO2.
Напишіть молекулярні, повні й скорочені йонні рівняння реакції, що було проведено в цьому досліді.
Тепер із допомогою якісних реакцій ми можемо відрізнити різні речовини, які навіть зовні майже однакові, наприклад натрій карбонат від натрій сульфату.
У таблиці 9 наведено якісні реакції на деякі аніони.*
Таблиця 9
|
|
Якісні реакції на аніони |
|
|||
Аніон |
Реагент |
Рівняння реакції |
Спостережувані |
|||
явища |
||||||
|
|
|
|
|
||
Cl− |
Ag+ |
Ag+ + Cl− |
= AgCl ↓ |
Білий сирнистий |
||
осад |
||||||
|
|
|
|
|
||
Br− |
Ag+ |
Ag+ + Br− |
= AgBr ↓ |
Жовтуватий |
||
сирнистий осад |
||||||
|
|
|
|
|
||
|
|
|
|
|
Жовтувато-корич- |
|
I− |
Ag+ |
Ag+ + I− = AgI ↓ |
невий сирнистий |
|||
|
|
|
|
|
осад |
|
CO2− |
H+ |
CO2− + 2H+ = H |
O + CO ↑ |
Виділяється газ |
||
3 |
|
3 |
2 |
2 |
|
|
* Якісні реакції на деякі катіони див. у додатку на с. 300.

108 Тема 2
Аніон
OH−
S2−
SO23−
SO24−
SiO23−
PO34−
Закінчення табл. 9
Реагент Рівняння реакції
Спостережувані
явища
Метил- |
Зміна кольору індика- |
||||
оранж |
тора |
|
|
|
|
Лакмус |
Зміна кольору індика- |
||||
тора |
|
|
|
|
|
|
|
|
|
|
|
Фенол- |
Зміна кольору індика- |
||||
фталеїн |
тора |
|
|
|
|
Cu2+ або |
Cu2+ + S2− = CuS ↓ |
|
|||
Pb2+ |
Pb2+ + S2− = PbS ↓ |
|
|||
H+ |
SO2− + 2H+ |
= H |
O + SO ↑ |
||
|
3 |
2 |
|
|
2 |
Ba2+ |
SO2− + Ba2+ |
= BaSO ↓ |
|||
|
4 |
|
|
|
4 |
H+ |
SiO2− + 2H+ |
= H |
|
SiO ↓ |
|
|
3 |
2 |
|
3 |
|
Ag+ |
3Ag+ + PO3− = Ag |
PO ↓ |
|||
|
4 |
|
|
3 |
4 |
Жовто-гаряче забарвлення змінюється на жовте
Фіолетове забарвлення змінюється на синє
З’являється малинове забарвлення
Чорний осад
Характерний запах або почервоніння вологого лакмусового паперу
Білий осад, не розчинний ані у воді, ані в кислотах
Білий драглистий осад
Жовтий осад
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
171.Які реакції називають якісними? Чому?
172.Як визначити йони H+ і OH− у розчині?
173.Охарактеризуйте поняття «водневий показник» і з’ясуйте його значення.
174.Наведіть приклади розчинів з різним показником pH.
175.Які йони необхідні для визначення йонів:
Cl− , Br− , I− , SO24− , PO34− , CO23− ?

Розчини 109
ВИКОНАЙТЕ ЗАВДАННЯ
176.Напишіть у молекулярній і йонній формах рівняння якісних реакцій, з допомогою яких можна виявити в розчині йони:
Cl− |
CO2− |
|
3 |
SO24− |
S2− |
SiO32− |
Br− |
Поясніть ваші відповіді.
177.Як розчином однієї солі розрізнити водні розчини Ca(NO3 )2 і HCl? Напишіть рівняння відповідних хімічних реакцій у моле-
кулярній і йонній формах, укажіть явища, що їх супроводжують.
178.Якого забарвлення набуде розчин лакмусу, який долили до розчину, що утворився після закінчення реакції між 1,5 моль хлороводню і 2 моль калій гідроксиду? Поясніть ваше рішення.
179.Яка кількість речовини солі та який об’єм водню утвориться під час взаємодії цинку з 200 г 22%-го розчину хлоридної кислоти?
180.До розчину, що містить суміш карбонату і натрій гідроксиду, спочатку додали надлишок розчину барій нітрату, а потім — сульфатної кислоти. Які йони залишились у розчині? Напишіть рівняння реакцій.
181.До розчину, який містить суміш калій сульфіту і натрій хлориду, спочатку додали надлишок розчину хлоридної кислоти, а потім — арґентум(І) нітрату. Які йони залишились у розчині? Відповідь підтвердіть рівняннями реакцій.
Для допитливих
182.Мінерал гідрогаліт має у складі йони Натрію. Під час розчинення 9,4 г цього мінералу в 100 мл води отримали розчин з масовою часткою розчиненої речовини 5,35%. Під час дії арґентум(І) нітрату на цей розчин утворюється білий сирнистий осад.
Визначте з допомогою розрахунків формулу мінералу.
183.Білі кристали солі А після додавання краплі води перетворюються на сині кристали солі Б, які повністю розчиняються у воді з утворенням блакитного розчину В. Якщо до розчину В додати розчин натрій гідроксиду, випадає блакитний осад Г, а після додавання розчину барій хлориду випадає білий осад Д, який не розчиняється в розчині кислот. Визначте речовини А, Б, В, Г, Д.
184.Невелику кількість речовини Х блідо-зеленого кольору було поміщено в пробірку й розчинено у воді. Отриманий розчин

110 Тема 2
розділили на дві частини. Після додавання до розчину першої пробірки — розчину натрій гідроксиду — випав осад бруднозеленого кольору; до розчину другої пробірки — розчину барій нітрату — випав білий осад, що не розчиняється в розчинах кислот. Визначте формулу речовини Х, якщо відомо, що вона є кристалогідратом, масова частка двовалентного металу в якому дорівнює 20,14 %, а в його безводній солі — 36,8 %.
185.Натрій масою 0,23 г розчинили у воді масою 180 г. Обчисліть масову частку лугу в розчині, що утворився.
186.До розчину масою 1000 г з масовою часткою купрум(ІІ) сульфату 16 % додали надлишок розчину калій гідроксиду. Обчисліть масу блакитного осаду, що утворився після реакції.
187.До розчину сульфатної кислоти масою 200 г з масовою часткою розчиненої речовини 4,9% додали надлишок розчину барій хлориду. Обчисліть масу білого осаду, що утворився після реакції.
188.До розчину нітратної кислоти масою 200 г з масовою часткою розчиненої речовини 6,3 % додали розчин натрій гідроксиду до повної нейтралізації кислоти. Обчисліть масу солі, що утворилася після реакції. Яку масу розчину лугу з масовою часткою натрій гідроксиду 4 % треба взяти для нейтралізації кислоти?
189.Обчисліть масу й об’єм води, яку необхідно додати до літій оксиду масою 15 г, щоб одержати розчин лугу з масовою часткою розчиненої речовини 10 %.
