
Підручники з Біології / Біологія 9 клас / Шаламов Біологія 9 клас 2017
.pdf
Кожна така клітина дасть початок великій кількості клітин, кожна з яких також міститиме вектор. Генетично ідентичне потомство однієї клітини називають клоном, а весь процес отримання великої кількості ідентичних молекул ДНК — молекуляр-
ним клонуванням.
Отримана в результаті бактерія вироблятиме людський білок, який за допомогою нескладних фізико-хімічних методів можна легко очистити від домішок і використати. Завершальним (і при цьому найбільштрудомісткимінайдорожчим)етапом створення будь-якого комерційного генетично модифікованого продукту є перевірка його безпечності для здоров’я людини й навколишнього середовища. Якщо кваліфікований біолог за вдалих обставин може створити трансгенний мікроорганізм лише за кілька днів, то випробування властивостей цього мікроорганізму й перевірка безпечності в деяких випадках тривають роки.
 1
1
Зараження
4 |
Соматична |
3 |
гібридизація |
2
5
Вирощування
клітин
76
Виділення
лімфоцитів
Рис. 61.4. Отримання гібридóм, що синтезують антитіла
1. Антиген. 2. Організм-донор лімфоцитів. 3. Лімфоцит. 4. Антитіло. 5. Клітина пухлини. 6. Гібридóма.
7. Утворені антитіла.
Завдяки клітинній інженерії можна створювати нові типи клітин
Приблизно водночас із генною інженерією почав розвиватися новий прикладний напрям біотехнології — клітинна інженерія. Клітинна інженерія — це сукупність методів отримання нових типів клітин, їх вирощування та практичного застосування. Методи вирощування клітин тварин поза організмом було розроблено ще на початку ХХ століття, але започаткували розвиток клітинної інженерії дослідження, проведені в 1960-х роках. Тоді було розроблено методи соматичної гібридизації — штучного злиття соматичних клітин з отриманням життєздатних клітин, здатних практично безкінечно утворювати подібних собі. Методи соматичної гібридизації дають змогу отримувати гібридні клітини з клітин різних типів або навіть із клітин організмів різних біологічних видів. Такі клітини не лише цікаві для фундаментальних біологічних досліджень (наприклад, за їхньою допомогою було визначено місце розташування різних генів на хромосомах людини), а й мають важливе практичне значення. Наприклад, гібридні клітини, утворені шляхом злиття лімфоцитів із пухлинними клітинами, здатні виробляти антитіла, як це роблять лімфоцити, і при цьому необмежено довго ділитися під час вирощування (рис. 61.4). Такі клітини мають назву гібридóми. Вони слугують основним джерелом промислового виробництва антитіл.
Поміркуймо
Знайдіть одну правильну відповідь
1Інсулін належить до такого класу сполук, як А білки Б ліпіди В вуглеводи Г нуклеїнові кислоти Д неорганічні сполуки
331

2За допомогою рестриктаз і лігаз можна А розрізати та зшивати молекули ДНК
Б копіювати специфічні послідовності ДНК В переносити гени з одного організму до іншого
Г здійснювати селекцію трансгенних організмів Д пригнічувати дію мутагенів
3Найчастіше для експериментів у галузі генної інженерії використовують такий вид мікроорганізмів, як
А |
кишкова паличка |
Б туберкульозна паличка |
В амеба |
Г |
дріжджі |
Д стафілокок |
|
4За молекулою РНК синтезують комплементарну їй ДНК за допомогою такого ферменту, як
А ДНК-полімераза |
Б лігаза |
В рестриктаза |
Г зворотна транскриптаза |
Д РНК-полімераза |
|
5Процес поглинання бактеріальною клітиною молекули ДНК із навколишнього середовища має назву
А |
трансформація |
Б трансляція |
В транскрипція |
Г |
транслокація |
Д трансмутація |
|
Сформулюйте відповідь кількома реченнями
6Опишіть послідовність дій для клонування гена зеленого флуоресцентного білка з медузи еквореї в кишковій паличці.
7Які наукові відкриття потрібно було здійснити, щоб генна інженерія стала реальністю?
8Як створення технології генної інженерії бактерій допомогло медицині?
9Як у схемі, що представлена на рисунку 61.3, здійснюється добір колоній, що містять цільовий ген?
10 Поясніть методику отримання гібридóм. Як використовують гібридóми?
Знайди відповідь і наблизься до розуміння природи
11У чому переваги методів генної інженерії порівняно з методами класичної селекції мікроорганізмів? Чому, незважаючи на це, селекцію мікроорганізмів продовжують застосовувати й зараз?
12Гібриди яких організмів вдалось отримати методами соматичної гібридизації? Чи знадобилися ці організми науці та виробництву?
13Як за допомогою соматичної гібридизації вдалося дізнатися, на яких хромосомах людини розташований той чи той ген?
Дізнайся самостійно та розкажи іншим
14Схарактеризуй потенційні біологічні загрози, пов’язані зі створенням і використанням генетично модифікованих бактерій.
15Розкажи про перспективи застосування генетично модифікованих мікроорганізмів у різних сферах людської діяльності.
332
§ 62. Роль біотехнології в медицині
Генна терапія може рятувати життя людей
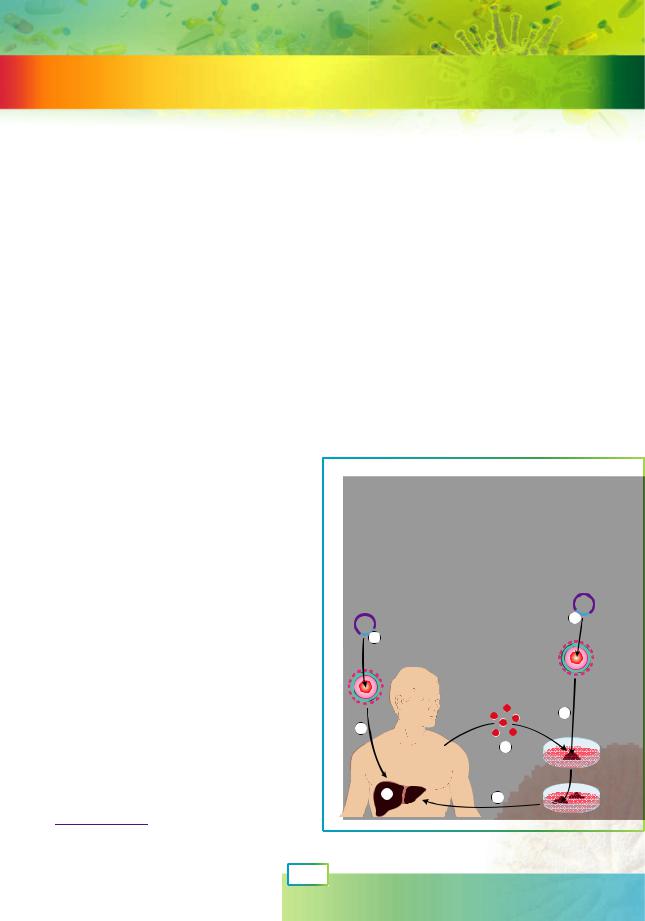
Якщо трансгенні рослини і тварини успішно створюють уже кілька десятиліть, то чи не можна застосувати методи генної інженерії до людини? Насправді принципових технічних проблем на цьому шляху немає. У цьому параграфі ми докладніше ознайомимося з досягненнями та проблемами генної терапії (чи генотерапії) — галузі медицини, що застосовує методи перенесення й модифікації генів для лікування захворювань людини.
Із § 39 ви вже знаєте, що генну терапію можна застосовувати для лікування спадкових захворювань. Також цей метод здатен допомогти хворим на рак, при захворюваннях нервової системи1 та інфекційних захворюваннях. Сьогодні методи генної терапії проходять клінічні випробування, багато з них продемонстрували позитивний ефект для здоров’я пацієнта.
Основним напрямом генної терапії є соматична генотерапія — доставка «правильної» копії гена чи «вимкнення» його мутантної форми в соматичних клітинах. Такі модифікації не успадковуються. Є кілька різних експериментальних підходів для доставки ДНК до клітин організму, але на практиці найуспішніше себе зарекомендувала, як ви вже знаєте, доставка за допомогою модифікованих вірусів. Звісно, віруси модифікують так, щоб повністю унеможливити їх розмноження в клітинах пацієнта та позбавити їх здатності уражати інші клітини чи інших людей. Після зараження клі-
тин віруси вбудовують свою ДНК, що несе |
|
|
|
|
|
«лікувальний» ген, у ДНК пацієнта. Вбу- |
|
|
|
|
|
дований ген зчитується і, наприклад, або |
Рис. 62.1. Два способи генної терапії |
||||
компенсує наявний генетичний дефект, |
|||||
1. «Лікувальний» ген. 2. Введення вірусу |
|||||
або підвищує здатність клітин опиратися |
|||||
в організм. 3. Хворий орган (наприклад, |
|||||
патогенним вірусам, або дозволяє імунним |
печінка). 4. Виділення клітин з організму. |
||||
клітинам знищувати ракові клітини. |
5. Зараження виділених клітин вірусом |
||||
Найчастіше генотерапевтичному впли- |
із «лікувальним» геном. 6. Повернення |
||||
клітин із виправленим геномом |
|||||
ву піддають клітини пацієнта напряму — in |
до організму. |
|
|
|
|
vivo, тобто в живому організмі. А іноді на |
In vivo |
|
|
|
|
клітини діють після виділення їх з організ- |
|
|
|
||
|
|
|
|
||
му. Такий метод називають терапією ex |
1 |
|
|
|
|
vivo, тобто поза організмом. Після генної |
|
|
|
||
модифікації ex vivo «відремонтовані» клі- |
|
|
|
|
|
тини «повертають» пацієнтові (рис. 62.1). |
|
|
|
|
|
Нині у світі дозволено використання |
|
|
|
|
|
менше десятка генотерапевтичних пре- |
|
|
|
|
|
паратів, але набагато більша кількість |
2 |
|
|
|
|
проходить клінічні випробування. Розро- |
4 |
|
|
||
бляються невірусні способи доставки ДНК |
|
|
|
||
|
|
|
|||
та нові методи модифікації геному. Отри- |
|
|
|
|
|
мано обнадійливі результати з лікування |
3 |
|
|
|
|
окремих форм раку. Очікується, що генна |
6 |
|
|
||
|
|
||||
терапія зможе повністю змінити підходи |
|
|
|
|
|
|
|
|
|
||
1Наприклад, хворобах Альцгеймера та Паркінсона, хореї Хантінгтона.
333
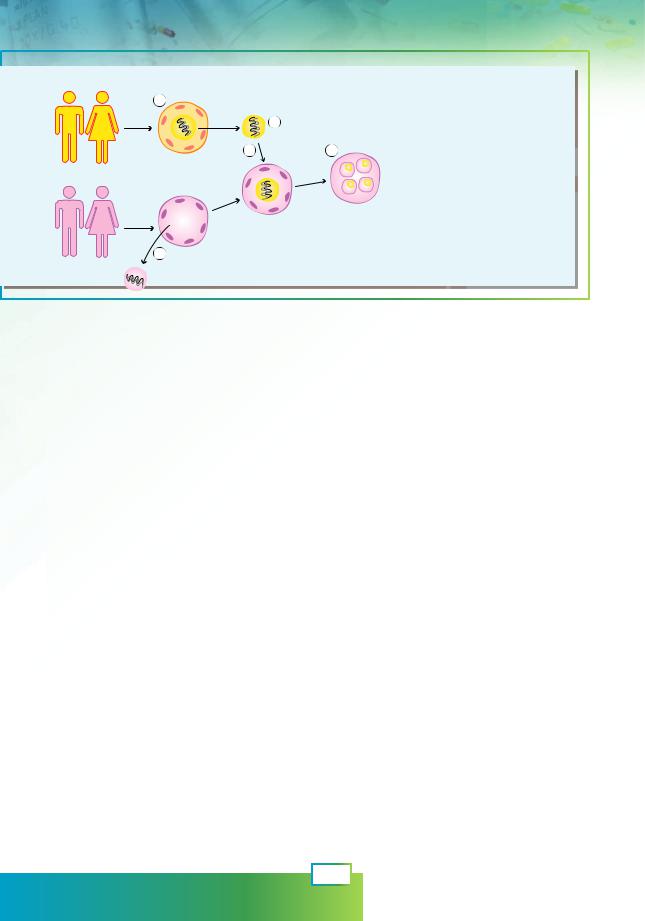
Пара пацієнтів
1 |
|
Рис. 62.2. Метод |
|
|
цитоплазматичної заміни |
||
|
|
||
|
2 |
1. |
Зигота пари пацієнтів |
4 |
5 |
з ушкодженими |
|
мітохондріями. |
|||
|
|
2. |
Здорове ядро виймають |
|
|
з ушкодженої зиготи. |
|
|
|
3. |
Ядро видаляють |
|
|
зі здорової зиготи. |
|
|
|
4. |
Ядро пацієнтів |
|
|
переносять до зиготи |
|
|
|
донорів зі здоровими |
|
3 |
|
мітохондріями. |
|
|
5. |
Ембріон, позбавлений |
|
Пара донорів |
|
мітохондріальних хвороб. |
|
до лікування деяких інфекційних захворювань, уповільнити процес старіння організму, виправити генетичні дефекти.
Однак із розвитком генної терапії постають нові етичні питання. Як далеко може зайти модифікація геному людини? Чи не призведуть успіхи генної терапії до появи «дизайнерських дітей» із покращеними спортивними чи інтелектуальними показниками? Чи не погіршиться генофонд людства і чи не відродиться єв- геніка—вченняпройогоуявне«покращення»?Зоглядунауспіхисучасноїгенної інженерії, відповіді на ці запитання можуть знадобитися вже найближчим часом.
Трансплантація мітохондрій допомагає при мітохондріальних захворюваннях
Однією з форм генної терапії можна вважати трансплантацію мітохондрій (чи метод цитоплазматичної заміни) — нещодавно розроблений метод, що дає змогу лікувати деякі форми безпліддя та запобігати розвитку в плода захворювань, пов’язаних із дефектом мітохондрій. Мітохондрії мають власну ДНК, що кодує кілька білків, транспортних і рибосомних РНК. Попри невеличкий розмір, ця ДНК необхідна для нормального функціонування клітини, і мутації в ній призводять до серйозних, часто летальних порушень розвитку дитини. Мітохондріальна ДНК успадковується дитиною від матері (зумовлюючи цитоплазматичну спадковість),
іякщо мати має в ній мутації, дитина також народиться хворою.
Уважких випадках єдиним дієвим методом розв’язання цієї проблеми є використання здорових мітохондрій від донора для заміщення мітохондрій матері, що несуть мутації в мітохондріальній ДНК. Уже розроблено методи, що дозволяють переносити ядро з яйцеклітини чи зиготи пацієнтки до здорової яйцеклітини чи зиготи, отриманої від жінки-донора. Така зигота, що містить хромосомний матеріал обох батьків і мітохондрії від третьої жінки, дає початок здоровому зародку, який нормально розвивається в матці жінки-пацієнтки. Схему такого процесу зображено на рисунку 62.2.
На місці зигот можуть бути яйцеклітини, тоді після перенесення ядра здійснюють штучне запліднення сперматозоїдами батька.
Технологію пересаджування мітохондрій у популярній літературі іноді називають народженням дитини від трьох батьків, але з таким визначенням не погоджуються більшість фахівців, що працюють у цій галузі. Мітохондріальна ДНК кодує
334
лише 13 білків людини з кількох десятків тисяч, що є в організмі, тобто її внесок у формування фенотипу дитини мінімальний.
Українська наука не стоїть осторонь від світових досягнень. Нашим лікарям одним із перших у світі вдалося успішно здійснити пересаджування мітохондрій, завдяки чому в січні 2017 року в Києві народилася здорова дівчинка.
Клонування ссавців можливе вже сьогодні
Клонування ссавців свого часу стало справжньою сенсацією та його широко обговорювали в пресі. Слово «клонування» означає отримання ідентичних копій — клонів — когось або чогось, у цьому випадку цілого багатоклітинного організму. Успішне клонування жаб було здійснене в 1960–1970-ті роки, але клонуванняссавціввиявилосянабагатоважчим завданням. Першим клонованим ссавцем у 1996 році стала вівця на ім’я Доллі.
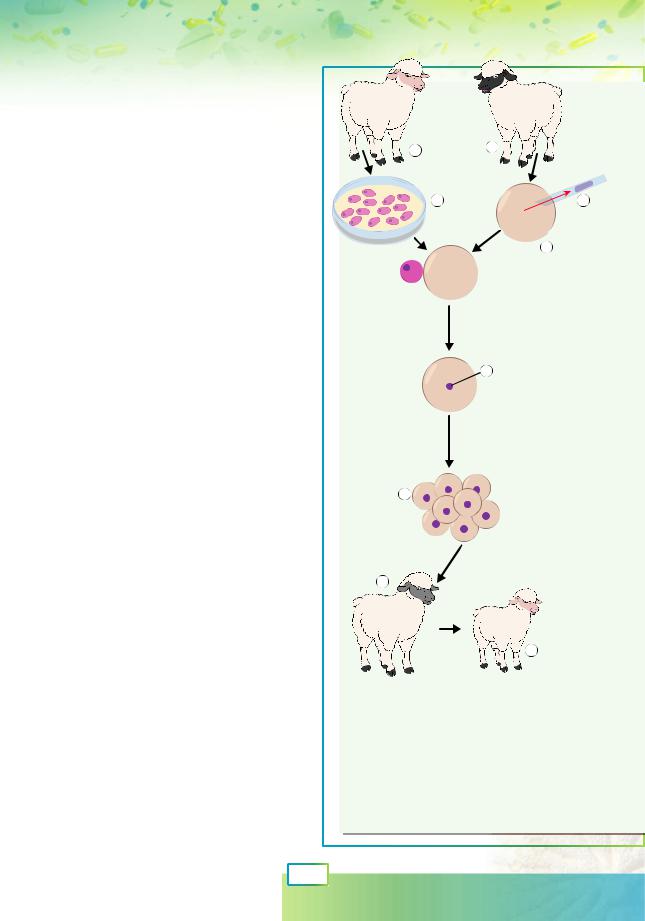
Принцип клонування полягає в заміні гаплоїдного ядра яйцеклітини диплоїдним ядром соматичної клітини (тобто майже будь-якої клітини організму, окрім статевої). Отриманий із такої клітини організм буде генетично ідентичним тому організму, із якого було взято соматичну клітину (рис. 62.3).
Вже розроблено технології, що уможливлюють клонування багатьох тварин (мишей, свиней, корів, кішок, собак та інших). Незважаючи на певні успіхи, клонування не є простою рутинною процедурою: не кожен ембріон розвивається в дорослу особину, а в отриманих у такий спосіб тварин часто спостерігаються патології розвитку. Наприклад, клонування Доллі вдалося після 277 невдалих спроб, а сама Доллі не прожила й 7 років. Однак технології розвиваються, завдяки чому вже розпочато комерційне клонування кішок і собак (рис. 62.4).
Для чого на практиці можна застосовувати клонування? Насамперед, для відтворення тварин з унікальними цінними
335
1 |
2 |
3 |
5 |
|
4 |
Злиття
клітин
6
|
Розвиток |
|
ембріона |
|
на поживному |
|
середовищі |
|
7 |
|
Імплантація |
|
до матки |
8 |
третьої вівці |
|
|
|
9 |
Рис. 62.3. Схема клонування вівці Доллі
1.Донор соматичної клітини.
2.Донор яйцеклітини. 3. Вирощування соматичних клітин. 4. Яйцеклітина з яєчника. 5. Видалення ядра яйцеклітини.
6.Ядро соматичної клітини. 7. Ранній ембріон. 8. Сурогатна мати. 9. Вівця Доллі, генетично ідентична донорові соматичної клітини.

Рис. 62.4. Клони різних тварин
властивостями або, у перспективі, для відновлення вимерлих видів тварин. Крім того, експерименти з клонування дають важливу наукову інформацію, наприклад, про роль ядерної та цитоплазматичної спадковості та їхній взаємозв’язок.
Таким чином, клонування ссавців цілком можливе, хоча й стикається з певними технічними труднощами. А як щодо клонування людини? Є два основні напрями, куди може рухатися клонування людини. Репродуктивне клонування передбачає повний розвиток плода та народження клонованої людини. При терапевтичному клонуванні розвиток ембріона зупиняється на ранній стадії, і отримані з нього клітини використовують для лікування. Репродуктивне клонування заборонено в усіх країнах світу, натомість терапевтичне клонування в деяких країнах дозволене (наприклад, у Великій Британії).
Мабуть, клонування людини — одне з найбільш обговорюваних наукових питань. Технічні проблеми в цій галузі пов’язані передусім із недосконалістю технології, високим відсотком невдач і ризиком виникнення відхилень розвитку. Етичні проблеми виникають через появу в процесі клонування великої кількості невдалих чи просто зайвих зародків, які знищують через непотрібність. За терапевтичного ж клонування знищують цілком життєздатного зародка людини з метою отримання клітин. У зв’язку з репродуктивним клонуванням виникають також численні юридичні проблеми щодо батьківства, спадкування майна тощо. Водночас часто обговорюване в пресі та популярній літературі питання «клонування Гітлера» й інших історичних особистостей не має жодного наукового підґрунтя: при клонуванні не відбувається «перенесення свідомості» і клон психологічно не буде абсолютно ідентичним своєму прототипові. Його радше можна розглядати як однояйцевого близнюка людини, тобто цілком самостійну особистість зі своїм фенотипом і свідомістю, що сформувалися в процесі життя.
Поміркуймо
Знайдіть одну правильну відповідь
1У генній терапії найпоширенішим є спосіб доставки ДНК до соматичних клі-
тин пацієнта за допомогою |
|
|
А модифікованих вірусів |
Б агробактерій |
В кишкової палички |
Г мікроін’єкції |
Д перенесення мітохондрій |
|
336

2Нині перенесення мітохондрій застосовують для
Алікування деяких форм безпліддя та для запобігання виникненню мітохондріальних захворювань у дитини
Б корекції мутацій у ядерній ДНК В запобігання народженню дітей із синдромом Дауна
Гзапобігання перенесенню мітохондріальних захворювань за чоловічою лінією
Длікування дорослих пацієнтів із порушеннями в мітохондріальній ДНК
3За цитоплазматичну спадковість відповідають такі клітинні органели, як
А |
ядро |
Б ендоплазматичний ретикулум |
В комплекс Гольджі |
Г |
мітохондрії |
Д лізосоми |
|
4Першим клонованим ссавцем стала
А кішка |
Б собака |
В корова |
Г вівця |
Д коза |
5Клонування доцільно застосувати, щоб А повернути до життя відомих людей Б створити «запланованих» дітей
В зберегти собак з унікально чутливим нюхом Г збільшити надої корів Д трансплантувати мітохондрії
Сформулюйте відповідь кількома реченнями
6Як генна інженерія може допомогти запобігти спадковим захворюванням людини та лікувати їх? Які етичні проблеми при цьому виникають?
7Який спосіб генної терапії доцільніше використовувати для лікування генетичного захворювання, пов’язаного з роботою не однієї, а кількох різних тканин?
8У чому відмінність між репродуктивним і терапевтичним клонуванням?
9Які технічні, етичні та юридичні проблеми виникають у зв’язку з можливим клонуванням людини?
10Чи є сенс клонувати великих учених минулого для здійснення проривів у сучасній науці?
Знайди відповідь і наблизься до розуміння природи
11Здебільшого генну терапію ex vivo здійснюють зі стовбуровими клітинами. Чим це пояснюється?
12Схарактеризуй технологію клонування вівці Доллі. Чому вона прожила так мало?
Дізнайся самостійно та розкажи іншим
13Як методи клонування можуть допомогти відновити вимерлих тварин? Які успіхи досягнуто та які проблеми постають?
14У лікуванні яких захворювань генна терапія досягла найбільших успіхів?
15 Використавши здобуті знання, доповни процес клонування, показаний у фільмі «Парк Юрського періоду».
337

§ 63. ГМО
|
Що таке ГМО? |
|
ГМО розшифровується як «генетич- |
|
но модифікований організм». Це означає, |
|
що до його спадкової інформації штучно |
|
було внесено зміни для надання йому |
|
корисних властивостей. Найчастіше це |
|
досягається шляхом перенесення генів |
|
з організму одного виду в інший, і тоді |
|
отриманий генетично модифікований ор- |
|
ганізм ще називають трансгенним. |
Рис. 63.1. Різні варіанти GloFish |
Стисло розглянемо історію й сучасні |
|
досягнення у створенні генетично моди- |
|
|
|
фікованих організмів. |
Перший генетично модифікований багатоклітинний організм — трансгенна миша — з’явився на світ 1974 року, тобто лише через два роки після створення першої рекомбінантної молекули ДНК і через рік після появи першої генетично модифікованої бактерії.
1983 року було створено першу трансгенну рослину — тютюн, що містив ген стійкості до антибіотика.
1992 року вірусостійкий тютюн, вирощений у Китаї, став першою комерційною трансгенною рослиною.
1994 року на ринку з’явився перший генетично модифікований продукт харчування — томат сорту Flavr Savr, плід якого довше зберігається та повільніше псується.
2003 року було створено акваріумну рибку GloFish (рис. 63.1), здатну флуоресціювати. Вона стала першою генетично модифікованою домашньою твариною.
2015 року було дозволено промислове вирощування та вживання в їжу ге-
|
нетично модифікованого лосося з прискореним ростом — AquAdvantage. |
|||
|
Лосося використовуватимуть |
лише у тваринництві й не випускатимуть |
||
|
у природне середовище. |
|
||
|
Він досягатиме потрібно- |
|
||
|
горозмірувдвічішвидше, |
|
||
|
ніж його звичайні співро- |
|
||
|
дичі (рис. 63.2). |
|
||
У |
створенні |
трансгенних |
|
|
тварин і рослин |
застосовують |
|
||
ті самі підходи, що й під час |
|
|||
роботи з мікроорганізмами. Ос- |
|
|||
новні етапи їх модифікації такі: |
|
|||
отримання |
ізольованого цільо- |
Рис. 63.2. Звичайний лосось (менший) |
||
вого |
гена, |
вбудовування гена |
і лосось AquAdvantage (більший) одного |
|
у вектор, перенесення вектора |
віку |
|||
до клітин модифікованого орга- |
|
|||
|
||||
нізму та відбір модифікованих |
|
|||
338

організмів, їхня перевірка на безпеку. Принципово відрізняється лише метод переносу вектора, оскільки у тварин і рослин немає природного процесу, що забезпечував би поглинання ДНК із навколишнього середовища. Також доводиться враховувати особливості розвитку багатоклітинних організмів.
Рис. 63.3. Трансформація клітин По рослинах стріляють рослини за допомогою генної гармати
із генної гармати
Для перенесення генів до клітин рослин використовують агробактерію, яка здатна заражати клітини рослин і при цьому переносити до них генетичний матеріал. Для деяких рослин (наприклад, кукурудзи та пшениці) цей спосіб непридатний. У такому разі використовують трансформацію за допомогою генної гармати (рис. 63.3), яка в буквальному сенсі стріляє наночастинками із закріпленою на них ДНК.
Іншими способами трансформації рослинних клітин є мікроін’єкція ДНК за допомогою мікропіпетки та електропорація, тобто введення ДНК у клітину завдяки створенню електричного поля високої напруги.
Сьогодні трансгенними рослинами засаджено понад 10 % усіх посівних територій. Усього в сільському господарстві дозволено використовувати понад 30 видів генетично модифікованих рослин. Більшість модифікацій націлені на підвищення опірності рослин шкідникам чи на надання стійкості до гербіцидів. Крім того, є модифікації, що подовжують термін зберігання продуктів (томати), міняють колір декоративних рослин (гвоздики, троянди), надають стійкості до посухи (кукурудза, цукрова тростина), підвищують уміст корисних речовин (рапс, соя) чи знижують уміст шкідливих (тютюн). Використання ГМО дало змогу зменшити використання пести-
цидів майже на 40 % і водночас підвищити |
|
врожайність на 20 %. Однак вирощування |
|
модифікованих рослин досі стикається із |
|
серйозною протидією. |
|
2000 року було розроблено так зва- |
|
ний золотий рис (рис. 63.4), що містить, |
|
на відміну від звичайного рису, в значній |
|
кількості β-каротин, попередник вітаміну А. |
|
Важливість цього продукту, особливо для |
|
бідних верств населення Африки та Азії, |
|
важко переоцінити: у світі щонайменше |
Рис. 63.4. Зерна звичайного |
250 млн людей страждають від браку ві- |
|
таміну А. Щороку від гіповітамінозу гине |
та золотого рису |
до 2 млн людей і щонайменше 250 тисяч |
Жовтий колір зерен золотого рису |
дітей назавжди втрачають зір. Вирощуван- |
зумовлений наявністю великих |
ня золотого рису могло б раз і назавжди |
кількостей жовтого β-каротину. |
розв’язати цю проблему. Але його комер- |
|
|
|
ційне використання досі не розпочато, |
|
339

А |
Б |
|
|
|
Рис. 63.5. Генетично модифіковані |
|
|
тварини |
|
|
А. Кішки з вбудованим флуоресцент- |
|
|
ним білком допомагають |
|
|
вивчати СНІД. |
|
|
Б. Генетично модифікованих гризунів |
|
|
використовують у якості модельних |
|
|
організмів для вивчення ожиріння |
|
|
й діабету. |
|
|
|
|
|
|
передусім через сильний (і не зовсім зрозумілий) спротив природоохоронних організацій і їхніх прихильників. У 2016 році 107 учених — лауреатів Нобелівської премії — підписали відкритого листа, адресованого природоохоронній організації «Грінпіс», а також Організації Об’єднаних Націй та урядам усіх держав світу, із закликом припинити боротьбу з ГМО загалом і проти золотого рису зокрема. Лист закінчується риторичним питанням: скільки ще людей у світі мають померти, перш ніж боротьбу з ГМО визнають злочином проти людства?
Генетично модифіковані тварини допомагають у розв’язанні численних проблем
Методи створення генетично модифікованих тварин теж добре відпрацьовані, їх широко застосовують у наукових дослідженнях (рис. 63.5). Для отримання таких тварин генетичній модифікації піддають зиготу або клітини ембріона на ранніх стадіях. Це роблять, наприклад, для створення експериментальних лабораторних тварин, що слугують модельними організмами для вивчення хвороб людини.
Іншим перспективним напрямом застосування трансгенних тварин є виробни- цтворізноманітнихмедичнихпрепаратів—антитіл,факторівзгортаннякровітаінших білків. Особливо цікавим рішенням є синтез чужорідних білків у клітинах молочної залози. У такий спосіб можливо виробляти та виводити з організму значні кількості цих препаратів із молоком, тобто без шкоди для тварини. Незважаючи на наявність відпрацьованих технологій, генетично модифікованих тварин у сільському господарстві поки що широко не використовують (крім згаданих нами лососів AquAdvantage).
ГМО: за та проти
Полеміка про можливість вживання в їжу генетично модифікованих продуктів триває вже не одне десятиліття з моменту створення перших трансгенних організмів. Незважаючи на очевидні переваги, що дає їх використання, і відсутність якихось наукових даних про потенційну шкоду ГМО, застосування їх у сільському господарстві стикається зі значним спротивом.
Ось кілька аргументів, які наводять супротивники ГМО.
1.Генетично модифіковані організми шкідливі для здоров’я. Насправді це не так: за десятиліття найретельніших досліджень жодної реальної небезпеки для здоров’я, пов’язаної з трансгенними організмами, виявлено не було. Це в жодному разі не означає, що вони безпечні у будь-яких випадках: якщо вбудувати до геному картоплі ген холерного токсину, то така картопля, без сумніву, користі здоров’ю не принесе. Щоб запобігти будь-яким подібним
340
