
Фториды и оксиды щелочноземельных металлов и магния. Поверхностные свойства
.pdfИзменение свойств оксидов ЩЗМ и магния закономерно [21]. Обусловлено это последовательным увеличением радиусов ионов Ме2+ при сохранении ими однотипной электронной структуры (инертного газа). В ряду оксидов от магния к барию наблюдается уменьшение энергии решетки соединения, увеличивается плотность и растворимость (табл. 1.2), уменьшаются температуры кипения и плавления.
Т а б л и ц а 1 . 2
Данные по растворимости оксидов щелочноземельных металлов и магния в воде
Оксид |
Растворимость, в г/100 г воды (вверху указана температура) |
MgO |
0,000620, 0,008630 |
CaO |
0,130 , 0,6680 |
SrO |
Реагирует с водой |
BaO |
Реакция с водой |
Оксид бария имеет более низкую температуру плавления, чем оксиды кальция и стронция, и после охлаждения застывает в кристаллическую массу [19]. Заметное испарение оксидов ЩЗМ наступает лишь при очень высоких температурах. По ряду Ca – Sr – Ba летучесть оксидов возрастает, причем испарение сопровождается диссоциацией молекул на атомы.
Все оксиды ЩЗМ и магния – устойчивые соединения, имеют одинаковую стехиометрию МеО. Химическая активность увеличивается при переходе от оксида магния к оксиду бария. Оксид магния относительно инертен (особенно при прокаливании при высокой температуре), другие оксиды реагируют с водой с выделением теплоты и образуют гидроксиды. Оксиды магния и ЩЗМ довольно легко поглощают диоксид углерода и влагу из воздуха, растворимы в большинстве минеральных кислот. При введении этих оксидов в шихту для твердофазных реакций, они относительно мало реакционноспособны, поэтому реакции с их участием требуют высоких температур.
Оксиды щелочноземельных металлов – твердые, тугоплавкие соединения; обладают высокой прочностью. Проведенный информационный поиск свидетельствует о том, что наличие выше указанных свойств у оксидов ЩЗМ и магния дает возможность использовать их в технологии тугоплавких соединений и защитных покрытий
[22–26].
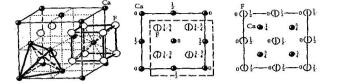
Фториды ЩЗМ и магния – твердые кристаллические вещества белого цвета.
Кристаллические структуры фторидов ЩЗМ и магния различа-
ются. Для фторидов кальция, стронция и бария характерна до-
вольно широко распространенная структура минерала флюорита
CaF2 (рис. 1.2) [27].
а б в
Рис. 1.2 – Кристаллическая структура флюорита СаF2. Общий вид структуры (а) с выделенными координационными полиэдрами вокруг атомов Са и F и план структуры с началом координат в атоме Са (б) и в атоме F (в)
В кристаллической структуре флюорита (ионный кристалл) межатомные расстояния Mе−F практически одинаковы. Количество ближайших соседей (координационное число) у атома металла равно 8, а у фтора – 4. Очевидно, что описанная структура флюорита достаточно рыхлая, содержит пустоты, например, в центре кубической ячейки или в середине ребра, то есть может включать в себя избыточные (внедренные) атомы. Во флюорите могут быть дефекты и другого типа – незаполненные регулярные позиции (вакансии).
При комнатной температуре основным типом дефектов в кристаллах с таким типом структуры являются антифренкелевские дефекты [28], представляющие собой вакансии галоида и ион галоида в междоузлии [29]. О доминирующем характере антифренкелевской разупорядоченности свидетельствует значительно более низкая энергия образования антифрекелевских дефектов по сравнению с дефектами Френкеля и Шоттки (таблица 1.3) [30, 31]. Описанные точечные дефекты и их более сложные сочетания способствуют высокой подвижности ионов фтора. Вещества со структурой флюорита легко переходят в состояние, характеризующееся суперионной проводимостью, которую можно увеличить, регулируя концентрацию дефектов структуры [32, 33].
Элементарная ячейка этого типа состоит из тетрагональной призмы, углы и центры которой заняты ионами одного сорта, на-
12
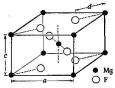
пример ионами Мg2+, в то время как ионы другого сорта (F-), лежат на расстоянии d от углов и соответственно центра.
Т а б л и ц а 1 . 3
Энергия образования дефектов Шоттки (Ws), Френкеля (Wf) и антифренкелевских дефектов (Waf) в ионных кристаллах (в эВ), WЭKC -экспериментально полученные значения
Кристалл |
Ws |
Wf |
Waf |
WЭКС |
MgF2 |
7,4 |
17,5 |
3,5 |
3,2 – 4,0 |
CaF2 |
7,0 – 8,6 |
6,0 |
2,6 – 2,7 |
2,2 ‒ 3,1 |
SrF2 |
6,9 – 8,1 |
- |
2,2 – 2,4 |
1,7 – 2,3 |
BaF2 |
6,3 – 6,9 |
- |
1,6 – 2,0 |
1,6 ‒ 1,9 |
Фторид магния имеет структуру рутила (рис. 1.3) [27].
Рис. 1.3 – Кристаллическая решетка типа рутила
Параметры элементарных ячеек и значения плотности фторидов представлены в таблице 1.4 [34].
|
|
|
|
Т а б л и ц а 1 . 4 |
|
|
Параметры кристаллической решетки фторидов ЩЗМ |
||||
|
|
|
|
|
|
Фторид |
|
Параметры элементарной ячейки, Å |
Плотность, г/см3 |
|
|
|
|
а |
с |
||
|
|
|
|
||
MgF2 |
|
4,64 |
3,06 |
3,14 |
|
CaF2 |
|
5,45 |
– |
3,20 |
|
SrF2 |
|
5,78–5,86 |
– |
4,33–4,15 |
|
BaF2 |
|
6,19 |
– |
4,91 |
|
Среди многообразия неорганических фторидов можно найти примеры соединений с различными типами химической связи [1]. Наиболее значительную группу неорганических фторидов составляют фториды металлов с преобладанием ионного характера связи, к которым относятся фториды щелочноземельных металлов и магния. Они относятся к классу диэлектриков и обладают проводимостью ионного типа [34]. Влияние химической связи на свойства соединений интересно прослеживается в ряду фторидов бария, строн-
13
ция, кальция, магния: увеличивается ковалентный вклад и уменьшается ионная составляющая в химическую связь [35].
Ионные фториды ЩЗМ и магния характеризуются высокими значениями энергии кристаллической решетки, они малолетучи, имеют высокие температуры плавления и кипения, трудно растворимы в воде.
Основные характеристики фторидов ЩЗМ и магния представлены в таблицах 1.5 и 1.6.
Т а б л и ц а 1 . 5
Некоторые физические характеристики фторидов ЩЗМ и магния
Параметр |
MgF2 |
CaF2 |
SrF2 |
BaF2 |
|
Молекулярный вес |
62,3 |
78,0 |
125,6 |
175,3 |
|
Ереш, кДж/моль |
2914,6 |
2613,3 |
2462,7 |
2316,2 |
|
Тпл, ºC |
1396 |
1418 |
1400 |
1353 |
|
Ткип, ºC |
2239 |
2500 |
2450 |
2200–2260 |
|
ρ, г/см3 |
2,9–3,2 |
3,18 |
4,24 |
4,83 |
|
Rk/Ra |
– |
0,8 |
0,95 |
1,03 |
|
Ионность связи, % |
81 |
85 |
85 |
86 |
|
Ширина запрещенной |
12,3 |
11,5−12,5 |
10,8−11,5 |
10,3−10,6 |
|
зоны, эВ |
|||||
|
|
|
|
||
Теплота испарения, |
69,8 |
80,3 |
78,2 |
69,8 |
|
ккал/моль |
|||||
|
|
|
|
||
Стандартная энтропия, |
|
|
|
|
|
при 298,16 К, |
13,68±0,07 |
16,46±0,8 |
|
23,0±0,1 |
|
кал/моль град |
|
|
|
|
Т а б л и ц а 1 . 6
Растворимость и произведение растворимости фторидов щелочноземельных металлов и магния
|
Параметр |
MgF2 |
CaF2 |
SrF2 |
|
BaF2 |
|
|||
|
Растворимость, |
при 18 ºС |
0,0874 |
0,0163 |
0,1173 |
1,605 |
|
|||
|
г/л |
при 25 ºС |
0,13 |
0,04 |
0,39 |
|
1,21 |
|
||
|
|
при 18 ºС |
7,1 10-9 |
3,4 10-11 |
– |
|
1,7 10-6 |
|
||
|
Произведение |
при 26 ºС |
6,4 10-9 |
3,95 10-11 |
3,4 10-9 |
1,73 10-6 |
|
|||
|
растворимости |
при комн. |
5,5 10 |
-10 |
4,1 10 |
-11 |
3,7 10 |
-9 |
– |
|
|
|
|
|
|
|
|||||
|
|
темп. |
|
|
|
|
|
|
|
|
|
|
при 25 ºС |
– |
|
4,9 10-11 |
3,56 10-9 |
3,15 10-6 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как следует из таблиц 1.6, 1.3 и 1.5, наблюдается закономерное изменение свойств фторидов кальция, стронция и бария, имеющих одинаковый тип решетки, с изменением величины энергиии решет-
14
ки. Так, при уменьшении энергии решетки соединения снижается его химическая активность, увеличивается плотность, уменьшаются температуры плавления и кипения. Высокая энергия решеток фторидов является причиной их малой растворимости, которая объясняется и теоретическими выводами Капустинского и Яцимирского
[34].
Свойства фторида магния не укладываются в описанную закономерность. Это подтверждает положение, что энергия кристаллической решетки является характеристикой, определяющей изменение свойств только в ряду соединений с одинаковым строением и типом решетки.
Фториды щелочноземельных элементов обособленно стоят в ряду других галоидных соединений щелочноземельных элементов, так как практически нерастворимы не только в воде, но и в разбавленных кислотах. Это делает перспективным использование этих материалов в химически агрессивных средах.
В отличие от прочих галогенидов фториды ЩЗМ не образуют кристаллогидраты. Малый радиус аниона фтора и связанная с этим высокая энергия решетки препятствует координированию воды у катиона. По этой же причине CaF2 не образует аммиакатов. Теоретические расчеты Яцимирского [34] указали на невозможность устойчивого существования кристаллогидратов фторидов магния и кальция.
Фториды указанных металлов обладают высокой химической устойчивостью по сравнению с другими галоидными соединениями этих же элементов. Это объясняется чрезвычайной химической активностью фтора, обусловленной, в свою очередь, его высокой электроотрицательностью (4 эВ) и небольшим радиусом (1,38 Å). Здесь следует особо отметить, что на химию соединений фтора оказывают влияние малый размер атома и иона, самая высокая электроотрицательность, большая величина сродства к электрону (по сравнению с кислордом), очень высокое значение энергии ионизации.
Химическая инертность фторидов ЩЗМ и магния при низких температурах на воздухе сменяется увеличением активности при повышении температуры. При нагревании на воздухе CaF2 наблюдается диффузия О2 в решетку. Расчет термодинамических характеристик для этих реакций
МеF2 +1/2 O2 ↔ MеO + F2, MеF2 + H2O ↔ MеO + 2 HF
15
показал [34], что наиболее вероятны реакции пирогидролиза. Анион О2- диффундирует вглубь кристалла с поверхности. Склонность к пирогидролизу в ряду MgF2 – CaF2 – SrF2 – BaF2 падает.
Наиболее часто фториды ЩЗМ и магния содержат примеси кислорода, что меняет их химические и физические свойства, например, понижается температура плавления. Иногда даже возникают ошибки при поиске новых фаз. Другой проблемой является неразличимость ионов F− и О2− (или ОН−) в твердых фазах. Возможность частичного замещения фтора на кислород связана с близостью ионных радиусов, электронных конфигураций, электроотрицательностей атомов фтора и кислорода. Примесь кислорода оказывает большое отрицательное влияние на оптические характеристики фторидных поликристаллических оптических материалов: снижается пропускание как в УФ-, так и в ИКобласти спектра. Одним из источников этой примеси является атмосферная влага, сорбированная мелкодисперсной исходной шихтой и приводящая при высоких температурах к частичному пирогидролизу фторидов ЩЗМ и магния (о чем говорилось выше) [14].
Монокристаллы фторидов ЩЗМ и магния имеют равномерное пропускание в широком диапазоне длин волн и малую дисперсию в видимую область спектра, что обусловлено большой шириной запрещенной зоны (порядка 11–13 эВ). Области пропускания указанных фторидов несколько сдвинуты одна относительно другой, что соответствует расположению этих элементов в Периодической системе. Обладая такими свойствами, фториды ЩЗМ и магния находят применение для изготовления оптической керамики, стекол различного значения, например, в качестве минералов для световодов. Наиболее перспективной группой фторидных стекол являются фторцирконатные стекла, представляющие собой многокомпонентную систему, содержащую, кроме ZrF4, фториды щелочных и щелочноземельных металлов.
Представленная характеристика оксидов и фторидов щелочноземельных металлов и магния позволяет выявить следующие сходства и различия между этими соединениями:
1. Оксиды и фториды ЩЗМ и магния представляют собой ионные соединения, имеющие различные кристаллические структуры. Оксиды имеют кристаллическую решетку типа каменной соли. Кристаллическую структуру типа NaCl можно рассматривать как плотнейшую укладку отрицательно заряженных ионов О2-, все октаэдрические пустоты в которой заняты более мелкими положитель-
16
ными ионами Ме2+. Тетраэдрические пустоты остаются свободными. Для фторидов кальция, стронция и бария характерна структура минерала флюорита CaF2. Кристаллы МgF2 построены по типу рутила. Следует обратить внимание, что структуры типа NaCl и флюорита CaF2 имеют одинаковый тип решетки – гранецентрированный куб, но их структуры совершенно разные.
2.Из сравнения величин энергии кристаллической решетки, представленных в таблицах 1.1 и 1.5, следует, что фториды щелочноземельных металлов и магния являются более устойчивыми соединениями по сравнению с оксидами. При уменьшении энергии кристаллической решетки в ряду фторидов со структурой флюорита
(СаF2, SrF2, BaF2) увеличивается растворимость, также увеличивается плотность соединения. Свойства MgF2, имеющего тип решетки рутила, не укладываются в описанную закономерность. Величина
энергии кристаллической решетки (Ереш.) коррелирует с величинами Тпл оксидов ЩЗМ. Хотя плотность МеО в ряду MgO – CaО – SrO – BaO увеличивается, твердость их падает.
3.Все оксиды ЩЗМ и магния имеют высокие значения энтальпии образования, примерно равные друг другу. Именно высокие значения энтальпии образования оксидов, а также их тугоплавкость делают металлы главной подгруппы второй группы ценными раскислителями в металлургических процессах. Закономерное пониже-
ние Тпл от MgO к ВаО можно объяснить ослаблением Кулоновских взаимодействий Ме2+ – О2- в этом ряду вследствие роста размера катиона [36].Фториды менее тугоплавки, чем оксиды.
4.Оксиды и фториды щелочноземельных и металлов и магния обладают разной растворимостью по отношению к воде, причем у
МеО растворимость в воде больше, чем у МеF2. Отмечается, что оксиды стронция и бария вступают в реакцию с водой с образованием гидроксидов. При переходе в рядах оксидов и фторидов от Mg2+
кВа2+ растворимость увеличивается.
5. В отношении химической активности оксиды и фториды ЩЗМ и магния ведут себя по-разному. Фториды являются более инертными соединениями по сравнению с оксидами. Это объясняется, как указывалось ранее, чрезвычайной химической активностью фтора, обусловленной его высокой электроотрицательностью и небольшим радиусом иона. Фториды ЩЗМ и магния лишь частично растворимы в разбавленных минеральных кислотах и разлагаются сильными кислотами. Химическая активность оксидов ЩЗМ и магния увеличивается при переходе от МgО к ВаО. Оксид магния легко реагиру-
17
ет с кислотами, оксид кальция бурно взаимодействует с кислотами, оксид бария еще более реакционноспособен [21].
Представленные данные показывают, что замена кислорода на фтор дает соединения с различающимися физическими и химическими свойствами, которые должны проявиться и в различии поверхностных свойств данных веществ.
1.2 Способы получения фторидов и оксидов ЩЗМ и магния
Существует большое количество лабораторных и промышленных способов получения оксидов и фторидов магния и ЩЗМ [37– 47]. Например, синтез оксидов магния, кальция, стронция и бария может быть осуществлен:
−взаимодействием гидридов ЩЗМ и магния с водяным паром;
−обезвоживанием гидроксидов ЩЗМ и магния;
−разложением солей и других соединений ЩЗМ и магния.
Как отмечается в работе [42], наиболее высокой активностью обладает оксид магния, полученный разложением химических соединений этого металла: гидроксида, карбоната и оксалата магния; кристаллогидратов сульфата, хлорида и нитрата магния Природа активности, по-видимому, определяется наличием дефектов структуры, появление которых связано с неравновесными условиями образования продуктов реакции. Для МgО, полученного путем термического разложения указанных выше химических соединений магния, характерна весьма мелкодисперсная субструктура и высокая плотность дислокаций. При этом существенными факторами, определяющими параметры субструктуры и соответственно активность оксида магния, являются температура, при которой осуществлялась реакция разложения, и наличие или отсутствие кристаллизационной воды в исходном соединении. Максимальный уровень искажений кристаллической решетки достигается в случае использования в качестве исходного материала безводных солей магния, разлагающихся при относительно низких температурах.
В работе [19] для оксидов ЩЗМ и магния обнаружена, напротив, очень незначительная степень дефектности; особенно мало отклонение от стехиометрии для MgO, на монокристаллах которого проведено значительное количество исследований. На поверхности MgO, полученного термическим разложением гидроксида магния, находится значительно большее количество кислорода в состоянии
18
низкой координации, чем на поверхности образца оксида магния, полученного сжиганием ленты Mg [19]. Образцы MgO с большой степенью разупорядоченности структуры можно получить при относительно низкотемпературной (≥ 573 К) обработке гидроксида магния, причем количество низко координированных ионов уменьшается с ростом температуры термообработки (> 773 К).
Вработе [43] приведены данные по получению оксида магния с высокими адсорбционными свойствами сульфатно-аммиачным и сульфатно-карбонатным методами, рассматривается влияние условий синтеза гидроксида и оксида магния на их адсорбционную активность. Показано, что поверхностные и адсорбционные свойства синтезированного MgO существенно зависят как от исходных продуктов, так и от метода его получения. Условия синтеза (температура, концентрация исходного раствора, количество щелочного реагента и продолжительность процесса) оказывают существенное влияние на величину удельной поверхности оксида магния. При переходе от магния к более тяжелым металлам количество дефектов
воксидах при росте больших монокристаллов возрастает [19], например, для монокристаллов ВаО размером ~ 1 см х 2 мм, выращенных в вакууме, характерно темно-красное окрашивание вследствие содержания ~ 0,1 % избытка металла.
Впоследние годы в литературе можно найти результаты экспериментальных исследований, указывающих на новые методы получения оксидов. Так, в дисертационной работе [48] разработаны фи- зико-химические основы переработки нетрадиционного сырья (доломитов и доломитизированных магнезитов) на чистый оксид и другие соединения магния.
Способ получения фторидов ЩЗМ и магния зависит от области их применения. Синтез этих соединений может быть осуществлен
[40, 41, 44–47]:
− взаимодействием плавиковой кислоты (или раствора щелочного фторида) с любой растворимой солью ЩЗМ;
− взаимодействием плавиковой кислоты или раствора фторида (бифторида) аммония с водными суспензиями оксида, карбоната и некоторых основных солей металлов;
− сплавлением солей щелочноземельных металлов с фторидами металлов I-ой группы;
−карботермическим способом – сплавлением оксида металла с углеродом и FeF2;
19
–прямым фторированием (действием электролитически полученного фтора на МgO);
–действием раствора плавиковой кислоты на оксид магния. Последние два способа были использованы в нашей работе [49]
при получении систем MgO − MgF2.
Химические способы получения, в частности карбонатный, дают образцы с высоким содержанием влаги и СО2 и требуют дополнительной обработки во фторирующей атмосфере [50]. Таким образом, уже непосредственно при синтезе появляется вероятность загрязнения фторидов примесями, как основного, так и кислотного характера, образования различного рода дефектов структуры [28]. Во время синтеза фторидов появление примеси кислорода связано, в основном, с присутствием атмосферной влаги. Влага, сорбированная исходной шихтой (как уже указывалось), приводит при высоких температурах к пирогидролизу фторидов ЩЗМ и магния, что ведет к образованию кислородных примесей, ухудшению оптических характеристик материалов, полученных из фторидов.
При синтезе MgF2 иногда пользуются действием концентрированной HF на оксид магния и сушкой при 400 ºС [51]. Оксиды других щелочноземельных металлов реагируют с HF слишком бурно. При необходимости кристаллизацию фторидов ЩЗМ и сплавление следует проводить в вакууме или в атмосфере сухого газа с целью исключения их взаимодействия при высокой температуре с водяным паром. Известно введение нескольких процентов PbF2 как минерализатора [34]. Очень чистый фтористый кальций встречается в природе в форме «оптического» флюорита.
1.3Краткая характеристика объектов исследования
иих идентификация
Вмонографии представлены результаты исследований поверхностных свойств оксидов и фторидов щелочноземельных металлов
и магния, проведенных на серии образцов разного способа синтеза, а также механических смесях с различным содержанием MgO и MgF2 и системах MgO ‒ MgF2, полученных путем фторирования оксида магния. Ниже даны обозначения, используемые в работе, объектов исследования.
(1) – фторид магния промышленного способа получения из сульфата магния (ГОСТ 7204-77, марка “хч”); (2) – фторид кальция промышленного способа получения из хлорида кальция (ТУ 6-09-
20
