
Атомная физика и физика твёрдого тела
..pdf
Таким образом, r rem re .
n nmмe 207n
В итоге радиус первой орбиты мюона определяется как
r |
r0 |
0,529 10 10 |
2, 44 10 13 м, а отношение: r |
r 1/ 207 . |
|
||||
1 |
207 |
207 |
1 |
0 |
|
|
|
б) Ядро считаем неподвижным, поэтому внутренняя энергия атома равна сумме кинетической энергии мюона и потенциальной энергии взаимодействия мюона с ядром:
|
m v2 |
1 |
e2 |
|
|
E |
м n |
|
|
. |
(5) |
|
|||||
n |
2 |
|
4 0 |
rn |
|
|
|
|
|||
Решив совместно уравнения (1) и (2) и (5), находим допустимые значения энергии мюонного атома и энергию связи Eсв, которая рав-
на энергии ионизации атома. Это энергия, которую надо сообщить мюону, чтобы удалить его за пределы атома. Очевидно, эта энергия равна энергии мюона в невозбужденном состоянии.
Подставив выражения (4) и (3) в формулу (5), для энергии мюона получаем:
|
m e4 |
|
|
m e4 |
|
|
m e4 |
1 |
|
|
||
En |
м |
|
|
м |
|
|
м |
|
|
. |
|
|
32 2 02n2 2 |
4 0 |
4 0n2 2 |
|
32 2 02 2 |
|
n2 |
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
m e4 |
||||
Тогда энергия связи мюона в атоме (n |
= 1): Eсв |
|
|
м |
|
. |
||||||
32 2 02 2 |
||||||||||||
Подставим значения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m e4 |
|
|
|
|
|
|
|
|
|
|||||
|
|
E |
207 |
|
|
|
e |
|
|
|
|
207 |
13,6 эВ 2,82 кэВ, |
|
||||||
|
|
|
|
|
2 |
|
2 |
|
2 |
|
||||||||||
|
|
св |
|
|
32 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
||||||
|
|
m e4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где E1 |
|
e |
|
– энергия связи электрона в атоме водорода. |
|
|||||||||||||||
32 2 02 |
2 |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
в) Подставив выражение (4) для радиуса в формулу (3), получа- |
||||||||||||||||||||
ем скорость мюона на первой орбите: |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
n m e2 |
|
e2 |
|
|
||||||
|
|
|
|
vn |
|
|
|
|
|
|
|
м |
|
|
|
|
. |
(6) |
||
|
|
|
|
|
m |
|
|
4 |
0 |
n2 2 |
4 0n |
|||||||||
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|
|
|
|
||
11
Видно, что от массы частицы эта скорость не зависит, следовательно, скорость мюона на каждой орбите совпадает со скоростью электрона на этой орбите.
Подставим значения для n = 1, имеем:
v |
|
|
1,62 10 38 |
|
2, 2 106 м/с. |
|
|
|
|
||
1 |
4 |
3,14 |
8,85 10 12 1,05 |
10 34 |
|
|
|
г) Чтобы найти число оборотов, которое совершит мюон до своего распада, найдем период обращения мюона:
T 2 rn vn . |
(7) |
Период обращения мюона после подстановки формулы (3) в выражение (7):
|
|
2 r |
|
2 r2m |
|||
|
T |
n |
m r |
|
n |
м |
. |
|
|
n |
|
||||
|
|
n |
м n |
|
|
|
|
Подставив радиус орбиты (4) rn , получаем: |
|||||||
T |
2 mм 16 2 02n4 4 |
|
32 3 02n3 3 |
||||
|
m2 e4 |
|
|
m e4 . |
|||
n |
|
||||||
|
|
|
м |
|
|
м |
|
Число оборотов мюона до его распада – n  T .
T .
|
|
m e4 |
|
Число оборотов |
N |
м |
|
|
. |
||
32 3 02n3 3 |
|||
Подставим значения при n = 1:
N2, 2 10 6 207 9,1 10 31 1,64 10 76 3 1012 оборотов. 32 3,142 8,852 10 24 1,053 10 102
|
|
|
4 |
|
n2 2 |
|
|
re |
–13 |
|
||
|
Ответ: |
r |
|
|
0 |
|
; |
r |
n |
; r1 = 2,44 10 |
|
м; Eсв = 2,82 кэВ; |
|
|
|
|
|
|
|||||||
|
|
n |
|
mмe2 |
|
n |
207 |
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
v1 |
= 2,2 106 м/с; v |
ve ; N = 3 1012 оборотов. |
|
|
||||||||
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
Задача 2. Потенциал ионизации водородного атома i = 13,6 В.
Вычислить: а) значение постоянной Ридберга; б) первый потенциал возбуждения 1; в) энергию фотона, соответствующую второй линии серии Бальмера; г) длину волны первой линии 1 и длину волны коротковолновой границы серий Лаймана, Бальмера, Пашена; д) сколько линий серии Бальмера попадает в видимую часть спектра?
12

Дано:
i = 13,6 В
а) R =
б) 1 =
в) Е21 = г) 1 = ?;
= ? д) N =
Решение. В задаче рассматриваются спектральные закономерности атома водорода, поэтому для ее решения воспользуемся обобщенной формулой Бальмера – Ридберга:
R 1/ ni2 1/ n2j ,
где ni = 1, 2, 3, ..., nj = ( ni + 1); ( nj + 2); ...
а) Энергия ионизации атома Еi e i – это
та энергия, которую необходимо сообщить валентному электрону в атоме, находящемуся в основном состоянии, чтобы удалить его за пределы атома. Для атома водорода это переход из состояния ni 1 в
бесконечность, потому из формулы Бальмера – Ридберга имеем: ni = 1, nj . Тогда i R . Домножив это выражение на постоян-
ную Планка , получаем энергию ионизации i R , которая с другой стороны равна e i R , отсюда
R e i / .
Подставим числовые данные:
R 1,6 10 19 13,6 20,7 10 15 2,07 10 16 с–1. 1,05 10 34
б) Первый потенциал возбуждения соответствует энергии, которую нужно сообщить валентному электрону, находящемуся в основном состоянии, чтобы перевести его на первый возбужденный уровень (для атома водорода nj = 2).
Из формулы Бальмера – Ридберга получаем частоту перехода
1 R 1 12 1
12 1 22 3R
22 3R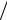 4,
4,
энергия этого перехода 1 1 , тогда первый потенциал возбуждения равен
e (3 / 4) R |
3 4. |
|
1 1 |
e |
i |
|
|
|
Подставим числовые данные: 1 3 13,6 / 4 10, 2 В.
в) Серия Бальмера соответствует переходам электрона из состояний nj = 3, 4, 5, … в состояние ni = 2. Энергия, соответствующая
второй линии этой серии, равна
13
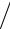
E21 R 1/ 22 1/ 42 3 R /16 3Ei /16 .
Подставим числовые данные: E21 3 13,6 /16 2,55 эВ.
г) Чтобы найти длину волны, запишем формулу Бальмера – Ридберга в виде
1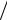 (R
(R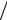 2 c) 1
2 c) 1 ni2 1 n2j .
ni2 1 n2j .
Так как нас интересуют первая и последняя линии каждой серии,
то
для серии Лаймана ni = 1, nj1= 2, nj2 , для серии Бальмера ni = 2, nj1= 3, nj2 , для серии Пашена ni = 3, nj1= 4, n j2 .
Для серии Лаймана: длина волны первой линии
|
|
|
|
|
|
2 c |
|
|
8 c |
121 10 9 121 нм; |
||||||||
|
|
|
1/12 |
1/ 22 |
|
|||||||||||||
|
|
1 |
|
R |
|
R 3 |
|
|
|
|||||||||
границы линии |
|
|
|
2 c |
2 c |
91 10 9 |
91 нм. |
|||||||||||
R 1/11 1/ 2 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
R |
|
|
||||||
Для серии Бальмера: |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
2 c |
|
|
2 c 36 |
655,2 нм, |
|
|
|||||||
|
R 1/ 22 1/ 32 |
|
|
|
|
|
||||||||||||
1 |
|
|
|
R 5 |
|
|
|
|
|
|||||||||
|
|
2 с |
|
4 364 нм. |
|
|
|
|
|
|
|
|||||||
|
R |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для серии Пашена: |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
2 с |
|
|
|
2 c 144 1872 нм, |
|
|
|||||||
|
R 1/ 33 1/ 44 |
|
|
|||||||||||||||
1 |
|
|
|
R 7 |
|
|
|
|
|
|||||||||
|
|
2 c |
|
9 819 нм. |
|
|
|
|
|
|
|
|||||||
|
R |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
д) В видимую часть спектра попадают длины волн в диапазоне от 400 нм до 760 нм. Рассчитав длины волн серии Бальмера, подсчитаем число линий, длины которых укладываются в этот диапазон.
Произведем подсчет длин волн всех линий серии Бальмера, лежащих в видимой части спектра:
14

|
|
|
2 c |
|
|
2 c 36 655, 2 нм; |
|||||||
R 1/ 22 |
1/ 32 |
||||||||||||
1 |
|
|
|
|
R 5 |
|
|
|
|||||
2 |
|
2 c |
|
1 |
|
|
|
|
2 c 16 |
485 нм; |
|||
R 1/ 22 1/ 42 |
R 3 |
||||||||||||
|
|
|
|
|
|
||||||||
3 |
|
2 c |
|
1 |
|
|
|
|
2 c 100 |
433 |
нм; |
||
R 1/ 22 1/ 52 |
|
|
R 21 |
|
|||||||||
|
|
|
|
|
|
|
|
||||||
4 |
|
2 c |
|
1 |
|
|
|
|
2 c 36 |
409,5 нм; |
|||
R 1/ 22 1/ 62 |
R 8 |
||||||||||||
|
|
|
|
|
|
||||||||
5 |
|
2 c |
|
1 |
|
|
|
|
2 c 196 |
396 |
нм. |
||
R 1/ 22 1/ 72 |
|
|
R 45 |
|
|||||||||
|
|
|
|
|
|
|
|
||||||
Линия 5 лежит уже в ультрафиолетовой части спектра. Таким образом, число линий серии Бальмера, лежащих в видимой части
спектра, равно N = 4. |
|
|
|
|
|
|
|
Ответ: a) |
R = 2,07 1016 |
с–1; б) |
|
= 10 2 В; в) |
E |
= 2,55 эВ; |
|
г) 1 = 121 нм; |
|
|
|
1 |
|
21 |
|
= 91 нм; |
1 |
= 655,2 нм; |
= 364 нм; |
1 = 1872 нм; |
|||
= 364 нм; д) N = 4. |
|
|
|
|
|
|
|
Задача 3. Какую работу нужно совершить, чтобы удалить электрон со второй орбиты атома водорода за пределы притяжения его ядром?
Дано:
n = 2
me = 9,1 10–31 кг e = 1,6 10–19 Кл
A = ?
Решение. Чтобы удалить электрон со второй орбиты атома, необходимо совершить работу, равную потенциальной энергии на этой орбите в поле электростатического притяжения ядра. Очевидно, эта энергия равна
E |
1 |
e2 |
(1) |
|
, |
||
|
|||
n |
4 0 |
rn |
|
|
|
где rn – радиус орбиты, который можно найти по второму закону Ньютона:
mv2 |
1 e2 |
. |
(2) |
||
|
|
|
|||
4 0 rn2 |
|||||
rn |
|
|
|||
Для определения скорости v электрона воспользуемся правилом квантования орбитального момента импульса электрона
mvrn n . |
(3) |
15
Решив совместно эти три уравнения, находим работу по удалению электрона.
Скорость электрона на n-й орбите согласно выражению (3)
v |
n |
|
, |
подставив полученную формулу в (2), |
получаем: |
|||||||||||||
mr |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
m n2 2 |
|
|
1 e2 |
|
|
|
|
rn |
4 0 2n2 |
|
|
|||||||
|
|
|
|
|
|
|
|
, отсюда |
|
|
. Подставив в (1), находим |
|||||||
rn m2rn2 |
|
4 0 rn2 |
me2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
работу: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
A |
|
1 |
|
me4 |
|
me4 |
. |
|
||
|
|
|
|
|
|
|
|
4 0 |
4 0 2n2 |
16 2 02 2n2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Подставим |
в |
|
|
формулу |
числовые |
значения: |
||||||||||
A |
9,1 10 31 1,64 |
10 76 |
5, 47 10 19 Дж = 3,42 эВ. |
|
|
|||||||||||||
|
|
|
|
|
92 1018 1,05 |
|
|
|
|
|
|
|
|
|
||||
Ответ: A = 5,47 10–19 Дж = 3,42 эВ.
Задача 4. Определить изменение орбитального момента импульса и орбитального магнитного момента электрона при переходе его из возбужденного состояния в основное с испусканием фотона с
длиной волны = 1,02 10–7 м. |
|
|
|
|||
Дано: |
Решение. Электрон в атоме водорода перешел |
|||||
ni = 1 |
из состояния с номером nj в основное состояние |
|||||
= 1,02 10–7 м |
n = 1. Длина волны испущенного фотона известна, |
|||||
L = ? |
i |
|
|
|
||
следовательно, воспользовавшись формулой Баль- |
||||||
|
||||||
мера – Ридберга 1 R (2 c) 1/ ni2 1/ n2j |
, найдем nj : |
|||||
|
nj |
|
1 |
|
. |
|
|
1/ n2 |
|
|
|||
|
|
2 c / R |
||||
|
|
i |
|
|
|
|
Согласно правилу квантования орбит, момент импульса электрона на n-й орбите Ln n , тогда изменение момента импульса
L Ln2 Ln1 .
Момент импульса в возбужденном состоянии
Lnj n j |
|
|
, |
|
1/ n2 |
2 c / R |
|||
|
|
|||
|
i |
|
|
в основном состоянии Lni ni , и изменение момента импульса
16

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
L L L |
|
|
|
|
|
|
1 |
|
|
. |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
ni |
|
nj |
|
|
|
1/ n2 |
2 c / R |
|
|
|
|
1/ n2 |
2 c / R |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
Подставим числовые данные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L 1,05 10 |
34 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
34 |
|
2 |
|
1 |
|
||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2,03 10 |
|
кг м |
|
с |
|
. |
||||
|
|
|
6, 28 |
3 108 |
|
|
|
|
|
|
||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
1,02 10 |
7 |
2 10 |
16 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Момент импульса при переходе электрона в основное состояние уменьшился.
Электрон, движущийся по орбите, обладает магнитным моментом IS , где I – сила тока, соответствующего движению электрона,
I е/ Т (T – период обращения |
T 2 r / ), |
S = 2 r2 – площадь, |
||||||||||
охватываемая орбитой, тогда |
|
|
|
|
|
|
|
|||||
|
|
|
e r2 |
|
e |
|
e |
mvr |
|
|
e |
|
|
|
|
n |
v |
|
r v |
|
|
|
L . |
||
|
|
2m |
2m |
|||||||||
|
n |
|
2 r |
|
2 n |
n |
|
n |
||||
|
|
|
n |
|
|
|
|
|
|
|
|
|
Это гиромагнитное отношение, связывающее орбитальные магнитный и механический (импульса) моменты электрона в атоме водорода. Изменение магнитного момента (е/ 2m) Ln .
Изменение магнитного момента электрона
|
e |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
. |
|
||
2m с |
|
2 |
2 c / R |
|
|
|||||||
|
|
|
|
|
|
|||||||
|
е |
|
|
|
1/ n j |
|
|
|
||||
Подставим значения: |
1,6 10 19 2 10 34 |
5,8 10 32 |
А м2. |
|||||||||
8 |
2 |
9,1 10 |
31 |
|||||||||
|
|
|
|
3 10 |
|
|
|
|
|
|||
Магнитный момент увеличился.
Ответ: L 2,03 10 34 кг м2 с 1, μ 5,8 10 32 А м2.
Задача 5. Считая поправку в законе Мозли равной единице, найти, сколько элементов содержится в ряду между элементами, у которых длины волн K -линий равны 375,3 пм и 251,2 пм (20 (Ca), 21 (Sc), 22 (Ti)).
17
Дано:
= 11 = 3,753 10–10 м
2 = 2,512 10–10 м Z = ?
Решение. Линии K , излучаемые ато-
мом, возникают при переходе электрона с уровня nj = 2 на уровень ni = 1. Согласно
формуле Мозли:
R Z 2 |
|
1 |
|
1 |
|
|
|
|
|
. |
(1) |
||||
|
n 2 |
||||||
|
n 2 |
|
|
|
|||
|
|
i |
|
j |
|
|
|
Определим атомные номера Z элементов, для которых известны длины волн K -линий. Учтём, что 2 с. Тогда формулу (1) можно записать
2 с R |
Z 1 2 |
1 |
|
1 |
|
3 R |
Z 1 2 . |
||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
4 |
|
|
|||
|
|
12 |
|
|
22 |
|
|
|
|||||
Отсюда выразим Z: |
Z 1 |
|
8 с |
. |
|
|
|
||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
3 R |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставим значения длин волн из дано:
Z1 |
1 |
|
|
8 3,14 3 108 |
|
19; |
||
3 |
3,753 10 10 |
2,07 1016 |
||||||
|
|
|
||||||
Z2 |
1 |
|
|
8 3,14 3 108 |
23. |
|||
|
3 2,512 10 10 |
2,07 1016 |
||||||
|
|
|
|
|||||
В итоге можно сделать вывод, что между элементами с номерами 19 и 23 находятся 3 элемента, атомные номера которых 20 (Ca, кальций), 21 (Sc, скандий), 22 (Ti, титан).
Ответ: 3 элемента: 20 (Ca, кальций), 21 (Sc, скандий), 22 (Ti, ти-
тан).
1.3Задачи для решения на практических занятиях
1.На какое расстояние rmin может приблизиться к неподвижно-
му ядру атома золота -частица при центральном соударении, если скорость частицы на большом расстоянии от ядра v = 3 107 м/с?
2.Сколько спектральных линий будет испускать атомарный водород, который возбуждают на n-й энергетический уровень?
3.Найти квантовое число n, соответствующее возбужденному состоянию иона He+, если при переходе в основное состояние этот
18
ион испустил последовательно два фотона с длинами волн
1 = 121,4 нм, 2 = 30,35 нм.
4.Определите длину волны спектра испускания ионизованного
гелия, соответствующего переходу электрона с орбиты n2 = 4 на орбиту с n1 = 2.
5.Пользуясь формулой Бальмера, рассчитайте коротковолновую
идлинноволновую границы спектра атомарного водорода для серии Бальмера.
6.Учитывая, что в постоянную Ридберга R входит приведенная масса ядра и электрона, найдите разность длин волн головных линий серии Лаймана для атомов легкого и тяжелого водорода (дейтерия). На сколько электронвольт отличаются работы ионизации для этих атомов?
7.Определить скорость v электрона на второй орбите атома водорода.
8.Вычислить длину волны , которую испускает ион лития Li++ при переходе со второго энергетического уровня на первый.
9.Определить первый потенциал U1 возбуждения иона Li++.
10.При исследовании линейчатого рентгеновского спектра некоторого элемента было найдено, что длина волны линии K рав-
на 76 пм. Какой это элемент?
Тестовые задания
1.Согласно первому постулату Бора электроны могут двигаться
ватоме только по определённым (стационарным) орбитам. Определите величину момента импульса электрона в атоме водорода, находящегося во втором возбуждённом состоянии. Ответ дайте в СИ.
Варианты ответов:
1) 1,05 10–34; 2) 2,1 10–34; 3) 3,15 10–34; 4) 4,2 10–34. 2. Выберите верное соотношение между кинетической Eк , по-
тенциальной Eп и полной E энергиями электрона в атоме водорода.
Варианты ответов: |
|
||
1) |
Eк = –0,5 Eп; E = Eк ; |
2) Eк = – Eп; E = 0; |
|
3) Eп = 2 Eк ; |
E = – Eк ; |
4) Eп = –2 Eк ; E = – Eк ; |
|
5) |
Eк = 0,5 Eп; |
E = – Eк . |
|
3. В какой области спектра излучения находится серия Брэкета?
19
Варианты ответов:
1)в инфракрасной;
2)в видимой;
3)в ультрафиолетовой;
4)в области рентгеновского излучения.
4. По какой из приведённых ниже формул может быть верно рассчитана длина волны, соответствующая второй линии спектра серии Пашена?
Варианты ответов:
|
1 |
|
|
1 |
|
1 |
|
|
|
|
1) |
|
|
R |
1 |
|
9 |
|
; |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||
|
1 |
|
|
1 |
|
1 |
|
|
||
3) |
|
|
R |
|
|
|
|
|
|
; |
|
|
4 |
16 |
|||||||
|
|
|
|
|
|
|||||
|
1 |
|
|
1 |
|
1 |
|
|
||
5) |
|
|
R |
|
|
|
|
|
. |
|
|
|
9 |
25 |
|||||||
|
|
|
|
|
|
|||||
5. Выберите правильное
тральных линий ωКα, ωКβ, ωLα новского излучения.
Варианты ответов: 1) K > K > L ; 3) ωКβ > K > L ; 5) K > L > K .
|
1 |
|
1 |
|
1 |
|
|
|
||
2) |
|
R |
4 |
|
9 |
|
; |
|
||
|
|
|||||||||
|
|
|
|
|
|
|||||
|
1 |
|
1 |
|
1 |
|
|
|
|
|
3) |
|
R |
|
|
|
|
|
|
|
; |
|
9 |
16 |
|
|||||||
|
|
|
|
|
|
|||||
соотношение между частотами спек- в спектре характеристического рентге-
2) K < K < L ; 4) K > L > K ;
1.4Задачи для самостоятельного решения
1.На какой орбите скорость электрона в атоме водорода равна
734 км/с?
2.В спектре атомарного водорода известны длины волн трех линий, принадлежащих одной и той же серии: 97,26; 102,58 и 121,57 нм. Найти длины волн других линий в данном спектре.
3.Какому элементу принадлежит водородоподобный спектр, длина волны которого в 4 раза короче, чем у атомарного водорода.
4.Пользуясь формулой Бальмера, рассчитайте коротковолновую
идлинноволновую границы спектра атомарного водорода для серии Лаймана.
20
