
МЕД химия тест
.docxАминотриуксусная кислота
Этилендиаминтетрауксусная кислота
+ Двунатриевая соль этилендиаминтетрауксусной кислоты*
Триметиленамин
Трихлоруксусная кислота
Ионы металлов образуют с комплексоном III связи:
Две ионные и одну координационную
+ Две ионные и две координационные*
Одну ионную и одну координационную
Одну ионную и три координационных
Все координационные
В комплексонометрии применяется индикатор:
+Эриохром черный*
Бриллиантовый зеленый
Бромтимоловый синий
Тимолфтелеин
Метиленовый красный
Ионы металла в комплексонометрии образуют с индикатором соединение:
+ Красного цвета*
Синего цвета
Зеленного цвета
Желтого цвета
Бурого цвета
Метод комплексонометрии применяется для определения:
Концентрации кислот
Концентрации оснований
Концентрации окислителей
Концентрации восстановителей
+Жесткости воды*
При определении жесткости воды цвет раствора в точке эквивалентности изменяется:
+ От красного к синему*
От синего к красному
От желтого к красному
От красного к желтому
От синего к зелёному
Определение жесткости воды в комплексонометрии проводится в среде:
Нейтральной
Кислой
+Щелочной*
Слабокислой
Слабонейтральной
Определение жесткости воды в комплексонометрии проводится в среде буферного раствора:
+Аммиачного*
Бикарбонатного
Фосфатного
Ацетатногo
Белкового
Жесткость воды связана с присутствием в ней ионов:
Натрия и калия
+Магния и кальция*
Натрия и магния
Калия и кальция
Лития и кремния
Постоянная жёсткость воды связана с присутствием солей кальция и магния:
Бикарбонатов
Фосфатов
+Хлоридов*
Ацетатов
Силикатов
Временная жесткость воды связана с присутствием в ней солей кальция и магния:
+Бикарбонатов*
Фосфатов
Хлоридов
Сульфатов
Силикатов
Постоянная жесткость воды связана с присутствием в ней солей кальция и магния:
Бикарбонатов
Фосфатов
Ацетатов
+Сульфатов*
Силикатов
Общая жесткость воды определяется присутствием солей кальция и магния:
Бикарбонатов и фосфатов
Всех кислот
+ Бикарбонатов, хлоридов и сульфатов*
Хлоридов и сульфатов
Бикарбонатов, фосфатов, силикатов
Реакция является экзотермической, если:
Q и ΔH имеют отрицательное значение
Q и ΔH имеют положительное значение
+Q имеет положительное, а ΔH имеет отрицательное значение*
Q имеет отрицательное, а ΔH имеет положительное значение
Сумма Q и ΔH положительная
Реакция является эндотермической, если:
Q и ΔH имеет положительное значение
Q имеет положительное, а ΔH имеет отрицательное значение
+Q имеет отрицательное, а ΔH имеет значение положительное*
Q и ΔH имеет отрицательное значение
Сумма Q и ΔH положительная
При растворении СН3СООNa в присутствии фенолфталеина раствор окрашивается в цвет:
Синий
Оранжевый
+Малиновый*
Бурый
Бесцветный
При растворении СН3СООNa в присутствии метилоранжа раствор окрашивается в цвет:
Синий
Оранжевый
Малиновый
+Жёлтый*
Бесцветный
Самопроизвольное протекание реакции возможно при значении энергии Гиббса:
+ΔG < 0 *
ΔG > 0
ΔG = 0
ΔS < 0
ΔH < 0
Самопроизвольное протекание реакции невозможно при значении энергии Гиббса:
+ΔG > 0 *
ΔG < 0
ΔG = 0
ΔS < 0
ΔH < 0
Выберите математическое выражение 1го закона термодинамики:
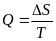
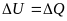
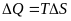
+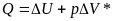
Qv = U2 –U1
Для расчёта теплового эффекта химических реакций используется закон:
+Гесса *
Рауля
Гиббса
Сеченова
Генри
Параметр, определяемый на основе закона Гесса:
Внутренняя энергия
Электрическая энергия
+Изменение энтальпии *
Энергия Гельмгольца
Изменение давления
Согласно закону Гесса тепловой эффект химических реакций зависит от:
Числа ступеней по которым проходит реакция
+Природы и агрегатного состояния веществ *
Давления
Температуры
Размера поверхности
Законом, характеризующим изменение давление пара растворителя над раствором является:
Гесса
+Рауля *
ВантГоффа
Сеченова
Генри
Первому закону Рауля соответствует формула:
ΔH = ΔU + TΔS
+
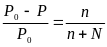 *
*
Δtкип. = E . b
Δtзам. = К . b
P = сRT
Математическим выражением эбуллиоскопического закона Рауля является:
ΔH = ΔU + TΔS
+Δtкип. = E·b *
Δtзам. = К·b
P = сRT
Предельная концентрация кислоты (щёлочи), добавляемого в буфер без значительного изменения рH называется:
Величина рН буфера
+Буферная ёмкость *
Концентрация буфера
Объём кислоты или основания
Константа диссоциации кислоты или основания
Буферная ёмкость рассчитывается для следующего объёма буфера:
10 литров
15 литров
+1 литр *
5 литров
0,1 литр
Буферная ёмкость рассчитывается по формуле:
pH = lg [H+]
См = m / MV
Кд = [AB]/ [A+]n [B]m
n = m / M
+В = С / рН1 – рН0 *
Основную часть буферной ёмкости плазмы крови определяет буферная система:
Фосфатная
Аммиачная
+Гидрокарбонатная *
Ацетатная
Белковая
Укажите химический состав гидрокарбонатной буферной системы
NaH2PO4 + Na2HPO4
+NaHCO3 + H2CO3 *
CH3COONa + CH3COOH
PtCOONa + PtCOOH
NH4CO3 + NH4OH
Механизм буферного действия при добавлении ОН ионов в гидрокарбонатный буфер отражён в уравнении:
+H2CO3 + OH = HCO3 + H2O *
H2PO4 + OH = HPO42 + H2O
NH4CO3 + OH = NH4OH + CO3
CH3COOH + OH = CH3COO + H2O
PtCOOH + OH = PtCOO + H2O
Основной внутриклеточной буферной системой является:
+Фосфатная *
Аммиачная
Гидрокарбонатная
Ацетатная
Белковая
Укажите химический состав фосфатной буферной системы
PtCOONa + Pt COOH
Na3РО4 + H3РO4
CH3COONa + CH3COOH
+NaH2PO4 + Na2HPO4 *
NH4Cl + NH4OH
Какой Механизм буферного действия при добавлении ОН ионов в фосфатный буфер отражён в уравнении:
Na3РО4 + OH = H3РO4 + H2O
+H2PO4 + OH = HPO42 + H2O *
NH4Cl + OH = NH4OH + Cl
CH3COOH + OH = CH3COO + H2O
PtCOOH + OH = PtCOO + H2O
Буферная система, оказывающая действие во всех клетках и тканях организма:
Фосфатная
Аммиачная
Гидрокарбонатная
Ацетатная
+Белковая *
Укажите химический состав белковой буферной системы:
NaH2PO4 + Na2HPO4
NaHCO3 + H2CO3
CH3COONa + CH3COOH
+PtCOONa + PtCOOH *
NH4Cl + NH4OH
Механизм буферного действия при добавлении ОН ионов в белковый буфер отражён в уравнении:
H2CO3 + OH = HCO3 + H2O
H2PO4 + OH = HPO42 + H2O
+PtCOOH + OH = PtCOO + H2O *
CH3COOH + OH = CH3COO + H2O
NH4Cl + OH = NH4OH + Cl
Частицы, которые непосредственно связаны с комплексообразователем называются:
Внутренняя сфера
+Лиганды *
Внешняя сфера
Катион
Анион
Количество лиганд называется:
Валентность
Степень окисления
+Координационное число*
Электроотрицательность
Сродство к атому
По химической природе лиганды могут быть:
Катионами
Металлами
+Полярной нейтральной частицей или кислотным остатком*
Атомом и молекулой
Радикалом или свободным атомом
Внешнюю сферу катионных комплексов могут образовывать частицы:
+Кислотный остаток или гидроксидная группа*
Металл
Нейтральная полярная молекула
Неметалл
Ион аммония
Во внешней сфере анионных комплексов могут располагаться частицы:
Кислотный остаток или гидроксидная группа
+Ион металла или ион аммония*
Нейтральная полярная молекула
Неметалл
Молекулы воды
Циклические комплексы называются:
Катионные
Анионные
Гетероциклические
+Хелаты *
Комплексоны
Частицы, выполняющие роль лигандов в хелатах называются:
Молекулы воды
Молекулы аммиака
Карбонильная группа
+Комплексоны*
Неорганические молекулы
Соединение, принадлежащее к группе хелатов – это:
Аквакомплекс
+Хлорофилл *
Ацидокомплекс
Амминокомплекс
Ацетат свинца
Метод титриметрического анализа для определения жёсткости воды называется:
Аргентометрия
+Комплексонометрия *
Перманганатометрия
Алкалиметрия
Иодометрия
В комплесонометрии в качестве рабочего раствора используется:
Раствор иода
+Раствор Трилона Б *
Сильная кислота
Сильное основание
Перманганат калия
В комплексонометрии в качестве индикатора используется:
Тимолфталеин
Фенолфталеин
Метилоранж
Метилкрасный
+Эриохром чёрный *
Для определения концентрации кислот и оснований используется метод объёмного анализа называемый:
Оксидиметрия
Перманганатометрия
+Нейтрализации *
Комплексометрия
Осаждения
Метод нейтрализации в свою очередь делится на методы:
Перманганатометрия, хроматометрия
+Алкалиметрия, ацидиметрия *
Иодометрия, хроматометрия
Комплексонометрия, хелатометрия
Аргентометрия, перманганатометрия
Точка эквивалентности в методе нейтрализации определяется:
По выпадению осадка
По изменению окраски осадка
По изменению цвета рабочего раствора
По точке излома кривой титрования
+По изменению окраски индикатора *
Метод оксидиметрии, используемый для определения концентрации пероксида водорода называется:
Алкалиметрия
Ацидиметрия
Хроматометрия
+Перманганатометрия *
Хроматометрия
Роль индикатора в методе перманганатометрии выполняет:
+Рабочий раствор *
Метилоранж
Метиловый красный
Фенолфталеин
Исследуемый раствор
Отличительной чертой реакции диспропорционирования является то, что:
Окислитель и восстановитель содержатся в одной и той же молекуле
+Один и тот же атом и окисляется и восстанавливается *
Катион одного соединения занимает место катиона в другом соединении
Идет образование циклических комплексов
Образуются двойные соли
Какое из перечисленных заболеваний относится к эндемическим:
Алюминоз
+Стронциевый рахит *
Бериллиоз
Антракоз
Аргирия
Гальванический элемент служит для преобразования энергии:
Тепловой в химическую
Химической в механическую
Механической в электрическую
Ядерной в химическую
+Химической в электрическую *
Величина, равная разности потенциалов между двумя электродами называется:
Напряжением
+Электродвижущей силой *
Химической энергией
Ядерной энергией
Индукцией
Величина электрохимического потенциала рассчитывается по уравнению:
ВантГоффа
ГульдбергаВааге
+Нернста *
Ньютона
Эйнштейна
Величина электрохимического потенциала для редокс системы Fe+3/Fe+2 впервые была рассчитана:
ВантГоффом
Нернстом
+Петерсом *
Уотсоном
Фельдманом
По величине стандартного редокс потенциала системы можно предсказать:
Образование продуктов
Расщепление веществ
Величину рн системы
+Направление редокс процесса *
Заряд потенциала
Математическим выражением криоскопического закона Рауля является:
ΔH = ΔU + TΔS
P = RT
Δtкип. = E·b
+Δtзам. = К·b *
P = сRT
Растворы, поддерживающие постоянство рн, при добавлении небольших количеств кислот и щелочей называются:
Кислотами
Основаниями
Электролитами
+Буферными *
Коллоидными
Буферные растворы могут состоять из:
Сильной кислоты и соли этой кислоты со слабым основанием
Сильной кислоты и соли кислоты с сильным основанием
+Слабой кислоты и соли этой кислоты с сильным основанием *
Слабой кислоты и соли этой кислоты с другой слабой кислотой
Сильного основания и соли этого основания с другим слабым основанием
В состав буферных растворов могут входить:
Две соли одного и того же основания
+Две соли одной и той же многоосновной кислоты *
Две соли одной и той же одноосновной кислоты
Две двойные соли
Две смешанные соли
Буферные растворы – это смесь:
Сильной кислоты и соли этой кислоты со слабым основанием
Сильной кислоты и соли кислоты с сильным основанием
Слабой кислоты и соли этой кислоты со слабым основанием
Слабой кислоты и соли этой кислоты со слабой кислотой
+Слабого основания и соли этого основания с сильной кислотой *
Механизм буферного действия заключается в образовании:
Слабой кислоты
+Более слабого электролита, чем исходный *
Более сильного электролита, чем исходный
Слабого основания
Соли слабой кислоты и сильного основания
рН буферного раствора рассчитывается с помощью уравнения:
ГульдбергаВааге
Разумовского
+ГендерсонаГассельбаха *
ГейЛюссака
ВантГоффа
Уравнение для расчёта рн буферных растворов выводится на основании закона:
Сохранения массы веществ
Постоянства состава химических веществ
Закона кратных отношений
+Закона действия масс *
Закона эквивалентов
При расчёте буферной ёмкости учитывается количество добавленной кислоты или щёлочи, выраженное в:
Граммах
Миллилитрах
Литрах
Килограммах
+Миллиэквивалентах *
В организме человека отсутствует буферная система:
+Аммиачная *
Фосфатная
Гемоглобиновая
Гидрокарбонатная
Оксигемоглобиновая
Щелочным резервом крови называется количество:
Гидроксидов, присутствующих в крови
+Углекислого газа в крови связанного в виде НСО3 *
Сильных кислот, присутствующих в крови
Слабых кислот, присутствующих в крови
Солей в крови, дающих нейтральную реакцию
При действии на фосфатный буфер гидроксида натрия, в качестве слабого электролита образуется:
Фосфорная кислота
Фосфат калия
Гидрофосфатный ион НРО42
Фосфат натрия
+Вода *
При действии на фосфатный буфер соляной кислоты, в качестве слабого электролита образуется:
Фосфорная кислота
Фосфат калия
+Дигидрофосфатный ион Н2РО4 *
Фосфат натрия
Вода
При определении на практике буферной ёмкости крови по кислоте, в качестве индикатора используется:
Фенолфталеин
Лакмус
+Метилоранж *
Метилкрасный
Тимолфталеин
При определении буферной ёмкости крови по щелочи, в качестве индикатора используется:
+Фенолфталеин *
Лакмус
Тимолфталеин
Метилоранж
Метилкрасный
Гальванический элемент служит для преобразования энергии:
Тепловой в химическую
Химической в механическую
Механической в электрическую
Ядерной в химическую
+Химической в электрическую *
Величина, равная разности потенциалов между двумя электродами называется:
Напряжением
+Электродвижущей силой *
Химической энергией
Ядерной энергией
Индукцией
Величина электрохимического потенциала рассчитывается по уравнению:
ВантГоффа
ГульдбергаВааге
+Нернста *
Ньютона
Эйнштейна
Величина электрохимического потенциала для редокс системы Fe+3/Fe+2 впервые была рассчитана:
ВантГоффом
Нернстом
+Петерсом *
Уотсоном
Фельдманом
По величине стандартного редокс потенциала системы можно предсказать:
Образование продуктов
Расщепление веществ
Величину рН системы
+Направление редокс процесса *
Заряд потенциала
Согласно закону Кольрауша определяется значение:
Предельной удельной электропроводности
Начальной молярной электропроводности
Степени диссоциации
Константы диссоциации
Предельной молярной электропроводности *
Кондуктометрией называется метод определения физикохимических параметров на основании значений:
Силы тока
Потенциалов
Напряжения
+Электропроводности *
ЭДС
Кривая потенциометрического титрования строится на основе зависимости:
Силы тока от концентрации
Напряжения от объёма раствора
+Электродвижущей силы от объёма титранта *
Потенциала от массы титранта
Электропроводности от объёма титранта
Закон Генри определяет зависимость растворимости газов в жидкости от:
Температуры
+Давления *
Природы веществ
Присутствия посторонних веществ
Водородного показателя
Закон Сеченова определяет зависимость растворимости газов в жидкости от:
Температуры
Давления
Природы веществ
+Присутствия посторонних веществ*
Водородного показателя
Закон ВантГоффа определяет зависимость осмотического давления от:
От давления
Природы веществ
+Концентрации веществ *
Присутствия посторонних веществ
Водородного показателя
Индикаторы в методе нейтрализации должны обладать свойством:
Комплексных соединений
Легко улетучиваться
Выпадать в осадок
+Кислоты или основания *
Растворяться в полярных растворителях
