
- •Занятие № 7 (Лабораторная работа) Тема: Кислотно-основное равновесие. Буферные системы
- •Вычисление показателя pH в буферном растворе
- •Значение буферных систем в медицине
- •Практическая часть Опыт 1. Приготовление ацетатных буферных растворов с разным значением pH
- •Опыт 2. Определение буферной ёмкости сыворотки крови
- •Контрольные вопросы:
Занятие № 7 (Лабораторная работа) Тема: Кислотно-основное равновесие. Буферные системы


Одним из свойств внутренней среды организма является постоянство концентрации ионов водорода. Сохранение постоянства концентрации связано с рядом физико-химических и физиологических механизмов. Уровень pH среды в организме зависит от веществ, поступающих извне, различных кислотных и щелочных веществ, которые образуются в результате метаболизма в качестве промежуточных продуктов. Однако ресурсы, сохраняющие кислотно-щелочное равновесие сохраняют постоянство среды системы. В основном за это ответственны буферные системы организма. Большое теоретическое и практическое значение имеет знание механизма их действия, определение рН, буферной емкости, определение количества кислот и оснований в реакционной среде.
Свойство растворов сохранять постоянство значения pH среды называется буферным действием. Растворы обладающие буферным действием называются буферными растворами. Буферные растворы бывают состоящими из :
Смеси слабой кислоты и соли, образованной этой кислотой с сильным основанием
Смесь слабого основания и соли, образованной этим основанием с сильной кислотой
Например:
CH3COOH + CH3COONa - ацетатный буферный раствор
H2CO3 + NaHCO3 - бикарбонатный буферный раствор
Na2HPO4 + NaH2PO4– фосфатный буферный раствор
NH4OH +NH4Cl – аммиачный буферный раствор
PtCOOH + PtCOONa – белковый буферный раствор
HHb + KHb – гемоглобинный буферный раствор
HHBO2 + KHBO2 – оксигемоглабинный буферный раствор
В человеческом организме постоянство pH среды в биологических жидкостях сохраняется благодаря вышеперечисленным буферным растворам, за исключением ацетатного и аммиачного буферных растворов.
Механизм действия буферных систем. Действие буферных систем заключается в образовании слабого электролита, вместо сильного. Например, в ацетатной буферной системе уксусная кислота диссоциирует как слабый электролит, а ацетат натрия - как сильный.
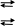
CH3COOH CH3COO- + H+
CH3COONa CH3COO- + Na+
Если в данную буферную систему добавить HCl, один из компонентов смеси соединяется с ионами CH3COO- образуя слабый электролит CH3COOH:
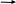
CH3COO- + H+ CH3COOH
Как видно из уравнения, сильная кислота заменяется слабой кислотой в эквивалентном количестве (в данном случае HCl заменяется на CH3COOH).

