
- •Опыт Резерфорда по рассеянию альфа-частиц.
- •Атомная модель Бора. Постулаты Бора.
- •Атомная модель Бора. Строение энергетических уровней атома. Основное состояние. Энергия ионизации.
- •Атомная модель Бора. Квантование момента импульса, радиуса орбиты и энергии электрона.
- •Опыт Франка и Герца, подтверждающий существование дискретных энергетических уровней атома.
- •Линейчатые спектры излучения и поглощения разреженных газов. Серия Бальмера. Серия Пашена. Серия Лаймана. Обобщенная формула Бальмера.
- •Рентгеновское излучение. Устройство рентгеновской трубки. Спектр рентгеновского излучения. Закон Мозли.
- •Рентгеновское излучение и его получение в рентгеновской трубке. Тормозное рентгеновское излучение, его коротковолновая граница.
- •Поглощение, спонтанное и вынужденное испускание излучения. Вынужденные переходы. Инверсная заселенность уровней и способы ее создания.
- •Строение атомного ядра. Заряд, размер и масса атомного ядра. Капельная и оболочечная модели атомного ядра.
- •1936 Год — Нильс Бор
- •Нуклоны. Понятие о свойствах и природе ядерных сил.
- •Радиоактивный распад. Виды радиоактивных распадов. Закон радиоактивного превращения. Активность. Период полураспада, постоянная распада.
- •Ядерные реакции. Виды и механизмы ядерных реакций. Законы сохранения. Эффективное сечение реакции.
- •Реакции деления. Цепная реакция. Ядерная энергетика.
- •Ионизирующее излучение. Дозиметрия ионизирующих излучений.
- •Физические основы квантовой механики. Принцип соответствия. Принцип причинности. Принцип дополнительности.
- •Принцип неопределенности Гейзенберга. Неопределенность координат и времени. Неопределенность энергии и импульса.
- •Уравнение Шредингера. Волновая функция и ее статистический смысл.
- •Потенциальный порог (потенциальная ступень). Прохождение частицей потенциального барьера конечной высоты. Туннельный эффект.
- •Квантовые числа атома. Моменты импульса атома: орбитальный, спиновый, результирующий.
- •Квантовые числа атома. Принцип запрета Паули. Заполнение оболочек и подоболочек в атоме.
- •Квантово-механическая модель строения атома.
- •Магнитные свойства атома. Орбитальный и спиновый магнитные моменты. Полный магнитный момент. Эффект Зеемана.
- •Энергия молекулы. Колебательные и вращательные уровни. Молекулярные спектры. Комбинационное рассеяние света.
- •Фундаментальные взаимодействия. Элементарные частицы и античастицы.
- •Виды взаимодействий и их объединение в рамках единой теории. Классификация элементарных частиц. Кварки.
Линейчатые спектры излучения и поглощения разреженных газов. Серия Бальмера. Серия Пашена. Серия Лаймана. Обобщенная формула Бальмера.
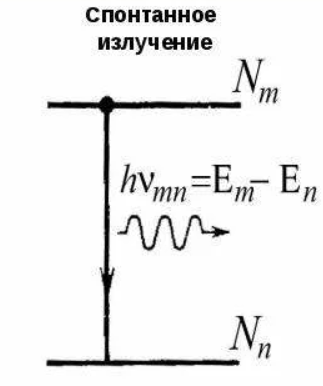
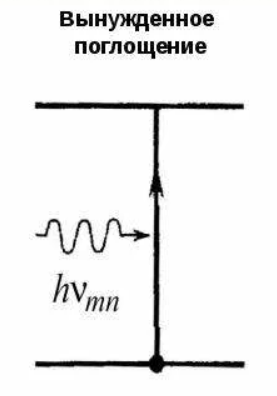
Поглощение излучения. Если атом находится в основном состоянии, то под действием внешнего излучения может осуществиться вынужденные переход в возбуждённое состояние, приводящий к поглощению излучения.
Спонтанное излучение. Атом из возбуждённого состояния может спонтанно перейти в основное состояние, испуская при этом фотон с энергией:
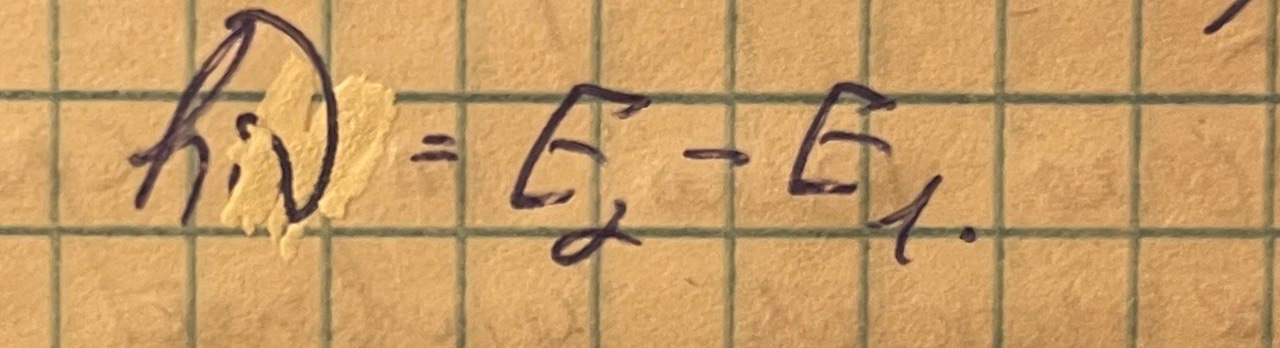
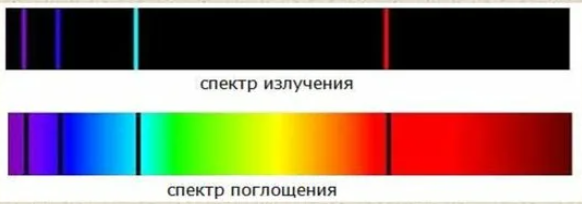
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода. Линии в спектрах атомов располагаются не беспорядочно, а объединяются в группы или, как их ещё называют, серии линий.
Атом может испускать фотоны только с фиксированными дискретными частотами, поэтому спектр испускания является линейчатым.
Спектр поглощения получается при прохождении белого света через разреженный газ. Он состоит из тёмных линий (полос поглощения), накладывающихся на непрерывный спектр источника света.
Швейцарский ученый И. Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
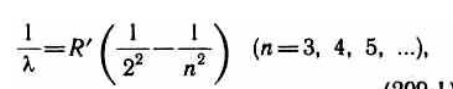
![]()
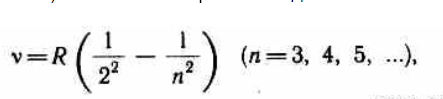
![]()
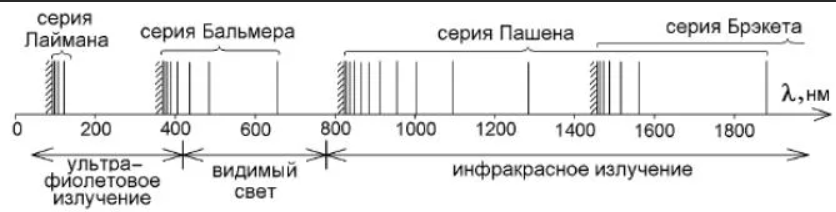
Из выражений вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии сближаются; значение n= определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
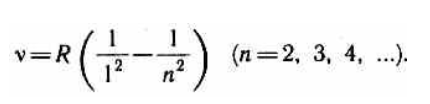
В инфракрасной области спектра были также обнаружены:
серия Пашена
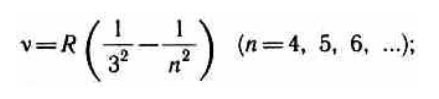
серия Брэкета
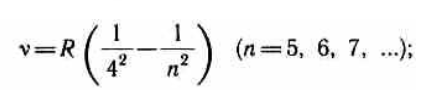
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
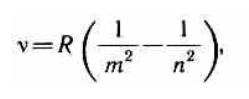
где m имеет в каждой данной серии постоянное значение, m= 1, 2, 3, 4, 5, 6 (определяет серию), n принимает целочисленные значения начиная с m+1 (определяет отдельные линии этой серии).
Рентгеновское излучение. Устройство рентгеновской трубки. Спектр рентгеновского излучения. Закон Мозли.
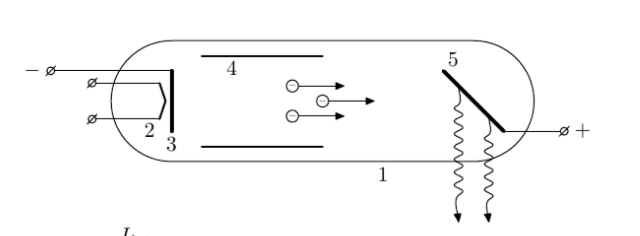
Электроны, испускаемые нагретой проволокой (катодом) в результате термоэлектронной эмиссии в вакуумной трубке, ускоряются высоким напряжением. При соударении электронов с поверхностью анода испускается рентгеновское излучение (тормозное рентгеновское излучение).
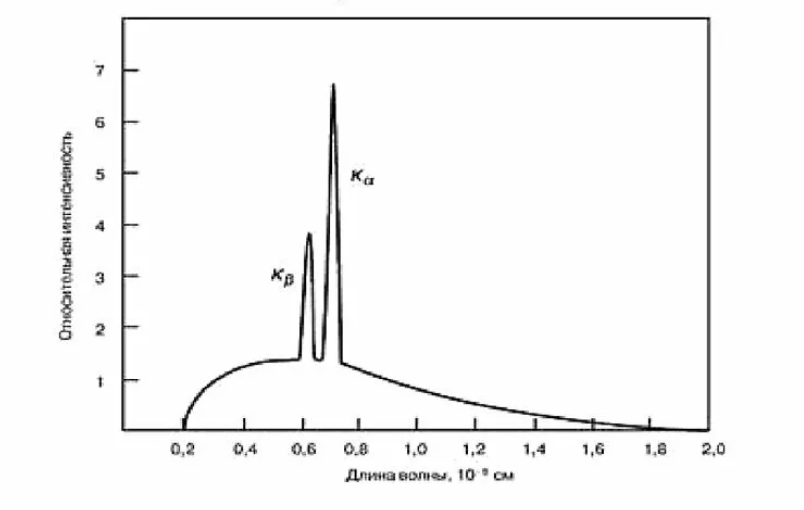
При обычном способе получения рентгеновского излучения, например, с помощью рентгеновских трубок, получают широкий диапазон длин волн, который называют рентгеновским спектром, который состоит из тормозной и характеристической составляющих.
Тормозное излучение имеет широкий непрерывный спектр, появление которого вызвано торможением электронов на материале анода. Мощность тормозного рентгеновского излучения P зависит от порядкового атомного номера материала анода Z, силы тока I, протекающего через трубку, квадрата приложенного напряжения U, и выражается формулой:
![]()
![]()
Коэффициент полезного действия трубки не более 1%.
Другой особенностью рентгеновского спектра является наличие отчетливо выраженных пиков характеристического излучения.
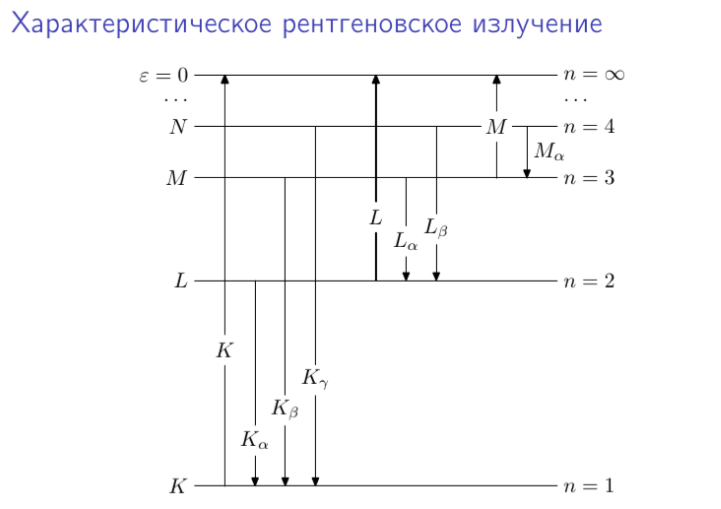
Как известно, атомы состоят из ядер, окруженных электронами, энергии которых имеют дискретные значения. Энергетические уровни электронов сгруппированы по электронным оболочкам, которые обозначаются символами K, L, M и т.д.
Когда налетающий электрон сталкивается с одним из электронов, находящимся, например, на K-оболочке, он выбивает его. Опустевшее место занимает электрон с другой L- или M-оболочки, которой соответствует большая энергия. В этом случае возникает Кα излучение, а во втором Кβ излучение характеристического спектра.
Поскольку электроны оболочек имеют дискретные значения энергии, возникающие рентгеновские фотоны тоже обладают дискретным спектром. Этому соответствуют острые пики для определенных длин волн, конкретные значения которых зависят от атомного номера элементов входящих в состав материала мишени.
Закон Мозли
Закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером. Экспериментально установлен английским физиком Генри Мозли в 1913 году.
Квадратный корень частоты характеристического рентгеновского излучения линейно зависит от атомного номера Z:
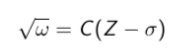

Электрон при переходе между уровнями находится в поле ядра, притяжение которого ослаблено экранирующим действием окружающих его электронов. Это экранирующее действие учитывается вычитанием из зарядового числа постоянной экранирования (чем ближе к ядру, тем меньше электронов мешают).
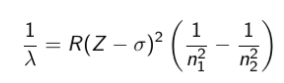
![]()
