
ответы на детские инфекции 2022-2023
.pdf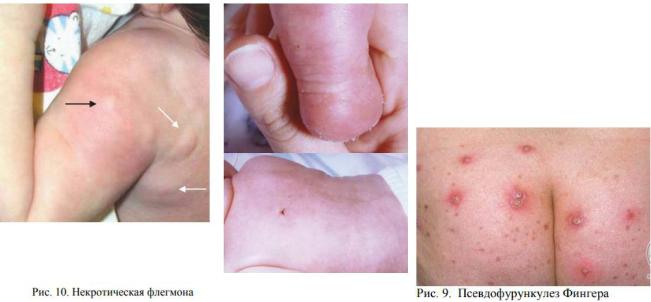
Узлы вскрываются с выделением полужидкого гнойного содержимого с примесью крови. Процесс заканчивается рубцеванием. Чаще всего множественные абсцессы возникают на местах соприкосновения тела с кроваткой (область затылка, спины, ягодиц, бедер). При генерализации, когда образуется несколько десятков узлов, процесс может захватывать кожу груди, живота. Обычно общее состояние детей удовлетворительное, температура повышается редко. Однако у истощенных детей могут наступать инфекционные осложнения, вплоть до сепсиса. В этих случаях высыпания появляются приступообразно, сопровождаясь повышением температуры, лейкоцитозом, язвочки долго не рубцуются. Перипорит следует дифференцировать с фолликулитами, при которых всегда имеется связь с волосяным фолликулом и в центре пустулы часто виден волос.
Инфекционные заболевания пупочной ранки Возбудителями омфалитов являются различные патогенные и условно-патогенные микроорганизмы. В структуре локальных гнойно-воспалительных заболеваний 10–15 лет назад отмечалось увеличение удельного веса грамотрицательных возбудителей, однако в последние годы вновь возросло количество грамположительных агентов. У недоношенных детей, по многочисленным исследованиям, остается характерным микст-инфицирование. У 85 % новорожденных отмечается колонизация области пупочной ранки уже к 3-му дню жизни.
Клинически омфалиты можно подразделить на следующие формы:
Катаральный омфалит — характеризуется наличием серозного отделяемого из пупочной ранки и замедлением ее эпителизации.
Гнойный омфалит — характеризуется наличием гнойного отделяемого из пупочной ранки, отеком и гиперемией пупочного кольца.
Флегмонозный омфалит — возникает в результате распространения воспалительного процесса на околопупочную область, вследствие чего он выбухает над поверхностью передней брюшной стенки. Гиперемия кожи вокруг пупка, расширение сосудов передней брюшной стенки (усиление венозной сети), присоединение лимфангоита. Состояние больного нарушено.
Некротический омфалит — осложнение флегмонозной формы омфалита с присоединением некроза передней брюшной стенки. Дифференциальная диагностика необходима при длительно мокнущей пупочной ранке для исключения свищей урахуса и желточного протока.
Терапия При катаральном и изолированном гнойном омфалите, как правило, достаточно местной терапии — обработка пупочной ранки перекисью водорода с последующим прижиганием спиртовыми растворами анилиновых красителей, либо антибактериальной присыпкой, содержащей бацитрацин и неомицин (банеоцин). При флегмонозной и некротической формах омфалита, кроме местной санации пупочной ранки с применением повязок с гипертоническими растворами и хирургической обработкой, показана системная антибактериальная терапия.
30. Цитомегаловирусная инфекция у новорожденного. Клиника, варианты течения, диагностика,
лечение, прогноз
Врожденная ЦМВИ у части детей проявляется сразу после рождения или в течение первых трех недель жизни ребенка. Первыми признаками болезни являются низкая оценка по шкале Апгар, низкая масса тела, лихорадка, интоксикация, геморрагический синдром, судороги, гепато-и спленомегалия, анемия, синдром дыхательных расстройств, т.е. характеризуется большим полиморфизмом клинических проявлений.
В периоде новорожденности у подавляющей части больных имеется манифестная неврологическая симптоматика, в основе которой могут быть пороки развития головного мозга как проявление ЦМВфетопатий: микроцефалия, микрогирия, макрогирия либо специфический воспалительный процесс (ЦМВ энцефалит), который встречается в 3-8% случаев генерализованных форм, либо нарушения церебральной гемодинамики за счет развития эксудатино-пролиферативных васкулитов и гипоксии. Очаги размягчения мозговой ткани в дальнейшем подвергаются обызвествлению. Как правило, кальцификаты имеют околожелудочковое расположение. Угнетение рефлексов новорожденных, нарушения мышечного тонуса, иногда расстройства актов сосания и глотания наряду с признаками поражения черепно-мозговых нервов (косоглазие, нистагм, асимметрия мимической мускулатуры) – все это может выявляться в первые дни с момента рождения. Однако, нередко дети с врожденной ЦМВИ при рождении могут выглядеть здоровыми, а симптомы болезни, включая нарушения слуха, проявляются в последующие после рождения месяцы. Тем не менее, маркеры инфекции позволяют выявить заболевание сразу же после рождения (анти-ЦМВ IgM и IgG в крови, антиген ЦМВ в крови и моче).
При интранатальном инфицировании признаки ЦМВ-поражения ЦНС, как правило, отсутствуют. Но через 1-2 месяца появляется беспокойство, вялость, адинамия, сонливость, срыгивания, рвота. Развивается гидроцефалия или микроцефалия, спастические парезы. Может возникать хориоретинит, катаракта, атрофия зрительного нерва.
Течение ЦМВ-поражений ЦНС отличается от энцефалопатий гипоксического и травматического генеза более медленным восстановлением, большей частотой резидуальных явлений.
Кроме поражения ЦНС врожденная ЦМВ-инфекция может проявляться гепатитом, для которого характерна желтуха, увеличение печени, признаки холестаза. Желтуха может начинаться и на второй неделе жизни. Интенсивность ее нарастает в течение нескольких дней и держится 1-2 мес, приобретая иногда волнообразное течение. В генезе желтухи можно выделить три механизма: гемолитические свойства ЦМВ, поражение гепатоцитов и внутрипеченочный холестаз за счет развития облитерирующего холангита. Селезенка может увеличиваться незначительно и выступать на 1-2 см из-под края реберной дуги, оставаясь при этом мягкой и эластичной. В биохимических показателях обычно отмечается повышение уровня общего билирубина, преимущественно за счет прямой фракции, с последующим увеличением непрямой, умеренно выраженная ферментемия, высокие значения ГГТ, щелочной фосфатазы, что свидетельствует о внутрипеченочном холестазе. Врожденный ЦМВ гепатит может протекать как хронический гепатит с исходом в портальный фиброз печени.
Одним из наиболее частых проявлений врожденной инфекции является интерстициальная пневмония, которая обычно сопровождается бронхообструктивным синдромом в результате поражения мелких бронхов, бронхиол с развитием перибронхита. Поражаются альвеоциты, эпителий бронхиол, Наряду с цитомегалическим метаморфозом обнаруживаются неспецифические изменения в легочных сосудах, вокруг которых формируются муфтообразные лимфомоноцитарные инфильтраты. Васкулиты часто являются основой для тромбообразования. Симптомы поражения легких могут возникнуть в первые дни или спустя неделю. Обычно температура не повышается выше субфебрильной, кашель, одышка, как правило, не сопровождаются аускультативными проявлениями со стороны легких.
Поражение органов мочевыделительной системы часто проявляется аномалиями их развития, которые не всегда сопровождается появлением клинических симптомов в периоде новорожденности. Очаговый интерстициальный ЦМВ нефрит протекает с микропротеинурией, микрогематрурией.

В большинстве случаев (80-85%) ЦМВИ в неонатальном периоде протекает без клинических проявлений – скрытый цитомегаловирусный синдром, в результате которого в более поздние периоды могут выявляться хориоретинит с атрофией зрительных нервов, нарушение речи, глухота, задержка психомоторного развития, малая мозговая дисфункция, снижение интеллекта.
Поражение кожи при врожденной ЦМВИ чаще проявляется петехиальной сыпью за счет поражения эндотелия капилляров дермы или тромбоцитопенической пурпурой.
Врожденные цитомегаловирусные увеиты, как правило, выявляются у детей с тяжелыми поражениями ЦНС в виде микроцефалии и наличии кальцификатов головного мозга, расположенных перивентрикуляроно.
Таким образом, клинические проявления врожденной ЦМВ чрезвычайно многообразны, что затрудняет своевременную диагностику и требует дифференциального диагноза с рядом инфекционных эмбрио- и фетопатий, таких как краснуха, листериоз, токсоплазмоз, а также гемолитической болезнью новорожденных, сепсисом новорожденных, врожденным сифилисом. Исходы врожденной ЦМВИ у выживших детей могут проявляться отставанием в физическом и психомоторном развитии, развитием ДЦП, микрои гидроцефалии, эпилепсии, нейросенсорной тугоухости, энуреза, хронического гепатита и хронического интерстициального нефрита.
Приобретенные формы ЦМВИ
Латентная форма, по всей вероятности, наиболее частая, хотя и не регистрируется, возникает у иммунокомпетентных лиц. Отсутствие каких-либо клинических проявлений приводит к тому, что диагноз ставится только на основании случайной или целенаправленной индикации маркеров возбудителя (ДНК вируса при ПЦР) и наличии специфического антительного ответа. Латентная форма на фоне снижения иммунитета может переходить в манифестные.
Манифестные формы острой приобретенной ЦМВИ могут быть локализованными и генерализованными и чаще протекают без поражения ЦНС. Но в отдельных случаях регистрируются поражения как центральной, так и периферической нервной системы.
Главными проявлениями локализованной формы являются симптомы поражения слюнных желез (сиалоаденит), чаще околоушных, реже – подчелюстных и подъязычной. Увеличение размеров слюнных желез без четких контуров и умеренной интоксикацией напоминает эпидемический паротит.
Мононуклеозная форма начинается остро с подъема температуры тела и появления симптомов интоксикации (снижение аппетита, вялость, адинамия, головная боль). Катаральные явления со стороны верхних дыхательных путей могут дополнять клинику начального периода. Среди главных симптомов следует отметить увеличение задне- и переднешейных лимфатических узлов, а так же подчелюстных, которые могут сопровождаться гепатомегалией ( край печени выступает на 2-3 см из-под реберной дуги, мягкой консистенции). В гемограмме лейкоцитоз, нейтрофилез и увеличение числа атипичных мононуклеаров. При биохимическом обследовании могут обнаруживать признаки гепатита в виде цитолитического синдрома, увеличения уровня холестерина, щелочной фосфатазы, β –липопротеидов. Заболевание протекает доброкачественно, заканчивается клиническим выздоровлением, хотя вирус может длительно персистировать.
Более редкими проявлениями генерализованной ЦМВИ, возникающей у иммунокомпроментированных лиц, могут быть поражение легких в виде интерстициальной пневмонии, почек (протеинурия), желудочнокишечного тракта по типу гастроэнтерита.
Диагностика. Лабораторная диагностика ЦМВИ опирается на комплекс методов, позволяющих верифицировать этиологический агент (выделение вируса, его генома, антигенов), определить наличие маркеров иммунного ответа (специфические антитела), оценить остроту инфекционного процесса.
Комплекс методов диагностики включает:

1)УЗИ, доплерометрию с целью выявления патологии беременности (многоводие, маловодие, задержка внутриутробного развития) и плода (микроцефалия, гидроцефалия, внутричерепные кальцинаты, водянка. гепатои спленомегалия). Сроки проведения УЗИ-скрининга: 1-й - до 15 недель, 2-й – 18-24 неделя, 3-й – 32-34 неделя. Доплерометрия плода и плаценты в сроки: 18-24 неделя и 32-34 неделя. Антенатальная кардиотокография – функциональная оценка плода – после 32 недели беременности;
2)индикация маркеров ЦМВ с помощью молекулярно-биологических методов – определение ДНК вируса в биологических субстратах (моча, слюна, выделения из цервикального канала) методом ПЦР;
3)определение у беременных специфических антител к ЦМВ – иммуноглобулинов класса М и G с помощью ИФА;
4)при наличии ультразвуковых признаков поражения плода целесообразно провести амниоцентез, кордоцентез для индикации специфических антител к вирусу в крови плода.
Постнатальная диагностика ЦМВИ у новорожденных проводится при указании на первичную или вторичную ЦМВИ у матери, клинических признаках внутриутробной инфекции (геморрагический синдром, гемолитическая анемия, стойкая гипербилирубинемия, гепато-спленомегалия, интерстициальная пневмония, гипотрофия, микроцефалия, гидроцефалия, внутричерепные кальцинаты, врожденные пороки развития и т.д.). отягощенном акушерско-гинекологическом анамнезе матери (выкидыши, мертворождения). Критерии активности внутриутробной ЦМВИ у новорожденных детей в раннем неонатальном периоде следующие:
1)обнаружение ДНК вируса в крови и ликворе
2)выявление в крови, в пуповинной крови анти-ЦМВ IgM и низкоавидных анти-ЦМВ IgG с нарастанием титра в динамике;
3)сопоставление уровня специфических антител у ребенка с материнскими титрами для правильной трактовки результатов.
Присутствие специфических IgM будет свидетельствовать о острой (первичной) инфекции, а IgG – о хроническом процессе. Наличие только IgG указывает на ранее перенесенную инфекцию. Специфические анти-ЦМВ IgG, выявлемые у новорожденных без клинических проявлений, следует рассматривать как материнские транспланцентарные антитела (при документальном подтверждении об их обнаружении у матери). При динамическом обследовании уровень их должен снижаться
Лечение врожденной ЦМВИ зависит от клинической формы и тяжести болезни и включает комплекс специфических и неспецифических методов терапии. Специфическое лечение проводится только после верификации диагноза, подтвержденного результатами клинического, вирусологического, иммунологического обследования.
При тяжелой генерализованной форме, сопровождающейся поражением ЦНС, пневмонией, назначается следующая комбинация: специфический анти-ЦМВ-иммуноглобуллин (Цитотект, 10% раствор, готовый к применению) в дозе 2 мл/кг внутривенно капельно через 2 дня до исчезновения клиники (3-5 введений) и противовирусный препарат ганцикловир (цимевен) 5 мг/кг в сутки внутривенно в течение 2-3 недель. Более длительный прием невозможен из-за высокой токсичности.
При легкой и средне-тяжелой форме ЦМВИ проводится лечение рекомбинантными интерферонами – вифероном, рофероном А и др. в течение 1 месяца. При наличии признаков активации (анти-ЦМВ IgM, ЦМВантиген в крови) противорецидивное лечение также проводится интерферонами по аналогичной схеме, что и в остром периоде.
При тяжелых генерализованных формах болезни проводится инфузионная терапия с целью уменьшения явлений инфекционного токсикоза по общепринятым стандартам. Антибактериальное лечение начинается при угрозе возникновения осложнений, наслоении бактериальной инфекции. В качестве стартовых могут быть цефалоспорины 2-3 поколения, макролиды, аминогликозиды в дозах, соответствующих возрасту.
Больные с ЦМВИ должны получать физиологическое питание с витаминной и микронутриентной поддержкой.

31. Врожденная краснуха. Клиника, варианты течения, диагностика, лечение, прогноз
Синдром врожденной краснухи в виде триады наиболее часто встречающихся аномалий развития - катаракты, пороков сердца и глухоты (классический синдром Грегга). Позднее были описаны поражения ЦНС с умственной отсталостью, микрофтальмией, низкой массой тела при рождении, дерматитом и др. Поражение мозга плода вирусом краснухи нередко ведет к развитию хронического менингоэнцефалита, но клинические проявления у новорожденного могут быть выражены очень слабо в виде сонливости, вялости или, наоборот, повышенной возбудимости. Иногда возникают судороги. В этих случаях постепенно выявляется микроцефалия, помутнение роговицы, катаракта, глаукома.
Из ранних неонатальных проявлений врожденной краснухи характерны множественные геморрагии, сопровождающие тромбоцитопению. Высыпания держатся 1-2 нед, иногдадольше. Бывают гепатиты с желтухой, увеличение селезенки, гемолитическая анемия, интерстициальная пневмония, поражение трубчатых костей (при рентгеновском исследовании выявляются участки разрежения и уплотнения костей).
Реже встречаются пороки развития скелета и черепа, органов мочеполовой, пищеварительной системы и др. Данные о частоте аномалий плода при краснухе у матери, приводимые в литературе, весьма разноречивы. Несомненно, что их частота связана со сроком беременности, на котором женщина заболела краснухой. Так, установлено, что аномалии развития зависят от времени воздействия вируса на плод: он наиболее уязвим в первые 3 мес гестации.
Кроме того, при краснухе беременность нередко заканчивается выкидышем или мертворождением. Диагноз врожденной краснухи ставят на основании анализа данных клинико-эпидемиологических и
лабораторных исследований.
Клинический диагноз синдрома врожденной краснухи (при отсутствии лабораторного подтверждения) основывается на выявлении двух любых основных симптомов или сочетания одного из основных симптомов и еще одного из дополнительного симптома.
Основные симптомы: |
|
- катаракта или врожденная глаукома; |
- глухота; |
- врожденный порок сердца; |
- пигментная ретинопатия. |
Дополнительные симптомы: |
|
- пурпура; |
- менингоэнцефалит; |
- спленомегалия; |
- изменения костей; |
- желтуха; |
- отставание в умственном развитии |
- микроцефалия; |
|
Лабораторная диагностика заключается в определении IgM-антител к вирусу краснухи в сыворотке крови ребенка, обнаружении вируса краснухи в эпителии слизистых, для чего исследуются носоглоточные мазки и моча.
Лабораторным подтверждением диагноза является:
-в первом полугодии жизни ребенка - обнаружение вируса краснухи, высокий уровень антител к вирусу, специфические IgM;
-во втором полугодии - обнаружение высоких уровней вирусспецифических антител и низкоавидных IgG антител к вирусу краснухи.
У детей с синдромом врожденной краснухи (СВК) при рождении или вскоре после него и, как минимум, в течение первых трех месяцев жизни обнаруживаются специфические для краснухи IgM.
Если тест на IgM антитела при рождении отрицательный, но присутствует подозрение на краснуху, следует в ближайшее время повторить тест.
При наличии СВК результат теста на IgM антитела будет положительным не менее чем у 85% младенцев в период между 3 и 6 месяцами жизни, а иногда в течение периода до 18 месяцев.
Лечение детей с врожденной краснухой должно осуществляться в стационаре. Лечение пороков развития проводят в профильных стационарах, где осуществляются их коррекция и реабилитационные меры.В зависимости от активности текущей инфекции лечение проводят препаратами рекомбинантного интерферона и интерфероногенами. Проводится симптоматическая терапия.
Прогноз обусловлен тяжестью состояния. Пороки сердца часто могут быть исправлены. Повреждение нервной системы является постоянным.
32.Вакцинопрофилактика. Иммунологические основы вакцинации. Первичный и вторичный иммунный ответ. Виды вакцин. Национальный календарь профилактических прививок.
Региональный календарь профилактических прививок. Постэкспозиционная специфическая профилактика.
+
33.Законодательные основы иммунопрофилактики. Особенности Национального календаря
России и календаря прививок Свердловской области.
Вакцинопрофилактика - искусственное воспроизведение иммунного ответа путем введения специфического антигена с целью создания невосприимчивости к инфекции
В ответ на введение антигена вакцины в организме закономерно происходит последовательная поэтапная активация иммунной системы в следующем порядке:
•захват антигена макрофагами;
•презентация информации об антигене макрофагами Т-лимфоцитам;
•пролиферация и дифференцировка Т-клеток с появлением регуляторных хелперов и супрессоров, цитотоксических Т-клеток, клеток памяти;
•активация В-клеток с превращением их в плазматические антителопродуцирующие клетки;
•формирование иммунной памяти;
•продукция специфических антител;
•снижение уровня антител.
При введении вакцины развивается иммунная реакция, в которой условно можно выделить 3 фазы. 1-я фаза охватывает время с момента введения антигена до формирования антител продуцирующих
клеток. Продолжительность этой фазы составляет несколько суток.
2-я фаза (фаза роста) - это собственно продукция антител и иммунокомпетентных клеток в крови вплоть до максимального уровня в соответствии с силой антигенного раздражителя. Продолжительность данной фазы бывает различной - от 4 дней до 4 нед, что важно для проведения постэкспозиционной профилактики. Так, быстрое повышение уровня антител в ответ на введение вакцин против кори и ветряной оспы позволяет использовать их для профилактики этих инфекций в течение первых 3 дней после контакта,
при этом достигается 90% защитный эффект. При других инфекциях, когда период нарастания уровня антител до защитного превышает инкубационный период болезни, постэкспозиционная профилактика оказывается неэффективной. Например, при коклюше фаза роста продолжается 2 нед.
После достижения наивысшей интенсивности иммунного ответа начинается 3-я фаза, когда концентрация антител в крови снижается сначала быстро, а затем медленно, в течение многих месяцев (шигеллез, сальмонеллез и др.) или многих лет (корь, эпидемический паротит и др.).
Имеются существенные различия в иммунной реакции на введение живых и инактивированных вакцин, на первичное и повторное введение вакцинных антигенов. При первичном введении (вакцинация) живой вирусной вакцины в неиммунном организме вакцинный штамм возбудителя попадает в тропный орган, где происходит его репродукция с последующим выходом в свободную циркуляцию и включением цепи иммунных реакций, идентичных таковым при естественной инфекции. В связи с этим реакция на введение живых вакцин особенно часто возникает по истечении как бы инкубационного периода и проявляется ослабленным симптомокомплексом естественной инфекции (увеличение затылочных лимфатических узлов после введения краснушной вакцины, околоушных слюнных желез после введения паротитной вакцины и т. д.). Иммунный ответ в этом случае обусловливает появление в крови антител класса IgM с последующим переключением на синтез антител класса IgG. В ходе такого взаимодействия формируются и клетки иммунной памяти. При первом введении инактивированных вакцин (АКДС, АДС) также развивается первичный иммунный ответ, но с низкой и непродолжительной продукцией антител при формировании клеток памяти, что требует повторного введения. Инактивированные вакцины обычно вводят троекратно с интервалом 1-2 мес и с ревакцинацией через 1 год после последней вакцинации. При этом формируется грундиммунитет. Впоследствии ревакцинацию можно проводить с уменьшенной антигенной нагрузкой (АДС- М), в результате чего развивается так называемый бустерный эффект за счет включения клеток памяти.
Живые вирусные вакцины, действие которых рассчитано на размножение вируса в организме привитого, создают стойкий иммунитет уже после первого введения. Повторная вакцинация позволяет привить от инфекций тех лиц, у которых 1-я доза вакцины по той или иной причине не привела к выработке иммунитета.
Иммунная система ребенка адекватно отвечает и на одновременное введение нескольких антигенов, при этом продукция антител происходит так же, как при раздельном их введении. Более того, некоторые вакцины при одновременном введении способны оказывать адъювантное действие, т. е. усиливать иммунный ответ на другие антигены (например, адъювантное действие оказывает коклюшный антиген). Наконец, доказана безопасность ассоциированных вакцин. В связи с этим ВОЗ считает возможным одновременное введение всех вакцин, необходимых ребенку по возрасту.
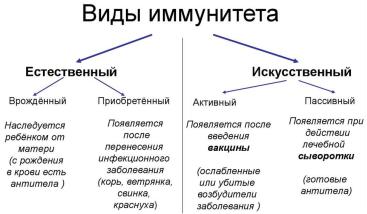
Приобретенный антиинфекционный иммунитет является типоспецифическим, т. е. предохраняет от заболеваний, вызываемых конкретными видами микроорганизмов. Он может быть антитоксическим, антибактериальным, противовирусным к грибам, паразитам и гельминтам.
Различают естественный (врожденный) и искусственный, активный и пассивный иммунитет после перенесенных заболеваний, искусственный после вакцинации. Антитела класса IgG, передаваемые от матери плоду, обеспечивают пассивно приобретенный естественный иммунитет у детей 1-го года жизни. С материнским молоком ребенок получает также секреторные IgA и IgM. Пассивно приобретенный искусственный иммунитет возникает в результате введения готовых антител в виде специфических иммуноглобулинов (противокоревой, противогриппозный, антистафилококковый и др.) или после введения сыворотки, плазмы и крови переболевших. Пассивный иммунитет развивается быстрее, чем активный, что приобретает особое значение при постэкспозиционной профилактике ряда инфекций (гепатита В, ветряной оспы и др.), в том числе у лиц, получающих иммуносупрессивную терапию.
А. Первичный иммунный ответ развивается после первого контакта с антигеном. Для него характерны следующие особенности.
– Наличие латентного периода (2-3 дня после первого контакта с антигеном). Это связано с отсутствием лимфоцитов памяти. Все клоны лимфоцитов находятся в фазе покоя G0. При поступлении в организм антигена вначале синтезируются IgM (антитела выявляются через 2-3 суток), а затем – IgG (пик приходится на 10-14 сутки, причем эти антитела могут сохранятся в низком
титре в течение всей жизни). Отмечается также небольшое увеличение уровней IgA, IgE и IgD. Образуются комплексы антиген-антитело.
–Уже с третьих суток появляются иммунные Т-лимфоциты.
–Первичный иммунный ответ затихает через 2-3 недели после стимуляции антигеном.
–Появляются лимфоциты памяти и может долго поддерживаться следовой уровень IgG.
Б. Вторичный иммунный ответ развивается после повторного контакта с тем же антигеном и имеет следующие особенности.
–В организме уже имеются долгоживущие клоны антигенспецифических Т- и В-лимфоцитов памяти, ответственных за «память» об антигене и способных к рециркуляции, они находятся не в покое, а в фазе G1.
–Стимуляция синтеза антител и иммунных Т-лимфоцитов наступает через 1-3 дня.
–Т-клетки памяти быстро превращаются в эффекторные.
–Количество антител сразу резко увеличивается, причем синтезируются иммуноглобулины высокой специфичности – IgG.
–Чем больше контактов с антигенами имело место в данном организме, тем выше будет концентрация и специфичность (аффинность) антител.
КЛАССИФИКАЦИЯ ВАКЦИН Все вакцины делят на инактивированные и живые.
Различают следующие инактивированные вакцины.
Цельноклеточные (корпускулярные) вакцины представляют собой микроорганизмы, инактивированные путем химического (обработка формалином, ацетоном, спиртом) или физического (нагревание, ультрафиолетовое облучение и др.) воздействия или комбинацией нескольких факторов. Такие вакцины обладают полным набором иммунитетформирующих антигенов, включая реактогенные липиды. Примерами цельноклеточных вакцин являются коклюшная (компонент АКДС), брюшнотифозная, лептоспирозная, гриппозные цельновирионные и ряд других препаратов. Помимо цельноклеточных, в практике используют дезинтегрированные или расщепленные препараты (сплит-вакцины), в которых структурные компоненты вириона разъединены с помощью детергентов, и также удален липидный слой. Дезинтегрированными вакцинами являются вакцины против гриппа «Ваксигрипп», «Флюарикс», «Бегривак» и др.
К последнему поколению можно отнести субъединичные вирусные вакцины, содержащие отдельные структурные компоненты вируса, например, субъединичные гриппозные вакцины «Гриппол» и «Инфлювак», состоящие из очищенных поверхностных антигенов гемагглютинина и нейраминидазы. Субъединичные вакцины отличает низкая реактогенность.
Химические вакцины представляют собой извлеченные из микробной клетки антигенные компоненты, обладающие протективной активностью и обеспечивающие развитие надежного иммунитета. Для их приготовления используют различные физикохимические методики. Такими вакцинами являются полисахаридные менингококковые групп А и С, гемофилюс инфлюэнца типа B, пневмококковая, брюшнотифозная - Viантиген брюшнотифозных бактерий и др. Поскольку бактериальные полисахариды - это тимуснезависимые антигены, для формирования Т-клеточной иммунной памяти используется их конъюгация с белковым носителем (менингококковым, дифтерийным, столбнячным анатоксинами) или с белком самого
микроорганизма, например, наружной оболочкой пневмококка. Химические вакцины имеют относительно низкую реактогенность.
Рекомбинантные вакцины. Для их производства применяют рекомбинантную технологию. Участок гена микроорганизма, кодирующий синтез протективного антигена, встраивают в ДНК клеток-продуцентов (дрожжи, эшерихии коли и др.), которые, размножаясь, продуцируют данный антиген. Протективный белок выделяют из клетокпродуцентов путем разрушения последних и подвергают очистке с помощью физических
ихимических методов. В результате полученный препарат освобождается от ДНК клетокпродуцентов и содержит лишь их следовое количество.
Для создания полноценного иммунитета обычно необходимо двукратное или троекратное введение инактивированных вакцин. Развивающийся после этого иммунитет относительно кратковременный, для поддержания его на высоком уровне требуются ревакцинации.
Анатоксиновые вакцины представляют собой бактериальные экзотоксины, обезвреженные длительным воздействием формалина при повышенной температуре. Такая технология получения анатоксинов сохраняет их антигенные и иммуногенные свойства и делает невозможной реверсию их токсичности. В процессе производства анатоксины подвергаются очистке от балластных веществ (питательной среды, других продуктов метаболизма и распада микробной клетки) и концентрации. Эти процедуры снижают их реактогенность и позволяют использовать для иммунизации небольшие объемы препаратов.
Анатоксины выпускают в виде монопрепаратов (дифтерийный, столбнячный, стафилококковый и др.)
иассоциированных препаратов (дифтерийно-столбнячный, ботулинический трианатоксин).
Впоследние годы разработан препарат коклюшного анатоксина, который в ряде зарубежных стран вошел в число компонентов бесклеточной коклюшной вакцины. В России коклюшный анатоксин рекомендован к практическому применению в виде монопрепарата для вакцинации доноров, чья сыворотка (плазма) используется для изготовления коклюшного антитоксического иммуноглобулина человека, предназначенного для лечения тяжелых форм коклюша. Для достижения напряженного антитоксического иммунитета препараты анатоксинов вводят, как правило, дважды с последующей ревакцинацией. Их профилактическая эффективность достигает 95-100% и сохраняется в течение нескольких лет. Анатоксины обеспечивают сохранение в организме привитого стойкой иммунной памяти, при их повторном введении людям, полноценно привитым 10 лет назад и более, происходит быстрое образование специфических антител в высоких титрах. Анатоксины имеют относительно низкую реактогенность, что позволяет свести к минимуму перечень противопоказаний. Живые вакцины изготавливаются на основе аттенуированных штаммов вирусов и бактерий со стойко закрепленной авирулентностью. Будучи лишенными способности вызывать инфекционную болезнь, они сохраняют способность к размножению в организме вакцинированного. Развивающаяся вследствие этого вакцинная инфекция протекает у большинства привитых без выраженных клинических симптомов, но приводит к формированию, как правило, прочного и длительного иммунитета к патогенным штаммам микроорганизмов. Вакцинные штаммы, применяемые в производстве живых вакцин, получают путем выделения аттенуированных мутантов от больных (вакцинный штамм вируса паротита Джерил Линн) или из внешней среды путем селекции вакцинных клонов (штамм СТИ сибирской язвы) и длительного пассирования в организме экспериментальных животных и куриных эмбрионах (штамм 17D вируса желтой лихорадки). Живые вакцины имеют ряд преимуществ перед инактивированными. Живые вакцины создают прочный и длительный иммунитет, по напряженности приближающийся к постинфекционному. Так, после однократного введения коревой, краснушной и паротитной вакцин продолжительность иммунитета достигает 20 лет, вакцины желтой лихорадки - 10 лет и т. д. Этим определяются и значительные интервалы между первой и последующей прививками данными препаратами. К недостаткам живых вакцин можно отнести их высокую реактивность и более широкий спектр противопоказаний. Живые вакцины, за исключением полиомиелитной, выпускаются в сухом лиофилизированном виде, что обеспечивает достаточно длительный (более 1 года) срок годности. В отличие от инактивированных живые вакцины не содержат консерванта, но в них имеется незначительное количество антибиотиков.
Как живые, так и инактивированные вакцины чаще используют в виде монопрепаратов. Комплексные (ассоциированные) вакцины обычно разработаны на основе существующих
монопрепаратов. Использование ассоциированных вакцин, число визитов к врачу, необходимое при раздельной иммунизации, обеспечивают более высокий (на 20%) охват детей прививками в декретируемые

сроки. Помимо этого, при использовании ассоциированных препаратов в значительной степени снижаются травмирование ребенка и нагрузка на медицинский персонал.
Наиболее известными ассоциированными препаратами, выпускаемыми в России, являются АКДСвакцина, живая 3-валентная полиомиелитная вакцина, менингококковая А+С вакцина, а также АДС- и АДСМ анатоксины, Бубо-М, Бубо-Кок. Среди зарубежных зарегистрированных в России вакцин широко известны «Тетракок 05» - вакцина против коклюша, дифтерии, столбняка и полиомиелита; «Д.Т. Вакс» - вакцина против дифтерии и столбняка; «Имовакс Д.т.полио» - инактивированная 3-валентная полиомиелитная 51 вакцина, приорикс и ММR-II - вакцины против кори, краснухи, эпидемического паротита; проходит регистрацию «Пент АктХИБ» - вакцина против коклюша, дифтерии, столбняка, полиомиелита и гемофильной b-инфекции. В настоящее время в ряде стран широко применяются и даже включены в календари профилактических прививок такие ассоциированные препараты, как 6-валентная вакцина, содержащая дифтерийный и столбнячный анатоксины, бесклеточную коклюшную вакцину, поверхностный антиген вируса гепатита В, конъюгированный полисахарид H. influenzae b,инактивированную полиомиелитную вакцину (входит в календарь прививок Франции); 4-валентная живая вирусная вакцина против кори, краснухи, эпидемического паротита и ветряной оспы; комбинированная вакцина против гепатита А и В и ряд других препаратов. В последние годы в России прошли лицензирование комбинированные вакцины против гепатита В, дифтерии и столбняка (Бубо-М) и комбинированная вакцина против гепатита В, дифтерии, коклюша и столбняка (БубоКок).
Форсифицированные вакцины представляют собой конъюгацию иммунизирующего антигена с синтетическим носителем, многократно усиливающим иммунный ответ. Первым удачным примером такой вакцины является отечественная гриппозная полимерсубъединичная вакцина гриппол, в состав которой вошел иммуностимулятор полиоксидоний. Это позволило снизить в 3 раза дозу гемагглютининов в каждом из 3 вакцинных штаммов по сравнению с таковой в зарубежных аналогах, повысить стабильность и активность антигенов.
+пояснения календаря, догоняющая вакцинация.
Национальный календарь профилактических прививок – приказ от 6 декабря 2021 г. №1122н.
