
- •КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПбГЭТУ «ЛЭТИ»
- •ОЛИМПИАДЫ
- •Общие понятия
- •ОСНОВЫ СТРОЕНИЯ ВЕЩЕСТВА
- •Общие понятия
- •Известные к середине XIX века элементы
- •Приведение элементов в порядок
- •Приведение элементов в порядок
- •Приведение элементов в порядок
- •Периодический закон Д.И. Менделеева
- •Строение атома
- •Строение атома
- •Квантово-механическая модель атома
- •Квантово-механическая модель атома
- •Квантовые числа
- •Форма орбиталей
- •Основные принципы заполнения орбиталей электронами
- •Распределение орбиталей водородоподобного атома по энергиям
- •Основные принципы заполнения орбиталей электронами
- •Основные принципы заполнения орбиталей электронами
- •Примеры построения электронных конфигураций атомов
- •Основные характеристики атомов
- •Атомные радиусы
- •Орбитальные атомные радиусы
- •Потенциал ионизации
- •Сродство к электрону
- •Электроотрицательность по Малликену
- •Магнитный момент
- •Периодический закон Д.И. Менделеева
- •Периодический закон Д.И. Менделеева
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов

Строение атома
Атом – мельчайшая неделимая частица вещества
В 1911 г. – планетарная модель |
V век до нашей эры |
… Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома…
противоречие с классической механикой:
…при движении электрона по орбите он должен был Демокрит терять потенциальную энергию и в конце концов
"упасть" на ядро и атом должен был прекратить свое Э. Резерфорд существование…
В 1913 г. – постулаты Бора
• электрон двигается по стационарным орбитам вокруг ядра
• при нормальных условиях не поглощает и не испускает энергию
1920-е годы –
|
Л. де Бройль, В. Гейзенберг, |
Н. Бор |
Э. Шредингер, П. Дирак |
|

Строение атома
Атом – сложная электромагнитная система, включающая элементарные частицы – нуклоны (протоны, нейтроны) и электроны
10-11-10-10, м
|
Частица |
Символ |
Масса, а.е.м. |
|
Масса, г |
Заряд, e |
|
|
|
|
|
|
|
|
Протон |
1p |
1.0073 |
|
1.67·10-24 |
+1 |
|
Нейтрон |
0n |
1.0087 |
|
1.67·10-24 |
0 |
|
Электрон |
e- |
0.00055 |
|
9.1·10-28 |
-1 |
|
Позитрон |
e+ |
0.00055 |
|
9.1·10-28 |
+1 |
|
Ядро (протоны и нейтроны) – |
|
|
|||
|
определяют массу атома, заряд ядра и |
|
|
|||
|
|
|
радиоактивные свойства |
|||
10-15, м |
Электроны – определяют химические свойства |
|
||||
Химический элемент – совокупность атомов с одинаковым зарядом ядра (числом протонов, числом электронов), совпадающим с порядковым (атомным) номером в таблице Менделеева
Изотопы – разновидности атомов одного и того же химического элемента, различающиеся массовыми числами, но имеющие одинаковый заряд ядра
Устойчивость атомного ядра: |
Легкие элементы: ~ 1 |
|
«число нейтронов/число протонов» |
||
Тяжелые элементы: ~ 1.6 |
||
|

Квантово-механическая модель атома
1924 г. h
m
…волновые и корпускулярные свойства квантовой частицы фундаментальным образом взаимосвязаны…
1927 г. Л. де Бройль Принцип неопределенности
х mh
Уравнение Планка
E1 E2 h |
В. Гейзенберг |

Квантово-механическая модель атома
1926 г.
Уравнение Шрёдингера (сферической стоячей волны)
2 |
2 |
2 8 2m |
|
E U |
0 |
|
x2 |
y2 |
z2 |
h |
|
|
|
Э. Шрёдингер
2(x,y,z)
Величина, пропорциональная вероятности нахождения электрона в некотором объеме, окружающем точку с координатами x, y, z
Электронная плотность
Область пространства, в которой вероятность нахождения электрона составляет не менее 95%, называется атомной орбиталью, которая характеризуется определенной формой и расстоянием от ядра
Состояние электрона в атоме полностью определяется четырьмя квантовыми числами, три из которых (n, l, ml) характеризуют электронную орбиталь, а четвертое (ms) – собственный момент электрона
Квантовые числа
Квантовое |
Принимаемые |
Характеризуемое |
Примечание |
|
число |
значения |
свойство |
||
|
||||
|
|
|
|
|
Главное |
1, 2, 3, …, ∞ |
Энергия (E) электронного |
n=∞ - отсутствует |
|
(n) |
|
уровня. Среднее |
взаимодействие с |
|
|
|
расстояние |
ядром. E = 0 |
|
|
|
от ядра |
|
|
|
|
|
|
|
Орбитальное (l) |
0, 1, …, (n-1) |
Орбитальный момент |
Обычно используются |
|
|
Всего n значений |
количества движения – |
буквенные символы: |
|
|
для данного n |
форма орбитали |
l: 0 1 2 3 4 |
|
|
|
|
s p d f g |
|
|
|
|
|
|
Магнитное (ml) |
-l, …,0, …, +l |
Ориентация момента |
При помещении в |
|
|
Всего 2l+1 значение |
количества движения – |
магнитное поле |
|
|
для данного l |
расположение орбитали в |
орбитали с разными ml |
|
|
|
пространстве |
имеют разную энергию |
|
|
|
|
|
|
Спиновое |
±1/2 |
Ориентация собственного |
Обозначают ↑ или ↓ |
|
(ms) |
Не зависит от |
магнитного момента |
||
|
||||
|
свойств орбитали |
электрона |
|
|
|
|
|
|

Форма орбиталей
l=0 (s)
l=1 (p)
l=2 (d)
l=3 (f)
* здесь + и – знаки волновой функции
Основные принципы заполнения орбиталей электронами
Zэфф. – заряд, действующий на электрон внешнего уровня.
Этот заряд меньше, чем истинный заряд ядра, т.к. внутренние электроны экранируют внешние
1.В многоэлектронном атоме подуровни имеют различную энергию. Для одноэлектронного приближения их распределение по энергиям показано далее…
2.Зависимость энергии орбитали от заряда ядра носит сложный немонотонный характер:
•с ростом Z энергии всех орбиталей понижаются;
•в пределах одного периода разница энергий подуровней (ΔEs-p) возрастает;
•при заполнении электронами d и f орбиталей их расположение по сравнению с одноэлектронным приближением существенно изменяется
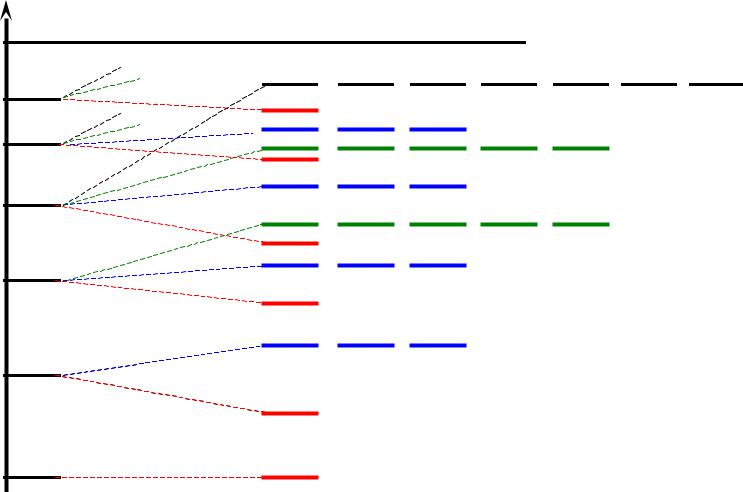
Распределение орбиталей водородоподобного атома по энергиям
E |
|
|
|
n=∞ |
|
|
|
n=6 |
6s |
4f |
|
5p |
|||
n=5 |
|
||
5s |
4d |
||
|
4p |
||
n=4 |
|
||
|
3d |
||
|
4s |
||
n=3 |
3p |
||
|
|||
3s |
|
||
|
|
||
n=2 |
|
2p |
|
|
|
||
|
2s |
|
|
n=1 |
1s |
|

Основные принципы заполнения орбиталей электронами
1.Принцип наименьшей энергии
В многоэлектронном атоме стабильной является такая конфигурация, для которой достигается минимум полной энергии.
В первую очередь заполняются орбитали с наименьшей энергией, т.е. выполняется последовательность:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<6d<5f
Энергия орбиталей увеличивается в порядке возрастания суммы квантовых чисел n+l, а при одинаковой сумме этих чисел –
в порядке возрастания главного квантового числа
(Правила Клечковского)
Основные принципы заполнения орбиталей электронами
2.Принцип запрета Паули
В атоме не существует двух электронов, состояние которых описывается одинаковым набором квантовых чисел
(n, l, ml, ms)
Следовательно на одной орбитали (она характеризуется тремя квантовыми числами (n, l, ml) может находиться не более двух электронов с
разными значениями спинового квантового числа (↑и ↓)
3.Правило Хунда
В пределах одного подуровня (т.е. на орбиталях с одним и тем же значением l) электроны распределяются так, чтобы суммарный спин (Σms) был максимален
