
- •КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПбГЭТУ «ЛЭТИ»
- •ОЛИМПИАДЫ
- •Общие понятия
- •ОСНОВЫ СТРОЕНИЯ ВЕЩЕСТВА
- •Общие понятия
- •Известные к середине XIX века элементы
- •Приведение элементов в порядок
- •Приведение элементов в порядок
- •Приведение элементов в порядок
- •Периодический закон Д.И. Менделеева
- •Строение атома
- •Строение атома
- •Квантово-механическая модель атома
- •Квантово-механическая модель атома
- •Квантовые числа
- •Форма орбиталей
- •Основные принципы заполнения орбиталей электронами
- •Распределение орбиталей водородоподобного атома по энергиям
- •Основные принципы заполнения орбиталей электронами
- •Основные принципы заполнения орбиталей электронами
- •Примеры построения электронных конфигураций атомов
- •Основные характеристики атомов
- •Атомные радиусы
- •Орбитальные атомные радиусы
- •Потенциал ионизации
- •Сродство к электрону
- •Электроотрицательность по Малликену
- •Магнитный момент
- •Периодический закон Д.И. Менделеева
- •Периодический закон Д.И. Менделеева
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов
- •Периодическая система элементов

КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПбГЭТУ «ЛЭТИ»
Курс ХИМИЯ
Лектор: Альмяшев Вячеслав Исхакович
Учебные материалы: |
http:// |
eltech.chemdm.ru/ |
|
Рекомендуемая литература:
Лебедев О.А. Конспект лекций по курсу «Химия».
СПбГЭТУ "ЛЭТИ". 2007. 250 с.
Коровин Н.В. Общая химия
осенний семестр, 2017-2018 учебный год

ОЛИМПИАДЫ
4 октября
C 17.00 до 19.30
http://technolog.edu.ru/university/
rsrolymp/item/3027.html
Общие понятия
Химия – одна из важнейших областей естествознания, изучающих окружающий нас материальный мир во всем богатстве его форм и явлений
Химия имеет дело с веществом – одной из форм материи, обладающих в отличие от полей массой покоя
Современная химия – это наука, изучающая превращения
веществ, сопровождающиеся изменением их состава и структуры
Основные критерии химической формы движения материи, т.е. химического взаимодействия:
пространственный масштаб событий 10–8 – 10–10 м температурный интервал 70 – 3000 K
диапазон энергий ± (30 – 3000) кДж/моль

ОСНОВЫ СТРОЕНИЯ ВЕЩЕСТВА
ПЕРИОДИЧЕСКИЙ ЗАКОН
В СВЕТЕ УЧЕНИЯ О СТРОЕНИИ АТОМА
Янад ней, может быть, двадцать лет думал,
авы думаете: сидел и вдруг… готово

Общие понятия
Слово «элемент» (лат. elementum) использовалось со времен античности в смысле части чего-либо
Химический элемент – базовое химическое понятие, отражающее химическую индивидуальность атомов в наиболее общем виде
«Элементы – практически неразложимые тела, состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних»
Роберт Бойль. Химик-скептик. 1661 год
Эмпирико-аналитическая концепция и первый в истории новой химии список химических элементов (таблица простых тел), разделённых на несколько типов
Антуан Лоран Лавуазье. Элементарный курс химии. 1789 год
Атомно-молекулярная гипотеза. Химический элемент – отдельный вид атомов. Простые и сложные вещества состоят, соответственно, из атомов одного или различного видов. Атомный вес – важнейшее свойство элементов, определяющее его химическую природу
Джон Дальтон. Новый курс химической философии. 1808 год
«Химические элементы – материальные части простых или сложных тел, которые придают им известную совокупность физических и химических свойств»
Дмитрий Иванович Менделеев. Середина XIX века
Известные к середине XIX века элементы
Элемент |
Атомный вес |
Элемент |
Атомный вес |
Азот |
14.008 |
Натрий |
22.991 |
Алюминий |
26.98 |
Никель |
58.71 |
Барий |
137.36 |
Ниобий |
92.91 |
Бериллий |
9.013 |
Олово |
118.70 |
Бор |
10.82 |
Осмий |
190.2 |
Бром |
79.916 |
Палладий |
106.4 |
Ванадий |
50.95 |
Платина |
195.09 |
Висмут |
209.00 |
Родий |
102.91 |
Водород |
1.0080 |
Ртуть |
200.61 |
Вольфрам |
183.86 |
Свинец |
207.21 |
Железо |
55.85 |
Селен |
78.96 |
Золото |
197.0 |
Сера |
32.066 |
Иридий |
192.2 |
Серебро |
107.88 |
Иттрий |
88.92 |
Стронций |
87.63 |
Йод |
126.91 |
Сурьма |
121.76 |
Кадмий |
112.41 |
Тантал |
180.95 |
Калий |
39.100 |
Теллур |
127.61 |
Кальций |
40.08 |
Титан |
47.90 |
Кислород |
16.000 |
Торий |
232.05 |
Кобальт |
58.94 |
Углерод |
12.011 |
Кремний |
28.09 |
Уран |
238.07 |
Литий |
6.940 |
Фосфор |
30.975 |
Магний |
24.32 |
Хлор |
35.457 |
Марганец |
54.94 |
Хром |
52.01 |
Медь |
63.54 |
Церий |
140.13 |
Молибден |
95.95 |
Цинк |
65.38 |
Мышьяк |
74.91 |
Цирконий |
91.22 |
ИТОГО:
54 элемента

Приведение элементов в порядок
триады Дёберейнера (1829): Br – Cl – I, Ca – Sr – Ba, S – Se – Te
первый химический конгресс (1860 г., Карлсруэ)
спираль де Шанкуртуа (1862)
октавы Ньюлендса (1864 - 1865)
таблицы Одлинга и Мейера (1870)
периодическая система Менделеева (1869)
коротко- и длиннопериодные варианты (всего ~ 700)
Приведение элементов в порядок
«Закон октав» Ньюлендса (1864 г.) |
|
|
|
|||||||||||||||||
|
№ |
|
№ |
|
№ |
|
№ |
|
№ |
|
№ |
|
№ |
|
№ |
|||||
H |
1 |
F |
|
8 |
|
Cl |
15 |
Co |
22 |
|
Br |
29 |
Pd |
36 |
I |
42 |
Pt |
50 |
||
|
|
|
|
|
|
|
|
|
Ni |
|
|
|
|
|
|
|
|
|
Ir |
|
Li |
2 |
Na |
|
9 |
|
K |
16 |
Cu |
23 |
|
Rb |
30 |
Ag |
37 |
Cs |
44 |
Os |
51 |
||
G |
3 |
Mg |
|
10 |
|
Ca |
17 |
Zn |
25 |
|
Sr |
31 |
Cd |
38 |
Ba |
45 |
Hg |
52 |
||
|
|
|
|
|
|
|
|
|
|
|
|
Ce |
|
|
|
|
V |
|
|
|
Bo |
4 |
Al |
|
11 |
|
Cr |
19 |
Y |
24 |
|
33 |
U |
40 |
Ta |
46 |
Tl |
53 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
La |
|
|
|
|
|
|
|
|
C |
5 |
Si |
|
12 |
|
Ti |
18 |
In |
26 |
|
Zr |
32 |
Sn |
39 |
W |
47 |
Pb |
54 |
||
N |
6 |
P |
|
13 |
|
Mn |
20 |
As |
27 |
|
Di |
34 |
Sb |
41 |
Nb |
48 |
Bi |
55 |
||
|
|
|
Mo |
|||||||||||||||||
O |
7 |
S |
|
14 |
|
Fe |
21 |
Se |
28 |
|
Ro |
35 Te 43 Au |
49 |
Th |
56 |
|||||
|
|
|
Ru |
|||||||||||||||||
|
|
|
График Мейера (кривая атомных объёмов элементов) |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
(1870 г.) |
Cs |
|
|
|
|
|
|
|||
|
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
объемы |
|
|
|
|
|
|
|
|
|
Rb |
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ba |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атомные |
40 |
|
|
|
|
|
|
|
|
Sr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
Cl |
Ca |
|
Br |
|
|
|
|
I |
|
|
|
|
|
|
||
|
|
|
Na |
|
Zr |
|
|
|
|
|
|
|
|
PbBi |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Te? |
|
|
|
|
|||
|
20 |
|
Mg |
|
|
Cl |
|
Se |
|
|
|
Sn |
Sb |
|
|
|
|
|||
|
|
|
S |
|
|
|
|
In |
|
|
|
|
|
Os? |
||||||
|
Li |
|
|
|
|
|
|
Nb |
|
|
|
|
|
Ta |
Au |
Ti |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
F |
|
P |
|
|
|
|
|
|
Cd |
|
|
|
|
W |
Hg |
||
|
10 |
|
|
|
|
|
As |
|
|
|
|
|
|
|
Pt |
|||||
|
O |
Al Si |
|
|
P |
Zn |
Mo |
|
Ag |
|
|
|
|
|
|
|
||||
|
HBe |
|
|
|
|
|
|
|
|
|
|
Ir |
||||||||
|
B CN |
|
|
|
Cr FeCo Cu |
|
|
RuRhPb |
|
|
|
|
|
|
|
|
||||
|
0 |
|
|
|
Mn |
Ni |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
20 |
|
40 |
|
60 |
80 |
|
100 |
120 |
140 |
|
160 |
180 |
|
200 |
|||
|
|
|
|
|
|
|
|
|
|
Атомные веса |
|
|
|
|
|
|
|
|||
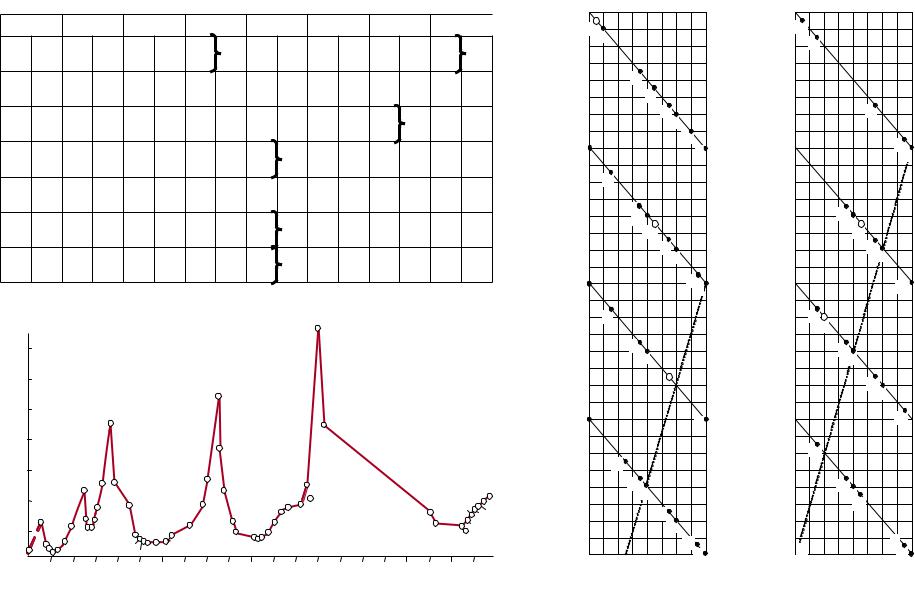
«Винтовой график» Бегуйе де Шанкуртуа (1864 г.)
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
(H2O) |
H |
|
|
|
|
|
|
|
|
2 |
Hydrogèn |
H |
|
|
|
|
|
|
|
||
(HO) |
|
|
|
|
|
|
|
|
|
|
Hydrogène |
|
|
|
|
|
|
|
|
|
4 |
Lithium |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
Li |
|
|
|
|
|
8 |
|
(GlO) |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Gl |
|
|
|
|
|
|
Gluciniume |
|
|
|
|
|
|
|
|
10 |
|
Bore |
|
|
|
|
|
Bo |
|
|
12 |
|
Carbone |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
C |
|
|
||
|
|
|
|
|
|
|
|
|
14 |
|
Azote |
O |
|
|
|
|
|
|
Az |
|
|
|
|
|
|
|
|
|
|
|||
Oxygène |
|
|
|
|
|
|
O |
|
16 |
|
|
|
|
|
|
|
|
|
|
||
Fluor |
|
|
|
|
|
|
|
|
|
18 |
|
Fl |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
||
Sodium |
|
|
|
Na |
|
|
|
|
|
22 |
|
|
|
|
|
|
|
|
|
||
Magnésium |
|
|
|
|
|
|
|
|
24 |
|
|
|
|
Mg |
|
|
|
|
|
||
Aluminiume |
|
|
|
|
Mg |
|
|
|
|
26 |
|
|
|
|
|
Al |
|
|
28 |
||
(SiO2) Silicium |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Si |
|
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
Phosphore |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph S |
|
||
Soufre |
|
|
|
|
|
|
|
32 |
||
Chlor |
|
|
|
|
|
|
|
|
|
34 |
|
Cl |
|
|
|
|
|
|
|
36 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
38 |
Potassium |
|
|
|
K |
|
|
|
|
|
40 |
Calcium |
|
|
|
Ca |
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
(SiO3) Silicium |
|
|
|
|
|
|
|
|
|
42 |
|
|
|
|
|
|
|
|
|
|
|
Carbone |
|
|
|
|
|
|
|
|
|
44 |
|
|
|
|
|
|
|
|
|
|
46 |
Titane |
|
|
|
|
|
|
|
Ti |
48 |
|
|
|
|
|
|
|
|
|
|
|
50 |
Chrome |
|
|
Cr |
|
|
|
|
|
|
52 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
54 |
|
Maʼnganèse |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mn |
|
|
|
|
|
|
|
Fer |
|
|
|
|
|
|
|
|
56 |
|
|
|
|
|
Fe |
|
|
|
|
|
|
Nikel |
|
|
|
|
|
Ni |
|
|
|
58 |
|
|
|
|
|
|
|
|
|
||
Cobalt |
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
Co |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Cuivre |
|
|
|
|
|
|
|
Cu |
|
62 |
(YtO) Yttrium |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
Yt |
|
64 |
|
14 |
16 |
||||||||
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
Zino |
|
|
|
|
|
|
|
|
|
64 |
Zn |
|
|
|
|
|
|
|
|
66 |
|
(Zr2O3) |
|
Zr |
|
|
|
|
|
|
|
|
Zirconium |
|
|
|
|
|
|
|
|
68 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
72 |
|
|
|
|
|
|
|
|
|
|
74 |
Arsenic |
|
|
|
|
|
As |
|
|
|
76 |
|
|
|
|
|
|
|
|
|
|
|
Brome |
|
|
|
|
|
|
|
|
|
78 |
|
|
|
|
|
|
|
Br |
|
80 |
|
Selénium |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Se |
82 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
84 |
Rubidium |
|
|
|
|
|
|
|
|
|
86 |
|
|
|
Rb |
|
|
|
|
88 |
||
Strontium |
|
|
|
|
|
|
|
|||
(ZrO2) |
|
|
|
|
Sr |
|
|
|
|
90 |
Zirconium |
|
|
|
|
Zr |
|
|
|
|
|
(LaO) |
|
|
|
|
|
La |
|
|
|
|
Lanthane |
|
|
|
|
|
|
|
|
92 |
|
(CeO) Cénum |
|
|
|
|
|
Ce |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
94 |
Molybdène |
|
|
|
|
|
|
|
Mo 96 |
||
(DiO) Didyme |
|
|
|
|
|
|
|
|
|
98 |
|
Di |
|
|
|
|
|
|
|
100 |
|
(Y2O3) Yttrium |
|
Yt |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
102 |
|
Thallium |
|
|
|
|
|
|
|
|
|
|
|
|
|
Tl |
|
|
|
|
104 |
||
Rhodium |
|
|
|
|
|
|
|
|||
|
|
|
|
Rh |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Palladium |
|
|
|
|
|
|
|
|
|
106 |
|
|
|
|
|
Pb |
|
|
|
108 |
|
Argent |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Ag |
|
|
|
|
Cadmium |
|
|
|
|
|
|
|
|
|
110 |
|
|
|
|
|
|
|
Cd |
|
112 |
|
|
|
|
|
|
|
|
|
|
||
Etain |
|
|
|
|
|
|
|
|
|
114 |
|
Sn |
|
|
|
|
|
|
116 |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
(ThO) Thorium |
|
|
|
|
|
|
|
|
|
118 |
|
|
|
Tb |
|
|
|
|
|
||
Uranium |
|
|
|
|
|
|
|
120 |
||
Antimoine |
|
|
|
|
Ur |
|
|
|
|
|
|
|
|
|
|
Sb |
|
|
|
|
122 |
|
|
|
|
|
|
|
|
|
|
124 |
Iode |
Te |
|
|
|
|
|
|
Io |
|
126 |
Tellure |
2 |
4 |
6 |
8 |
10 |
12 |
Te |
|
128 |
|
|
0 |
14 |
16 |
|||||||
Nota.-On a entouré d ύn cercle les pois correspondent aux caractères numénques dits secendaires.
Приведение элементов в порядок
1869 г. – статья в «Журнале русского химического общества»
Д.И. Менделеев впервые подробно изложил основы Периодической системы элементов
|
|
|
|
|
|
|
|
|
H=1 |
|
|
|
|
|
|
|
|
|
|
|
|
Be=9,4 |
|
|
|
|
|
|
|
|
|
|
|
B=11 |
|
Li |
Na |
K |
Cu |
Rb |
Ag |
Cs |
- |
Tl |
|
||
|
C=12 |
||||||||||
|
|
|
|
|
|
|
|
|
|
||
7 |
23 |
36 |
63,4 |
85,4 |
108 |
133 |
|
204 |
|
N=14 |
|
|
|
|
|
|
|
|
|
|
|
O=16 |
|
Be |
Mg |
Ca |
Zn |
Sr |
Cd |
Ba |
- |
Pb |
|
||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
F=19 |
|
B |
Al |
- |
- |
- |
Ur |
- |
- |
Bi |
|
||
Li=7 |
Na=23 |
||||||||||
|
|
|
|
|
|
|
|
|
|||
C |
Si |
Ti |
- |
Zr |
Sn |
- |
- |
- |
|||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
P |
V |
As |
Nb |
Sb |
- |
Ta |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
S |
- |
Se |
- |
Te |
- |
W |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
Cl |
- |
Br |
- |
J |
- |
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19 |
35,5 |
58 |
80 |
190 |
127 |
160 |
190 |
220 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ti=50 |
Zr=90 |
?=180. |
|
V=51 |
Nb=94 |
Ta=182. |
|
Cr=52 |
Mo=96 |
W=186. |
|
Mn=55 |
Rh=104,4 |
Pt=197,4. |
|
Fe=56 |
Ru=104,4 |
Ir=198. |
|
Ni=Co=59 |
Pl=106,6 |
Os=199. |
|
Cu=63,4 |
Ag=108 |
Hg=200. |
Mg=24 |
Zn=65,2 |
Cd=112 |
|
Al=27,4 |
?=68 |
Ur=116 |
Au=197? |
Si=28 |
?=70 |
Sn=118 |
|
P=31 |
As=75 |
Sb=122 |
Bi=210? |
S=32 |
Se=79,4 |
Te=128? |
|
Cl=35,5 |
Br=80 |
I=127 |
|
K=39 |
Rb=85,4 |
Cs=133 |
Tl=204. |
Ca=40 |
Sr=87,6 |
Ba=137 |
Pb=207. |
?=45 |
Ce=92 |
|
|
?Er=56 |
La=94 |
|
|
?Yt=60 |
Di=95 |
|
|
?In=75,6 |
Th=118? |
|
|
Периодический закон Д.И. Менделеева
«Свойства простых тел, а так же формы и свойства соединений элементов находятся в прямой зависимости от
атомных весов
элементов»
