
Билет 6. Химия. Итог 2
.docx
1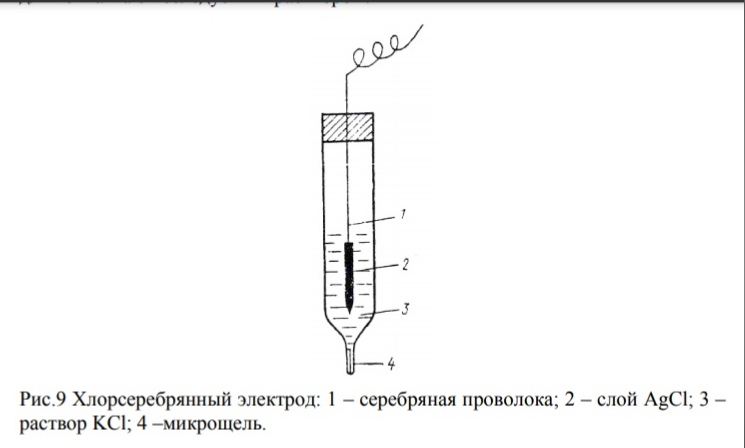 .
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД.
.
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД.
Хлорсеребряный электрод Аg Ag Cl ׀ KCl Хлорсеребряный электрод относится к электродам второго рода и представляет собой серебряную проволоку, покрытую слоем хлорида серебра и опущенную в сосуд, наполненный насыщенным раствором хлорида калия. Сосуд имеет микрощель для контакта с исследуемым раствором.
Основной химический процесс: Аg +1 + ē ↔ Аg 0
Сопровождается реакцией растворения или осаждения соли АgСl: АgСl ↔ Аg + + Сl‾
В присутствии хлорида калия, содержащего одноименный с хлоридом серебра ион хлора, растворимость хлорида серебра снижается. При постоянных концентрации KCl и температуре концентрация ионов Аg + постоянна, чем и объясняется необходимая устойчивость потенциала электрода.

2. МЕХАНИЗМ ВОЗНИКНОВЕНИЯ ЗАРЯДА НА КОЛЛОИДНЫХ ЧАСТИЦАХ.
В
следствие той или иной реакции между
растворимыми солями образуется
нерастворимые кристаллы (агрегаты)
полученной соли, содержащие m
молекул её. В зависимости от того, какая
соль была в избытке в начале на агрегате
избирательно адсорбируются ионы, которые
содержались в избыточной соли и не до
конца израсходовались при образовании
агрегата (изначальное количество ионов
в избыточной соли, образовавших агрегат
– m
= n).
Если адсорбировались положительные
ионы, то на поверхности агрегата
образуется положительно заряженный
слой, а если отрицательные иона, то –
отрицательный. Адсорбированные ионы
являются потенциалобразующими
(ПОИ).
Агрегат вместе с ПОИ образует ядро.
Под действием электростатических сил
к ядру притягивается число n ионов
противоположного знака – противоионов,
компенсирующих заряд ядра. Часть
противоионов (n–x), наиболее близко
расположенных к ядру, испытают действие
не только э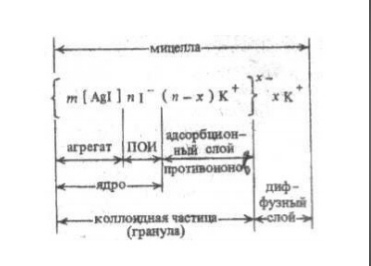 лектростатических,
но и Ван-дерваальсовых сил ядра, поэтому
прочно удерживаются около него и образуют
так называемый адсорбционный
слой противоионов.
Ядро с адсорбционным слоем образует
коллоидную
частицу или гранулу.
Она также имеет заряд, противоположный
заряду адсорбционного слоя. Остальные
х противоионы, слабее связанные с ядром
(только электростатически), под влиянием
теплового движения располагаются в
жидкой фазе диффузно (т.е. размыто),
почему и носят название диффузного
слоя. Они компенсируют заряд частицы.
Всё это образование вместе и является
мицеллой.
Мицеллы золей электронейтральны.
лектростатических,
но и Ван-дерваальсовых сил ядра, поэтому
прочно удерживаются около него и образуют
так называемый адсорбционный
слой противоионов.
Ядро с адсорбционным слоем образует
коллоидную
частицу или гранулу.
Она также имеет заряд, противоположный
заряду адсорбционного слоя. Остальные
х противоионы, слабее связанные с ядром
(только электростатически), под влиянием
теплового движения располагаются в
жидкой фазе диффузно (т.е. размыто),
почему и носят название диффузного
слоя. Они компенсируют заряд частицы.
Всё это образование вместе и является
мицеллой.
Мицеллы золей электронейтральны.
3. АДСОРБЦИЯ НА ГРАНИЦЕ Ж-Г, Ж-Ж:
При растворении в воде поверхностно-активные вещества (ПАВ) накапливаются в поверхностном слое; поверхностно-инактивные вещества (ПИВ), наоборот, концентрируются в объеме раствора. И в том, и в другом случае распределение вещества между поверхностным слоем и внутренним объемом подчиняется принципу минимума энергии Гиббса: на поверхности оказывается то вещество, которое обеспечивает наименьшее поверхностное натяжение, возможное при данных условиях. В первом случае это молекулы ПАВ, во втором – молекулы растворителя (воды). Происходит адсорбция.
Разность концентраций в поверхностном слое и объеме раствора приводит к возникновению сил осмотического давления и процессу диффузии, стремящемуся выравнить концентрации по всему объему.
Когда уменьшение поверхностной энергии, связанное с обеднением или обогащением поверхностного слоя растворенным веществом, будет уравновешено противодействующими силами осмотического давления (или когда химические потенциалы растворенного вещества и растворителя в поверхностном слое будут равны их химическим потенциалам в объеме раствора). В системе наступит подвижное равновесие, которое характеризуется определенной разностью концентраций между поверхностным слоем и объемом раствора.
Избыток или недостаток растворенного вещества в поверхностном слое, отнесенный к единице поверхности. Обозначают через Г, называют гиббсовской адсорбцией и выражают в моль/м2 , кг/м2 и т.п.
В тех случаях, когда концентрация адсорбтива в поверхностном слое больше, чем в объеме раствора, Г>0 – адсорбция положительна. Это характерно для растворов ПАВ. При недостатке вещества в поверхностном слое Г меньше 0 – адсорбция отрицательна, что имеет место для растворов ПИВ. Таким образом, положительной адсорбцией называют адсорбцию, сопровождающуюся накоплением растворенных веществ в поверхностном слое. Отрицательной называют адсорбцию, сопровождающуюся вытеснением растворенного вещества из поверхностного слоя внутрь среды (десорбция). Практическое значение имеет только положительная адсорбция, поэтому под термином “адсорбция” имеют в виду именно этот случай.
УРАВНЕНИЕ АДСОРБЦИИ ГИББСА:

Если адсорбция положительна, то согласно уравнению (7) d/dc меньше 0 Г больше 0. При отрицательной адсорбции d/dc >0, Г меньше 0. Зависимость знака адсорбции от знака d/dc называют правилом Гиббса.
