
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
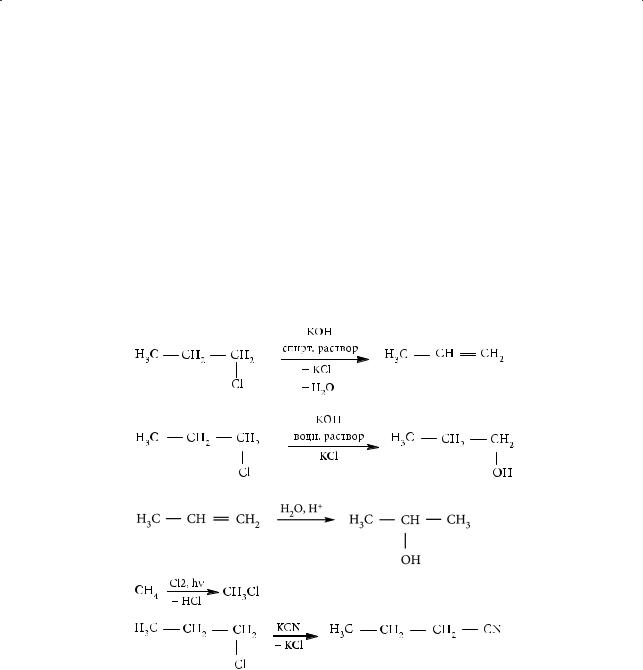
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

Глава 1. Введение в органическую химию
§ 5. ПЕРВОНАЧАЛЬНЫЕ ПРЕДСТАВЛЕНИЯ О ТИПАХ И МЕХАНИЗМАХ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Типы разрыва ковалентной связи
Одним из главных классификационных признаков органических реакций является их механизм. В ходе любых химических реакций разрываются химические связи в исходных веществах и образуются новые химические связи в продуктах реакции. Органические вещества в основном характеризуются ковалентным типом связи. Рассмотрим возможные пути разрыва (диссоциации) ковалентной связи.
Взависимости от химической природы соединения и условий проведения реакции ковалентная связь может разрываться по гомолитическому или гетеролитическому пути.
Впервом случае разрыв связи происходит симметрично, общая электронная пара распадается таким образом, что у каждого из атомов, участвовавших
вобразовании связи, остается по одному неспаренному электрону:
Именно такой способ разрыва связи и называется гомолитическим (от греч. homos — одинаковый и lysis — разложение, распад). Образовавшиеся частицы называются свободными радикалами.
Свободные радикалы — это частицы (атомы или молекулы), имеющие неспаренные электроны.
Несимметричный разрыв связи приводит к образованию ионов:
Такой путь разрыва связи называют гетеролитическим (греч. heteros — различный).
Механизм реакций, которые происходят с промежуточным образованием свободных радикалов, называют свободнорадикальным. Эти реакции идут в жестких условиях (при высокой температуре или при облучении) и характерны для соединений с относительно прочными неполярными или слабополярными связями. Механизм реакций, в которых разрыв связи идет по гетеролитическому пути, называется ионным.
Реакции, проходящие по ионному механизму, характерны для полярных веществ или тех, в которых химические связи легко поляризуются. Обычно такие реакции происходят в более мягких условиях.
34

§ 5. Первоначальные представления о типах и механизмах органических реакций
Механизмы органических реакций
В неорганической химии одним из критериев классификации химических реакций является состав и количество участвующих в реакции веществ. В зависимости от этого выделяют реакции соединения, разложения, замещения, обмена.
Воснову классификации органических реакций могут быть положены различные критерии. Один из них — механизмы реакций, а значит, и природа тех интермедиатов (промежуточных частиц: катионов, анионов, радикалов), которые образуются в процессе разрыва химических связей.
Атом или группу атомов, участвующих в разрыве или образовании связей, называют реакционным центром, а способность соединения вступать в те или иные реакции с той или иной скоростью служит мерой его реакционной способности. Здесь тоже своя терминология: органическое соединение, молекула которого поставляет для образования новой связи атом углерода, называют субстратом, а соединение, атакующее субстрат, называют реагентом.
Ворганической химии важнейшим объектом изучения является само органическое соединение и то, что с ним происходит. Среди возможных типов реакций выделим следующие:
1.Реакции замещения
Вэтих реакциях какой-либо атом или группа атомов замещает в молекуле органического веществ другой атом или группу атомов:
C |
X + Y |
|
C |
X + Y |
|
Например:
CH3Br+ NaOH → CH3OH+ NaBr.
Поскольку основной акцент делается на том, что произошло с органическим соединением, мы можем записывать формулы неорганических реагентов и условия реакций над стрелкой, а формулы неорганических продуктов реакции — под ней. Для приведенной ниже реакции это выглядит следующим образом:
CH3Br NaOH–NaBr CH3OH.
CH3OH.
35

Глава 1. Введение в органическую химию
2.Реакции присоединения
Врезультате таких реакций какой-либо реагент присоединяется к молекуле органического вещества по кратной (двойной или тройной) связи:
C C + XY |
C C |
X Y
Напомним, что в случае кратной связи одна общая электронная пара обусловливает σ-связь, остальные такие пары — π-связи. В ходе реакций присоединения происходит разрыв менее прочной π-связи. Примером подобных реакций может быть присоединение бромоводорода к этилену:
H2C  CH2 HBr
CH2 HBr CH3 CH2 Br
CH3 CH2 Br
3.Реакции отщепления
Впроцессе таких реакций разрываются две σ-связи (С–X и С–Y) и формируется новая углерод-углеродная π-связь:
C C |
C + XY |
X Y
Например, внутримолекулярная дегидратация (приставка «де-» указывает на процесс отщепления) спиртов — отщепление воды:
CH3 |
|
CH2 |
|
OH |
H2SO4, 170 °C |
H2C CH2 |
|
|
–H2O |
||||
|
|
|
|
|
|
Возможен и другой вариант: две взаимодействующие молекулы конденсируются в одну за счет отщепления продукта XY:
C |
|
X + Y |
|
C |
|
|
|
|
|
C |
|
C |
|
+ XY |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
Примером такой реакции может служить межмолекулярная дегидратация спиртов:
H3C — CH2 — OH + HO — CH2 — CH3 H2SO4, 170 °C –H2O
H2SO4, 170 °C |
H3C — CH2 — O — CH2 — CH3 |
|
–H2O |
||
|
36

§ 5. Первоначальные представления о типах и механизмах органических реакций
Нуклеофильные и электрофильные частицы
При обсуждении механизма реакций органическую молекулу принято называть субстратом, а частицы, которые ее атакуют, — реагентами. Реагентами могут быть свободные радикалы, ионы и нейтральные молекулы.
Частицы, атакующие субстрат на участках с избытком электронной плотности, называют электрофилами, а на электронодефицитных участках — нуклеофилами.
Электрофилы (от греч. phileo — люблю) обладают дефицитом электронной плотности: имеют положительный заряд (катионы Н+, СН3+, NO2+ и др.) или могут легко поляризоваться с образованием катионов (например, молекулы брома Br2). Они атакуют субстрат на участках с повышенной электронной плотностью.
Нуклеофилы обладают избытком электронной плотности. Это анионы (Сl–, OH–) или молекулы, имеющие атом с неподеленными электронными парами (например, H2O, NH3). Они атакуют субстрат на участках с пониженной электронной плотностью.
Греческое слово nucleos означает «ядро». Таким образом, слово «нуклеофил» буквально означает «любящий ядро». Ядра атомов, как известно, заряжены положительно. Конечно, нуклеофилы атакуют не ядра атомов, а области субстрата с дефицитом электронной плотности.
При классификации органических реакций с учетом их механизма можно выделить следующие типы:
—замещение свободнорадикальное (обозначают SR; S — сокр. от англ. substitution — замещение);
—замещение электрофильное (SE): первой атакующей частицей является электрофил (X+), а значит, атакуемый субстрат обладает избытком электронной плотности;
—замещение нуклеофильное (SN): первой атакующей частицей является нуклеофил (Y–), и, соответственно, атакуемый субстрат обладает дефицитом электронной плотности;
—присоединение свободнорадикальное (AR; A — сокр. от англ. addition — присоединение);
—присоединение электрофильное (AE);
—присоединение нуклеофильное (AN);
—отщепление (E — сокр. от англ. elimination — удаление) и т. д.
37
Глава 1. Введение в органическую химию
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Какие типы химических реакций органических соединений можно выделить, если классифицировать их на основании механизма?
2.Изобразите схему диссоциации молекулы HI по гомолитическому и гетеролитическому пути.
3.Заполните таблицу, записав формулы перечисленных ниже частиц в одну из ее колонок:
Свободные радикалы |
|
Нуклеофилы |
Электрофилы |
|
|
|
|
H+, H–, H3O+, OH–, |
OH·, NH2–, NO2+, C2H5·, |
NO2·, Cl–. |
|
4.Определите тип реакции (замещение, присоединение, отщепление), уравнения которых приведены ниже:
а)
б)
в)
г)
д)
К какому классу органических веществ относятся реагенты и продукты этих реакций?
38
