
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
§40. Строение карбоновых кислот, их физические и химические свойства
§40. СТРОЕНИЕ КАРБОНОВЫХ КИСЛОТ,
ИХ ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
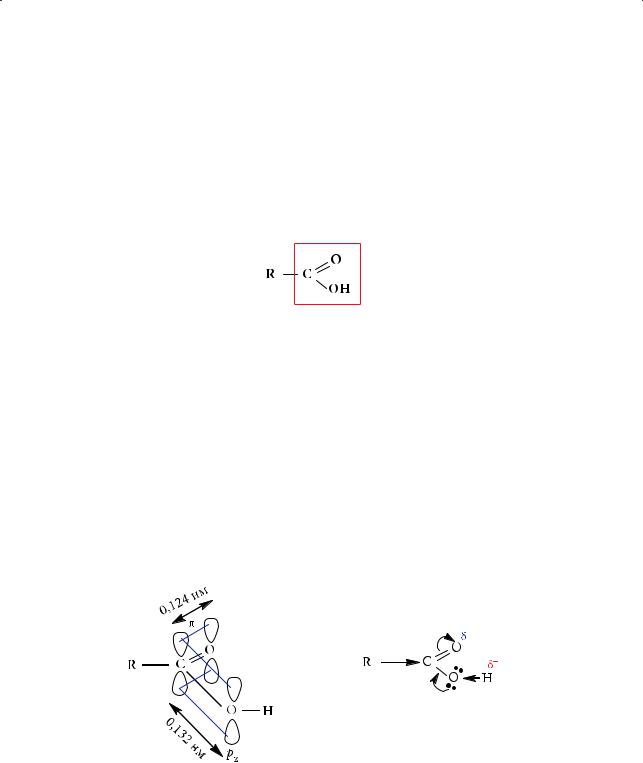
Электронное строение карбоксильной группы и прогноз реакционной способности карбоновых кислот
Рассмотрим особенности электронного строения функциональной группы карбоновых кислот:
Связь С=О полярна, ее присутствие в молекулах органических соединений обычно обусловливает склонность к реакциям нуклеофильного присоединения. Группа –ОН в составе молекул обеспечивает им проявление слабых кислотных свойств. Как скажется на свойствах карбоновых кислот одновременное присутствие в их молекулах гидроксильной и карбонильной групп?
Атом углерода карбонильной группы находится в sp2-гибридном состоянии. Он образует три σ-связи: две с атомами кислорода и одну с атомом водорода (в муравьиной кислоте) или углерода (в молекулах других карбоновых кислотах). Незатронутые гибридизацией р-орбитали атома углерода и карбонильного атома кислорода перекрываются с образованием π-связи (рис. 7.1). Однако по сравнению с альдегидами и кетонами углеродный атом карбонильной группы в молекуле карбоновой кислоты имеет меньший положительный заряд.
Рис. 7.1. Схема образования π-связи и р, π-сопряжения в карбоксильной группе
235

Глава 7. Карбоновые кислоты
Это происходит благодаря положительному мезомерному эффекту (+М) атома кислорода гидроксильной группы, имеющего неподеленную электронную пару на р-орбитали:
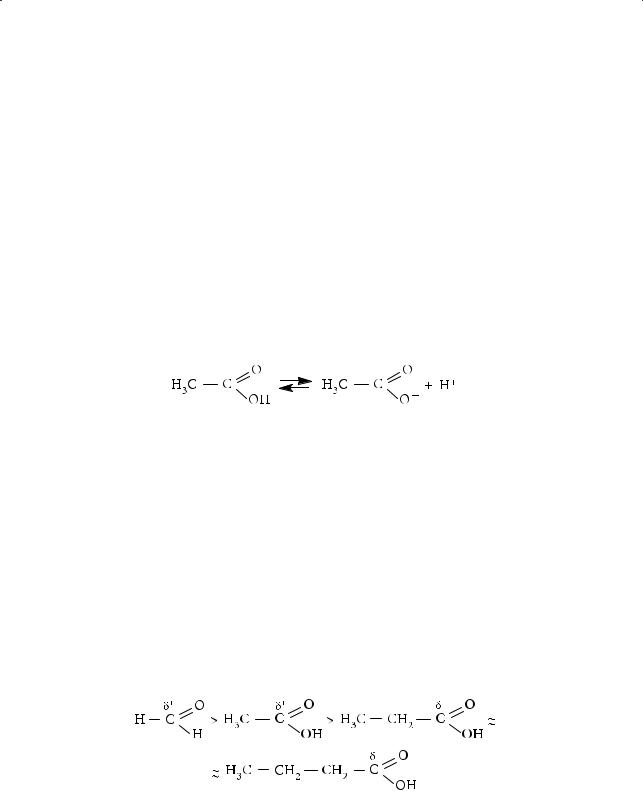
Повышенная кислотность карбоновых кислот обусловлена и мезомерией (сопряжением), что определяет устойчивость карбоксилат-аниона. Отрицательный заряд образующегося при диссоциации аниона в равной степени сосредоточен на обоих углеродных атомах кислорода карбоксильной группы, что может быть представлено следующими резонансными структурами:
Физические свойства карбоновых кислот
Первые три члена гомологического ряда предельных одноосновных карбоновых кислот — жидкости, хорошо растворимые в воде. Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей и существуют в основном в виде циклических димеров и линейных олигомеров:
С увеличением молекулярной массы их температуры кипения возрастают. Любопытную закономерность можно выявить, сравнивая и температуры плавления карбоновых кислот. Кислоты с четным числом углеродных атомов имеют более высокие температуры плавления, чем с нечетным. С увеличением числа углеродных атомов в молекуле кислоты это альтернирование температур плавления уменьшается, а начиная с кислоты, содержащей 36 углеродных атомов, вовсе исчезает.
236
§ 40. Строение карбоновых кислот, их физические и химические свойства
Химические свойства карбоновых кислот
Несмотря на то что в молекулах карбоновых кислот имеются карбонильная и гидроксильная группы, они заметно отличаются по химическим свойствам от спиртов и карбонильных соединений — альдегидов и кетонов. Взаимное влияние этих групп приводит к перераспределению электронной плотности в молекуле кислоты, определяя реакционную способность последней.
Карбоновые кислоты изменяют окраску индикатора и проявляют все свойства, характерные для кислот, обладая при этом и рядом специфических свойств, таких как образование функциональных производных и способность вступать в реакции по углеводородному радикалу.
1.Кислотные свойства
Одноосновные карбоновые кислоты являются слабыми электролитами,
незначительно диссоциируя на ионы:
Карбоновые кислоты, подобно минеральным кислотам, реагируют с металлами, оксидами, основаниями (растворимыми и нерастворимыми), солями, вытесняя более слабые кислоты:
2CH3COOH + Mg → (CH3COO)2Mg + H2↑; 2CH3COOH + CaO → (CH3COO)2Ca + H2O; CH3COOH + NaOH → 2CH3COONa + H2O; 2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O; 2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2↑.
На силу кислоты влияет природа углеводородного радикала. Чем бóльшим является положительный индуктивный эффект радикала, тем слабее выражены ее кислотные свойства:
237

Глава 7. Карбоновые кислоты
Присутствие акцепторного заместителя при α-углеродном атоме повышает силу кислоты:
2.Реакция этерификации
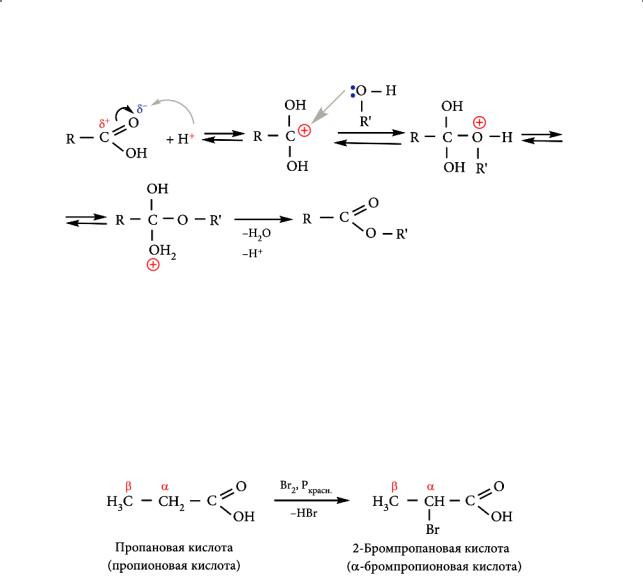
Взаимодействие карбоновых кислот со спиртами в присутствии минеральной кислоты приводит к образованию сложных эфиров:
Как видно из представленной схемы, группа ОН отщепляется от кислоты, а Н+ — от молекулы спирта. Причина этого заключается в следующем: катализатор активирует карбоновую кислоту, обеспечивая ее дальнейшее взаимодействие с молекулой спирта. Рассмотрим механизм реакции, который представлен на следующей схеме:
238
§ 40. Строение карбоновых кислот, их физические и химические свойства
Таким образом, причина того, что группа ОН отщепляется от кислоты, а катион водорода — от молекулы спирта, заключается в следующем: катализатор активирует карбоновую кислоту, обеспечивая ее дальнейшее взаимодействие с молекулой спирта.
3.Реакции с участием углеводородного радикала (реакции замещения)
Карбоновые кислоты взаимодействуют с галогенами в присутствии красного фосфора (реакция Геля (Carl Magnus Hell) — Фольгарда (Jacob Volhard) —
Зелинского).
Замещению подвергаются атомы водорода при α-углеродном атоме, которые активированы находящейся по соседству карбоксильной группой.
4.Образование функциональных производных
Общим свойством всех функциональных производных карбоновых кислот является то, что они могут быть получены из карбоновой кислоты и вновь в нее превращены при гидролизе.
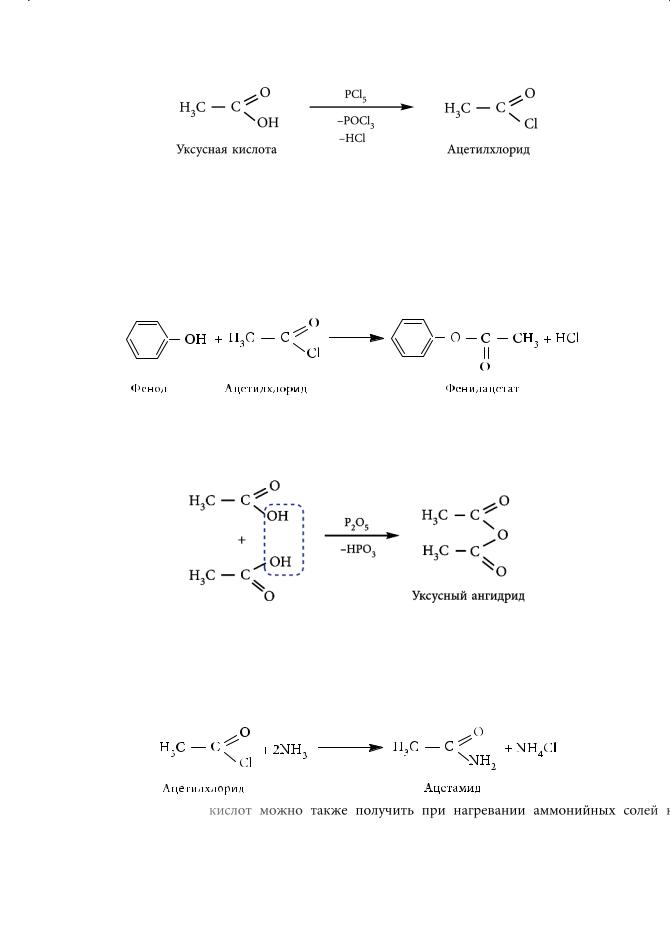
Образование галогеноангидридов. При действии на карбоновые кислоты хлоридов и бромидов фосфора(V) и (III) гидроксильная группа замещается на галоген с образованием соответствующих хлорили бромангидридов карбоновых кислот:
239
Глава 7. Карбоновые кислоты
В реакциях нуклеофильного замещения галогенангидриды карбоновых кислот гораздо более активны, чем сами кислоты, поскольку карбонильный углеродный атом имеет больший положительный заряд. Получение сложных эфиров с участием галогенангидридов является, в отличие от этерификации, необратимой реакцией. Например, получить сложный эфир фенола действием на него уксусной кислоты не удается, а в реакции с ацетилхлоридом легко образуется уксуснофениловый эфир (фенилацетат):
Образование ангидридов карбоновых кислот. При действии на карбоновые кислоты водоотнимающих средств в процессе межмолекулярной дегидратации образуются ангидриды карбоновых кислот:
Уксусный ангидрид находит широкое применение в различных реакциях ацилирования, при получении ацетатного волокна, фармацевтических препаратов и т. д.
Образование амидов. Взаимодействие галогенангидридов карбоновых кислот с аммиаком приводит к образованию амидов:
240
§ 40. Строение карбоновых кислот, их физические и химические свойства
Амиды кислот можно также получить при нагревании аммонийных солей карбоновых кислот:
СН3СООН + NH3 → CH3COONH4 → CH3CONH2 + H2O.
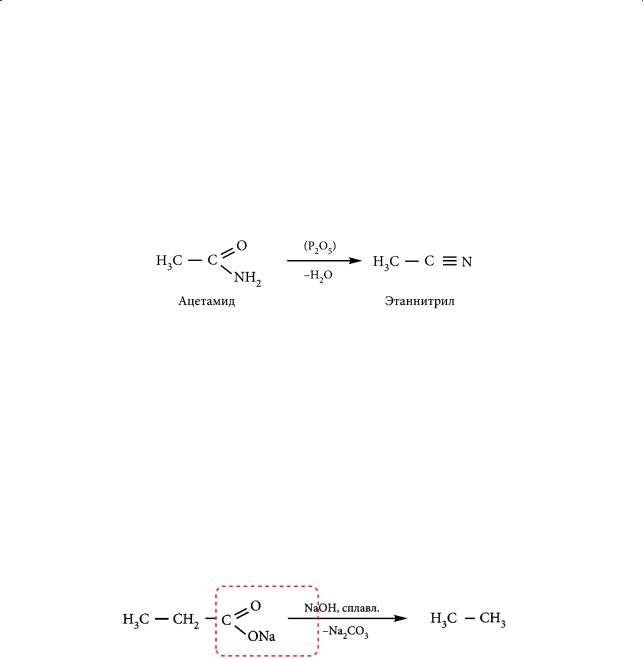
При термическом разложении амидов карбоновых кислот в присутствии водоотнимающих средств, например фосфорного ангидрида, образуются нитрилы, также являющиеся функциональными производными карбоновых кислот:
Неподеленная пара электронов атома азота в амидах находится в сопряжении с π-электронами карбонильной группы С=О (р,π-сопряжение), поэтому положительный заряд на карбонильном атоме углерода меньше, чем у других функциональных производных карбоновых кислот. Большинство амидов — кристаллические вещества с более высокими температурами кипения и плавления, чем у карбоновых кислот. Высокие температуры кипения обусловлены наличием межмолекулярных водородных связей. Водородные связи такого типа ответственны за формирование строго определенной вторичной и третичной структуры белков.
5.Сплавление солей карбоновых кислот со щелочью
Впроцессе сплавления солей карбоновых кислот c твердой щелочью происходит расщепление углеродной связи и образуются алканы:
6.Декарбоксилирование карбоновых кислот
При высоких температурах карбоновые кислоты подвергаются декарбок-
силированию (отщеплению СО2) с образованием алканов, молекулы которых содержат на один углеродный атом меньше, чем исходная кислота:
CH3 — CH2COOH 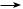 CH3 — CH3 + CO2.
CH3 — CH3 + CO2.
241
