
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
Глава 1. Введение в органическую химию
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Определите электронную конфигурацию атомов: а) водорода; б) кислорода; в) азота; г) серы; д) хлора; е) фосфора.
2.По данным о распределении валентных электронов найдите элемент. Какова электронная конфигурация следующих частиц: а) атома аргона Ar; б) иона калия K+; в) иона стронция Sr2+; г) бромид-иона Br–; д) селенид-иона Se2–; е) иона иттрия Y3+?
3.Перечислите все возможные частицы с конфигурацией внешнего энергетическо-
го уровня 2s22p6.
§ 4. ТИПЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
Химическая связь — совокупность сил, обусловливающих взаимодействие атомов или ионов друг с другом в химическом соединении.
Ионная связь
В образовании ионной связи участвуют ионы — заряженные частицы, образующиеся в результате отдачи или присоединения электронов атомами или группами химически связанных атомов. Различают два вида ионов: катионы — положительно заряженные ионы, анионы — отрицательно заряженные ионы.
Причина образования связи заключается в тенденции атомов элементов к приобретению устойчивой восьмиэлектронной оболочки. Вспомним это на примере образования ионной пары Na+F–. Условно разделим процесс образования ионной связи на три этапа:
1.Образование катиона Na+. Электронная конфигурация атома натрия 1s22s22p63s1. Для приобретения устойчивой электронной конфигурации ближайшего в Периодической системе инертного газа (Ne) требуется отдать 1e– с внешнего валентного уровня.
Na0 |
→ |
Na+ + 1e– |
1s22s22p63s1 |
|
1s22s22p6 |
атом |
|
катион |
2.Образование аниона F–. Электронная конфигурация атома фтора 1s22s22p5. Для приобретения устойчивой электронной конфигурации ближайшего инертного газа (Ne) требуется принять 1e– на внешний валентный уровень.
28

§ 4. Типы и характеристики химической связи
F0 + 1e– |
→ |
F– |
1s22s22p5 |
|
1s22s22p6 |
атом |
|
анион |
3.Образование связи между катионом и анионом. Атом Na отдает электрон атому F. В результате образуются два иона: Na+ и F–. Данные ионы притягиваются благодаря электростатическому взаимодействию:
Na+ + F– → NaF.
Таким образом, ионная связь — это связь, образующаяся между ионами противоположного знака в результате их электростатического взаимодействия.
Если представить ионы в виде несжимаемых сфер, то они располагаются в кристаллах относительно друг друга в порядке, позволяющем занять минимально возможный объем с минимальной потенциальной энергией. Так образуется ионная кристаллическая решетка.
Ковалентная связь
Именно этот тип связи в основном характерен для молекул органических соединений. Рассмотрим его подробнее.
Ковалентная связь — это связь между атомами, возникающая за счет образования общих связывающих электронных пар. При образовании ковалентной связи происходит перекрывание атомных орбиталей.
Существует два механизма образования ковалентной связи:
1.Обменный механизм. Общая связывающая электронная пара образуется неспаренными электронами исходных атомов. Например, образование ковалентной связи в молекуле водорода и в молекуле хлора:
2.Донорно-акцепторный механизм. Общая связывающая электронная пара предоставляется одним из атомов (донором электронной пары), другой атом предоставляет вакантную атомную орбиталь. Так, при образовании иона аммония NH4+ из молекулы NH3 и иона Н+ атом азота, имеющий не-
29
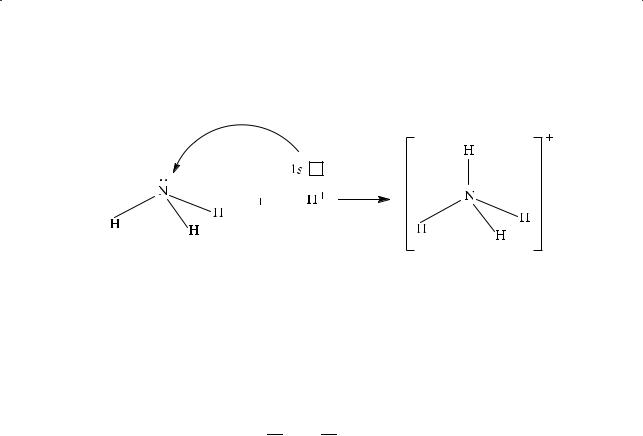
Глава 1. Введение в органическую химию
поделенную электронную пару, предоставляет ее для образования еще одной ковалентной связи, а ион Н+ — вакантную орбиталь:
Важной характеристикой связи является ее полярность. Различие в значениях электроотрицательности (ЭО) атомов определяет полярность связи.
Электроотрицательность — величина, характеризующая способность атомов того или иного элемента в молекуле или сложном ионе смещать к себе электроны, участвующие в образовании связи. Различают ковалентную полярную и неполярную связи.
Ковалентная неполярная связь — связь между атомами одного и того же элемента, например в молекулах газов хлора, водорода, азота:
Cl Cl, H H, N  N.
N.
Ковалентная полярная связь — связь между атомами элементов, которые различаются значениями электроотрицательности. В этом случае общая электронная пара смещается к более электроотрицательному атому, на котором возникает частичный отрицательный заряд (δ–). На атоме с меньшей электроотрицательностью возникает частичный положительный заряд (δ+), например в молекуле хлороводорода:
δ+ δ– H → Cl
Полярность связи указывает на характер распределения электронной плотности в молекуле. Характеристикой полярности связи служит ее электрический дипольный момент.
Диполь — система, состоящая из двух равных по величине, но противоположных по знаку зарядов, расположенных на некотором расстоянии друг от друга.
Дипольный момент связи µ (в Кл·м) определяется по формуле µ = ql, где q — абсолютная величина заряда в кулонах, l — длина диполя (вектор, направленный из центра положительного заряда к центру отрицательного заря-
30

§ 4. Типы и характеристики химической связи
да). Внесистемной единицей измерения дипольного момента является дебай (1D = 3,33·10–30 Кл·м).
Кроме полярности, присущей связям в невозбужденной молекуле, каждая связь обладает определенной поляризуемостью — способностью изменять свою полярность под влиянием внешнего электромагнитного поля. Поляризуемость имеет большое значение для возможности осуществления многих химических реакций в органической химии.
Характеристики ковалентной связи
Ковалентная связь характеризуется различными параметрами, такими как длина и кратность связи, энергия связи, валентный угол и т. д.
Под длиной связи понимают межъядерное расстояние взаимодействующих атомов. Длина связи чаще всего выражается в нанометрах (нм); 1 нм = 10–9 м.
Энергия связи — энергия, выделяющаяся при образовании связи, или энергия, которую потребуется затратить, чтобы разорвать связь между взаимодействующими атомами. Обычно энергия связи выражается в кДж/моль. Чем прочнее связь, тем больше энергия связи.
Валентный угол — угол между линиями, соединяющими ядра атомов, образующих связи. Так, например, валентный угол HOH в молекуле воды равен 104,5°; в молекуле NH3 — 107,5°; валентный угол НСН в молекуле метана равен 109,5° и т. д.
Кратность ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами. По кратности ковалентная связь может быть:
—одинарной (атомы связаны одной общей электронной парой) — связи
вмолекулах H–H ; Cl–Cl; H–Cl;
—двойной (атомы связаны двумя общими электронными парами) — связи
вмолекуле кислорода О=О;
—тройной (атомы связаны тремя общими электронными связями) — связи
вмолекуле азота N≡N.
При образовании ковалентной связи происходит перекрывание электронных облаков. По способу перекрывания атомных орбиталей различают:
—σ-связь, при образовании которой область перекрывания атомных орбиталей находится на линии, соединяющей центры взаимодействующих атомов. Между каждой парой атомов может быть только одна σ-связь. Одинарная связь всегда σ-связь.
—π-связь, при образовании которой области перекрывания атомных орбиталей располагаются на линии, перпендикулярной линии, соединяющей центры взаимодействующих атомов.
31

Глава 1. Введение в органическую химию
Рис. 1.6. Схема перекрывания орбиталей при образовании σ- и π-связей
π-Связь может только дополнять σ-связь в двойной (1 σ-связь и 1 π-связь) или тройной связи (1 π-связь и 2 σ-связи). В случае тройной связи две π-связи располагаются на взаимно перпендикулярных плоскостях.
Схемы образования σ- и π-связей приведены на рис. 1.6. С ростом кратности связи уменьшается ее длина.
Свойства ковалентной связи
Свойства ковалентной связи определяют способность вещества вступать в химические реакции. Наиболее важные из них — насыщаемость связи и ее направленность.
НАСЫЩАЕМОСТЬ
При образовании связи в области связывания могут находиться только два электрона с противоположными спинами. Невозможно использование одной и той же атомной орбитали дважды при образовании химических связей. В этом заключается насыщаемость ковалентной связи.
Насыщаемость ковалентной связи зависит от валентности атомов элементов, образующих связь. Вспомним, что валентность определяется:
—числом неспаренных электронов;
—числом неподеленных электронных пар;
—числом вакантных орбиталей на валентном слое атомов данного элемента.
Во всех органических соединениях углерод четырехвалентен, следовательно атомы углерода находятся в возбужденном состоянии. Конфигурация валентного слоя атома углерода:
|
Стационарное |
|
|
|
Возбужденное |
|||||||
(основное) состояние |
|
|
|
состояние |
|
|||||||
|
2p |
↑ |
↑ |
|
|
|
Энергия |
2p |
↑ |
↑ |
↑ |
|
2s |
↑↓ |
|
|
|
|
|
|
2s |
↓ |
|
|
|
32

§ 4. Типы и характеристики химической связи
НАПРАВЛЕННОСТЬ
Так как ковалентная связь образуется при перекрывании атомных орбиталей, которые, в свою очередь, направлены в пространстве (кроме сферических s-орбиталей), то и ковалентные связи пространственно направлены. Направленность ковалентной связи обусловливает определенную пространственную конфигурацию молекул.
Часто химические связи образуются с участием электронов разных энергетических состояний.
Например, у атомов в возбужденном состоянии Be (2s12p1), B (2s12p2), C (2s12p3) в образовании связей одновременно принимают участие s- и p-электроны. Однако связи, образованные с их участием, равноценны и расположены симметрично.
Для объяснения этого факта применяется представление о гибридизации атомных орбиталей.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Объясните механизм образования ионов: H3O+, BF4–.
2.Какие из известных вам типов химических связей не представлены в данном разделе? Что вы о них знаете?
3.Выберите из списка вещества, в молекулах которых имеется ковалентная неполярная связь: PCl5, CH4, H2, CO2, O2, S8, SCl2, SiH4.
4.Выберите из списка перечисленных ниже веществ те, в молекулах которых имеется ковалентная полярная связь: O3, P2O5, P4, H2SO4, CsF, HF, HNO3, H2.
5.Как меняется полярность связи в ряду HCl — H2S — PH3? Ответ обоснуйте.
6.Определите тип связи и укажите направление смещения по связи электронов в следующих веществах: а) оксид натрия, бромоводород, бромид калия, оксид брома(I), бром; б) фторид лития, литий, фтор, фторид кислорода; в) ортофосфорная кислота, ортофосфат калия, оксид фосфора(V), фосфор.
7.Могут ли быть две σ-связи: а) между двумя атомами; б) у одного из атомов в бинарном соединении?
8.Определите число σ- и π-связей в каждой из молекул: а) SF6, SO3, SO2F2, SO2, SOF2; б) PCl5, P2O5, POCl3, PSCl3, NOCl.
9.Выберите вещества, в молекулах которых содержится: а) двойная связь; б) тройная связь: C2H2, C2H6, C2H4, S2, NH3, CO2, H2S, CH4, N2.
33
