
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
Глава 9
Амины
§49. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ
ИПОЛУЧЕНИЕ АМИНОВ
Общие сведения об аминах
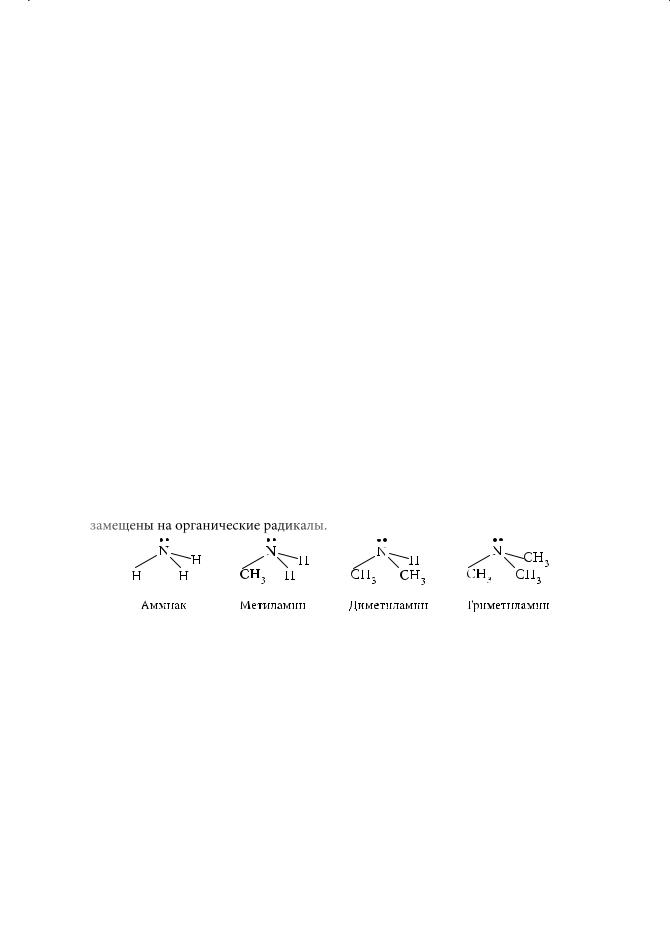
Органические амины — производные аммиака, где один или несколько атомов водорода замещены на органические радикалы.
В зависимости от степени замещенности амины подразделяются на первичные, вторичные, третичные, а также на четвертичные аммониевые соли или основания:
Первичный |
Вторичный |
Третичный |
Четвертичная |
|
|
|
аммониевая соль |
С2Н5NH2 |
(C2H5)2NH |
(C2H5)3N |
[(C2H5)4N]+Cl– |
Этиламин |
Диэтиламин |
Триэтиламин |
Хлорид тетраэтиламмония |
Глава 9. Амины
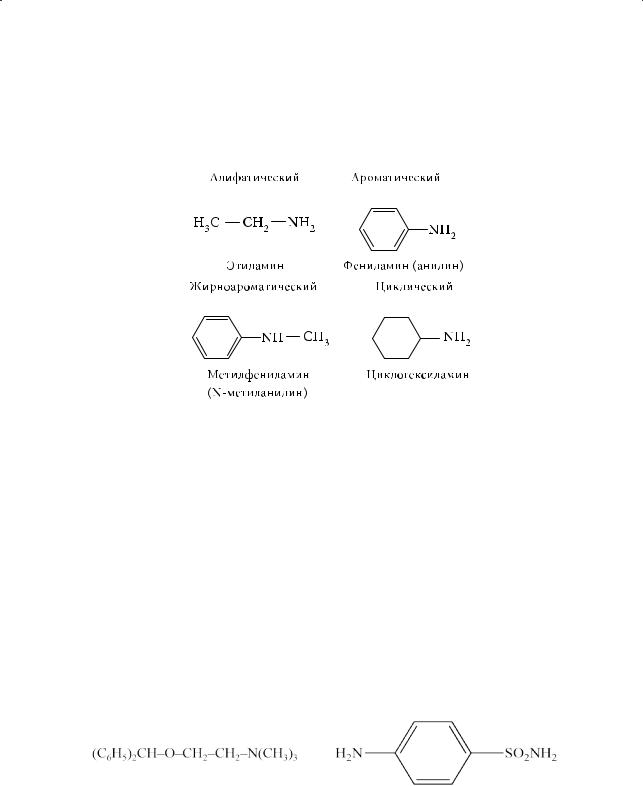
Другой признак классификации аминов — тип углеводородного радикала, связанного с атомом азота. В зависимости от природы радикала амины могут быть подразделены на алифатические (предельные и непредельные), алициклические, ароматические и амины смешанного ряда (жирноароматические):
Амины, содержащие в составе молекулы две и более аминогруппы, в названии имеют приставки «ди-», «три-» и т. д. Например, этилендиамин (1,2-ди- аминоэтан), гексаметилендиамин (1,6-диаминогексан):
H2N–CH2–CH2–NH2 |
H2N–CH2–(CH2)4–CH2–NH2 |
Этилендиамин |
Гексаметилендиамин |
Амины в природных объектах. Биологические функции аминов
Низшие алифатические амины образуются при разложении белков; диметил- и триметиламины сопровождают гниение рыбы, а в гниющем мясе найден 1,4-диаминобутан — путресцин (от англ. putrescence — гниение).
Многие амины обладают заметным биолого-фармакологическим действием. Производное третичного амина димедрол снимает спазмы бронхиальных мышц, снижает нервные стрессы. Производным ароматического амина является сильное бактерицидное средство стрептоцид:
Димедрол |
Стрептоцид |
298
§ 49. Классификация, номенклатура, изомерия и получение аминов
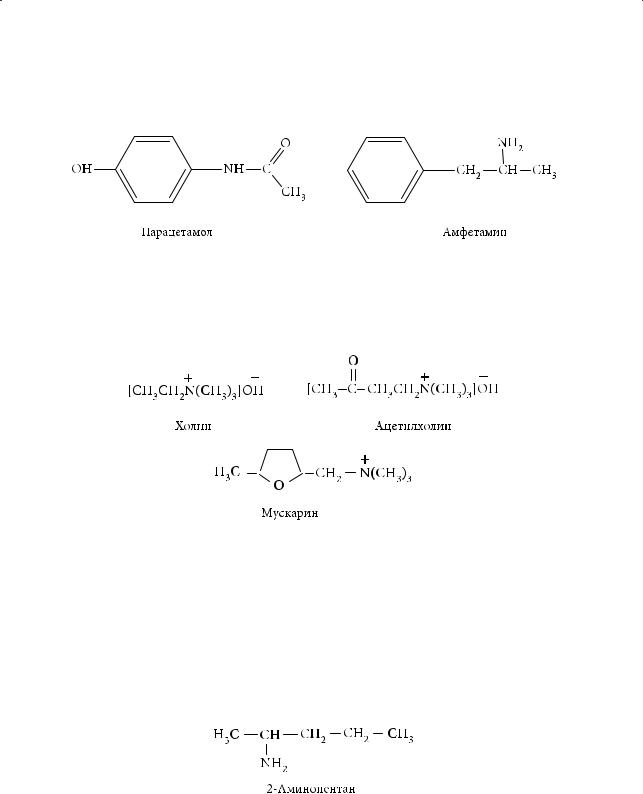
Обезболивающим эффектом обладает п-ацетаминофенол (парацетамол), возбуждающим — амфетамин:
В клетках нервных узлов содержатся холин и ацетилхолин — четвертичные аммониевые основания, участвующие в передаче нервных импульсов; из мухомора выделено биологически активное вещество, алкалоид мускарин, также являющееся также производным четвертичного аммониевого основания:
Четвертичные соли аммония применяются в производстве некоторых мыл и антисептических средств.
Номенклатура, гомология и изомерия аминов
Номенклатура аминов. По номенклатуре IUPAC название амина составляют из слова «амино» и названия алкана, которому соответствует самая длинная цепочка, с указанием номера углеродного атома, при котором расположена группа NH2. Например:
299
Глава 9. Амины
По рациональной номенклатуре сначала в алфавитном порядке называются радикалы, а затем добавляется слово «амин». Соответственно, вторичный амин, содержащий метильную и этильную группы, имеет название «метилэтиламин»:
H3C — NH — C2H5
Метилэтиламин
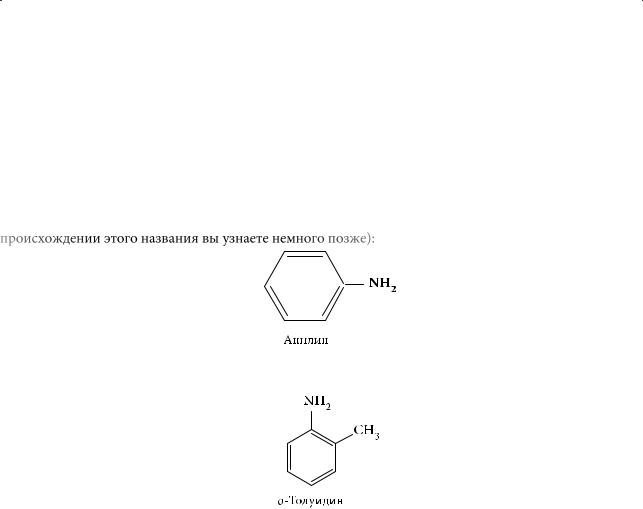
Простейший ароматический амин называют фениламином, или анилином (о происхождении этого названия вы узнаете немного позже):
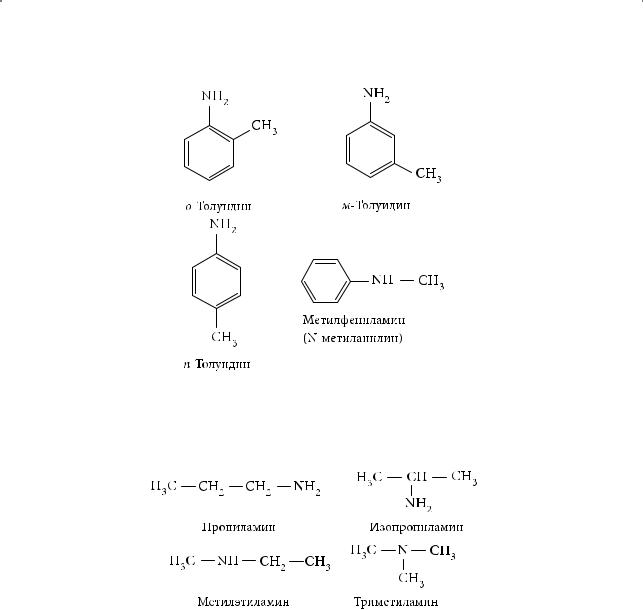
Для ближайших гомологов анилина обычно используют тривиальные названия, например орто-толуидин:
Гомологические ряды предельных алифатических и ароматических аминов. Простейшим амином является метиламин СН3NH2 — органическое производное аммиака, в молекуле которого один водородный атом замещен на метильный радикал. Последующие члены этого ряда отличаются по составу от предыдущих на гомологическую разность СН2: этиламин СН3СН2NH2, пропиламин СН3СН2СН2NH2 и т. д. Общая формула предельных алифатических аминов — СnH2n+3N. Если амин первичный, общую формулу можно записать в виде CnH2n+1NH2. Общая формула ароматических аминов — СnH2n–7NH2.
Простейший первичный ароматический амин — анилин С6Н5–NH2. Следующий представитель гомологического ряда, отличающийся по составу от анилина на группу СН2, имеет три изомера (о-, м-, п-толуидины), которые различаются взаимным положением метильной группы и аминогрупп в бензольном кольце. Все они являются первичными ароматическими аминами. Четвертый изомер того же состава, метилфениламин, относится к аминам жирноароматического ряда. Это вторичный амин.
300
§ 49. Классификация, номенклатура, изомерия и получение аминов
Изомерия аминов. Начиная с этиламина, имеет место изомерия: составу C2H8N соответствуют этиламин (первичный) и диметиламин (вторичный). Формуле состава C3H9N могут соответствовать следующие амины:
Физические свойства аминов
Низшие амины алифатического ряда — газы (метиламин, этиламин, диметил- и триметиламины) либо низкокипящие жидкости с характерным запахом, напоминающим запах аммиака. Метиламин имеет температуру кипения –6,5 °С, диметиламин — несколько выше, как и полагается веществу с большей молекулярной массой (+7,4 °С), а вот триметиламин, несмотря на бóльшую молекулярную массу, кипит ниже, чем вторичный амин (+3,5°С). Это объясняется отсутствием в молекуле третичного амина атомов водорода при атоме азота,
301
Глава 9. Амины
т. е. невозможностью для него образовывать межмолекулярные ассоциаты посредством водородных связей.
Высшие гомологи алифатических и ароматических аминов — жидкости или твердые вещества с высокими температурами кипения. Низшие амины хорошо растворяются в воде. По мере увеличения числа углеродных атомов
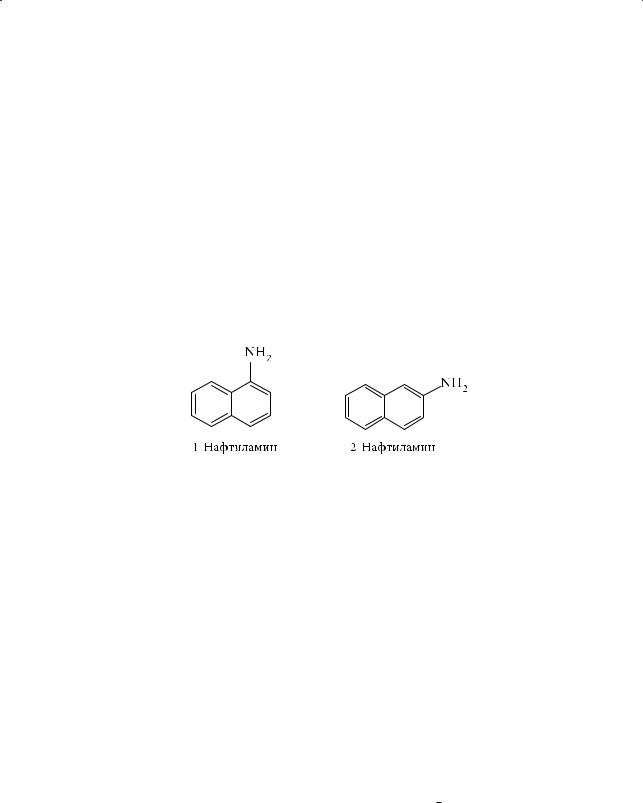
валкильных радикалах растворимость аминов падает. Важнейшим ароматическим амином является анилин — бесцветная высококипящая (184,4 °С) жидкость с характерным запахом, практически нерастворимая в воде, токсичная, при стоянии на воздухе приобретающая желто-коричневый цвет вследствие легкости окисления. К ароматическим аминам относятся толуидины и нафтиламины — бесцветные кристаллические соединения, подобно анилину легко окисляющиеся на воздухе и изменяющие цвет, плохо растворимые
вводе, токсичные; 2-нафтиламин является сильным канцерогеном.
Получение аминов
Основными методами получения аминов являются алкилирование аммиака и органических аминов, а также восстановление нитросоединений и нитрилов. Рассмотрим их подробнее.
1.Взаимодействие аммиака или аминов с алкилгалогенидами (алкилирование по Гофману)
Хотя данный метод прост и доступен, взаимодействие аммиака или пер-
вичных аминов с алкилгалогенидами приводит к образованию смеси продуктов: первичных, вторичных, третичных аминов и четвертичных аммониевых солей. Для получения преимущественно первичных аминов необходимо использовать избыток аммиака. В противном случае образуется соль алкиламмония:
СH3Cl + NH3 → [CH3NH3]+Cl–; CH3Cl + 2NH3 → CH3NH2 + NH4Cl.
302

§49. Классификация, номенклатура, изомерия и получение аминов
Николай Николаевич Зинин (1812–1880)
Русскийхимик-органик,профессорКазанскогоуниверсите- та, Медико-хирургической академии в Петербурге; академик Петербургской академии наук; организатор и первый президент Русского химического общества. В 1842 году открыл реакцию восстановления ароматических нитросоединений, послужившую основой новой отрасли химической промышленности — анилинокрасочной. Н.Н.Зинин — основатель школы русских химиков; в числе его учеников А.М.Бутлеров, Н.Н.Бекетов, А.П.Бородин и др.
Превращение третичных аминов в четвертичные аммониевые соли открыто Н. А. Меншуткиным в 1890 году. Реакцию проводят обычно в растворе спирта, ацетонитрила или нитрометана:
2.Получение аминов в реакциях восстановления
Первичные амины можно получить путем каталитического гидрирования нитрилов:
CH3–C  N + 2H2 Pt
N + 2H2 Pt CH3–CH2–NH2.
CH3–CH2–NH2.
Другим методом синтеза алифатических и ароматических аминов является восстановление нитропроизводных алифатических или ароматических углеводородов. Для получения алифатических аминов этот способ применяется редко, для ароматических он является основным. Реакция открыта в 1842 году профессором Казанского университета Н. Н. Зининым (реакция Зинина). В качестве восстановителя Зинин использовал сульфид аммония:
С6H5–NO2 + 3(NH4)2S → C6H5–NH2 + 3S↓+ 6NH3↑+ 2H2O.
Впоследствии выяснилось, что восстановление можно проводить железными стружками или оловом в присутствии соляной кислоты:
С6H5–NO2 + 6H Fe, HCl C6H5–NH2 + 2H2O.
303
Глава 9. Амины
либо алюминием или цинком в растворе щелочи. Восстановление осуществляется атомарным водородом, который является гораздо более сильным восстановителем, чем молекулярный. Подобный активный водород называют водородом в момент выделения.
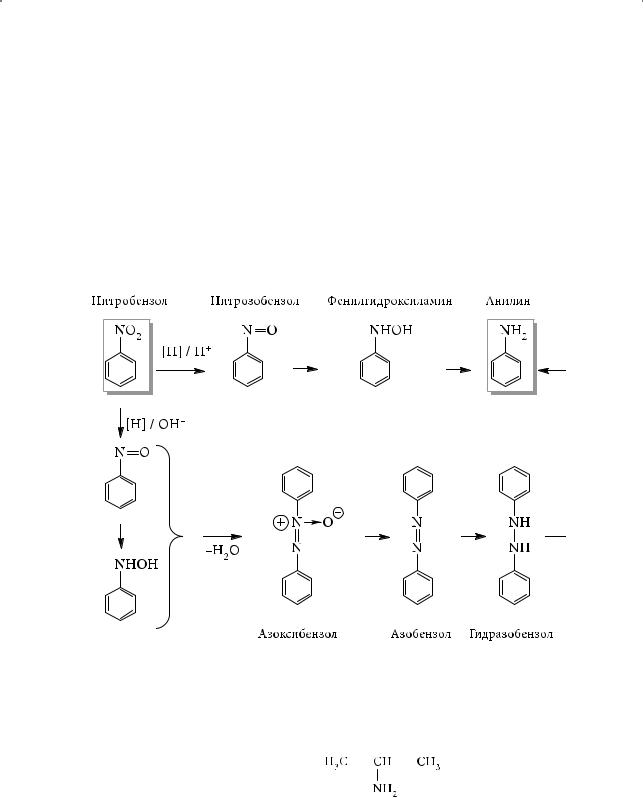
Таким образом, переход от нитробензола к анилину возможен как в кислой, так и в щелочной среде. В щелочной среде восстановление идет через промежуточное образование нитрозобензола C6H5–N=O и фенилгидроксиламина C6H5NHOH. В кислой среде взаимодействие первоначально образующихся нитрозобензола и гидроксиламина приводит к азоксибензолу, далее к азобензолу C6H5–N=N–C6H5 и гидразобензолу C6H5–NH–NH–C6H5. Последний при нагревании и образует анилин:
ВОПРОСЫ И УПРАЖНЕНИЯ
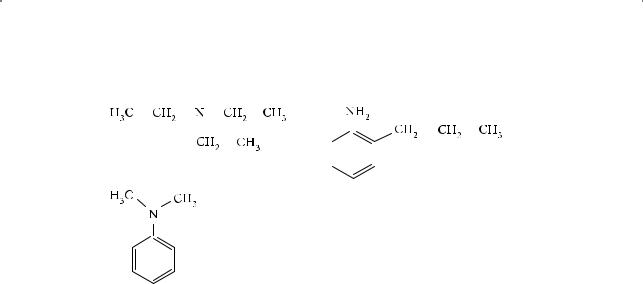
1.Назовите по номенклатуре IUPAC следующие амины:
а) H3C — CH2 — NH2 |
б) |
|
|
|
в) CH3 — NH — CH3 |
|
|
|
304
§ 49. Классификация, номенклатура, изомерия и получение аминов
г) H2N — CH2 — CH2 — CH3 |
д) H3C — NH — CH2 — CH3 |
|||||||||||||||||
е) |
|
|
|
|
|
|
|
|
|
|
ж) |
|||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з) |
и) H2N — CH2 — CH2 — NH2 |
2.Напишите структурные формулы всех изомерных первичных аминов состава С4H11N и назовите их.
3.Определите по молекулярным формулам, к каким гомологическим рядам можно
отнести следующие соединения: С3H8, C3H6, C3H4, C3H8O, C3H6O, C3H6O2, C3H9N. Какие из формул могут принадлежать веществам различных классов и почему? Напишите структурные формулы всех возможных изомеров азотсодержащего вещества и назовите их.
4.Составьте формулы следующих веществ: а) диэтиламина; б) втор-бутиламина;
в) п-нитроанилина;
г) изобутилфениламина.
5.Всегда ли по наличию аминогруппы в молекуле органического соединения его можно отнести к классу аминов? Свой ответ аргументируйте.
6.Почему третичные амины, несмотря на бóльшую молекулярную массу по сравнению с первичными и вторичными аминами, имеют меньшие температуры кипения?
7.Предложите метод синтеза м-броманилина из бензола и неорганических реагентов.
8.Укажите условия и реагенты для осуществления следующих превращений:
а) |
бутадиен-1,3 → А → В → этиламин; |
б) |
этан → А → В → этанол; |
в) |
ацетилен → А → В→ анилин. |
9.Выведите молекулярную формулу амина, если его элементный состав таков: массовая доля углерода — 78,50 %, азота — 13,08 %, водорода — 8,41 %. Напишите структурные формулы четырех возможных изомеров этого соединения и назовите его.
305
