
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

§ 46. Химические свойства глюкозы и ее получение
формулы Фишера для всех 16 стереоизомеров глюкозы, отметим, что они образуют 8 пар оптических антиподов. Из двух антиподов в природе встречается только тот, который относится к D-ряду. Остальные стереоизомерные гексозы получены синтетически. Если два стереоизомера различаются расположением всех групп Н и ОН (например, L-глюкоза и D-глюкоза), они являются энантиомерами. Физические и химические свойства энантиомеров одинаковы. Они различаются только знаком вращения плоскости поляризации света. Однако для стереоизомеров, входящих в состав разных антиподных пар (например, глюкоза и галактоза), физические константы различны. Например, температура плавления D,L-глюкозы составляет 146°С, а D,L-галактозы — 164°С.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Приведите уравнения химических реакций, в которых глюкоза проявляет свойства альдегидов.
2.С помощью каких химических реакций можно доказать наличие в молекуле глюкозы: альдегидной группы; пяти гидроксильных групп; нормальной цепи углеродных атомов?
3.Какие типы изомерии характерны для класса углеводов?
4.Что такое таутомерия и чем она обусловлена в случае моносахаридов?
5.Стереоизомеры подразделяют на конформеры и конфигурационные изомеры. В свою очередь, последние подразделяется на энантиомеры и диастереомеры. Приведите соответствующие примеры стереоизомеров в ряду углеводов.
6.Из перечисленных соединений выберите те, в молекулах которых имеется асимметрический атом углерода: ацетилхлорид, молочная кислота, бутен-2, этанол. Составьте структурные формулы этих соединений, отметив знаком «*» асимметрический углеродный атом, запишите формулы энантиомеров в виде тетраэдрических моделей.
§ 46. ХИМИЧЕСКИЕ СВОЙСТВА ГЛЮКОЗЫ И ЕЕ ПОЛУЧЕНИЕ
Химические свойства глюкозы
Наличие в молекуле глюкозы альдегидной и гидроксильных функциональных групп обеспечивает ей свойства альдегидов и спиртов: способность вступать в реакции восстановления, окисления, образовывать простые и сложные эфиры, взаимодействовать с гидроксидом меди(II) и др.
1.Реакции, характерные для альдегидной группы
Восстановление. Альдегидная группа глюкозы может восстанавливаться
до спиртовой с образованием шестиатомного спирта сорбита:
279

Глава 8. Углеводы
Сорбит — кристаллическое вещество, сладкое на вкус (вдвое слаще сахара) — впервые был выделен в 1872 году французским химиком Ж. Бруссино из листьев рябины (лат. sorbus — рябина). Сорбит сладок и нетоксичен, используется в питании диабетиков, является промежуточным продуктом при получении аскорбиновой кислоты из глюкозы в промышленности.
Окисление. Глюкоза окисляется аммиачным раствором оксида серебра (реактив Толленса) и свежеосажденным гидроксидом меди(II) (реактив Фелинга) в щелочной среде, восстанавливая ионы Ag+ до металлического серебра и ионы Cu2+до ионов Cu+. Углеводы подобного типа называют восстанавливающими:
HOCH2(CHOH)4CHO + 2Сu(OH)2 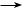 HOCH2(CHOH)4COOH + Cu2O↓+ 2H2O.
HOCH2(CHOH)4COOH + Cu2O↓+ 2H2O.
глюконовая кислота
Образующееся соединение, называемое глюконовой кислотой, в щелочной среде неустойчиво и подвергается реакциям изомеризации и деструкции углеродного скелета.
Окисление глюкозы бромной водой (мягкое окисление) в нейтральной среде позволяет выделить глюконовую кислоту:
Окисление глюкозы разбавленной азотной кислотой (жесткое окисление) приводит к образованию двухосновной глюкаровой кислоты, в молекуле которой первый и шестой углеродные атомы окислены до карбоксильных групп:
280
§ 46. Химические свойства глюкозы и ее получение
Структура углеродного скелета при этом не претерпевает изменений.
Реакции нуклеофильного присоединения (присоединение по карбонильной группе). В качестве примера рассмотрим взаимодействие глюкозы с синильной кислотой:
2.Реакции с участием гидроксильных групп
Образование глюкозидов. При действии метилового спирта в присут-
ствии газообразного хлороводорода образуется (с участием гликозидного гидроксила) простой эфир — метилглюкозид:
Полученное органическое соединение уже не способно вступать в реакцию «серебряного зеркала», поскольку отсутствие свободной, незамещенной гидроксильной группы при первом углеродном атоме делает невозможным равновесие между циклической и открыто-цепной формой. Подобного типа сахара называют невосстанавливающими.
281
Глава 8. Углеводы
Большинство моносахаридов редко встречаются в свободном виде. В природе они обнаруживаются в основном в виде гликозидов, т. е. связаны с остатками других моносахаридов, фенолов, спиртов и т. д.
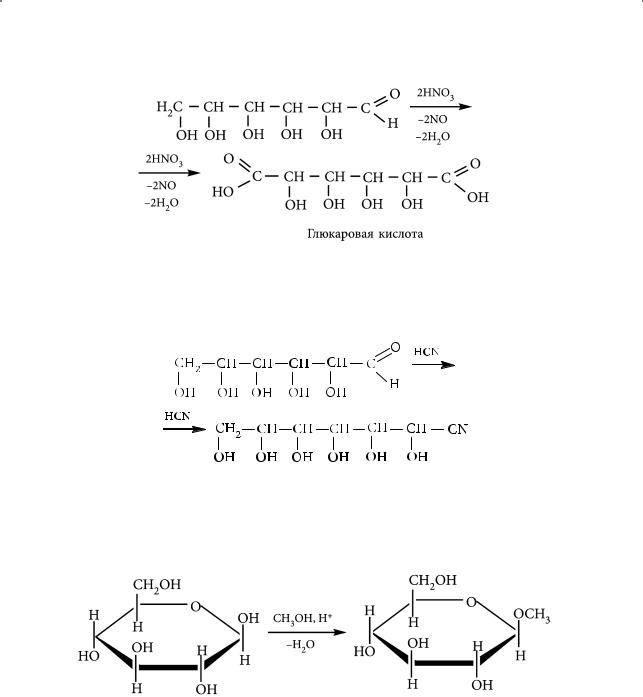
Образование простых и сложных эфиров. Простые эфиры образуются при взаимодействии избытка алкилгалогенидов со спиртами:
Сложные эфиры глюкозы могут быть получены при взаимодействии глюкозы с карбоновыми кислотами и ее функциональными производными: ангидридами и галогеноангидридами кислот. При избытке ацилирующего агента все спиртовые группы молекулы глюкозы переходят в сложноэфирные:
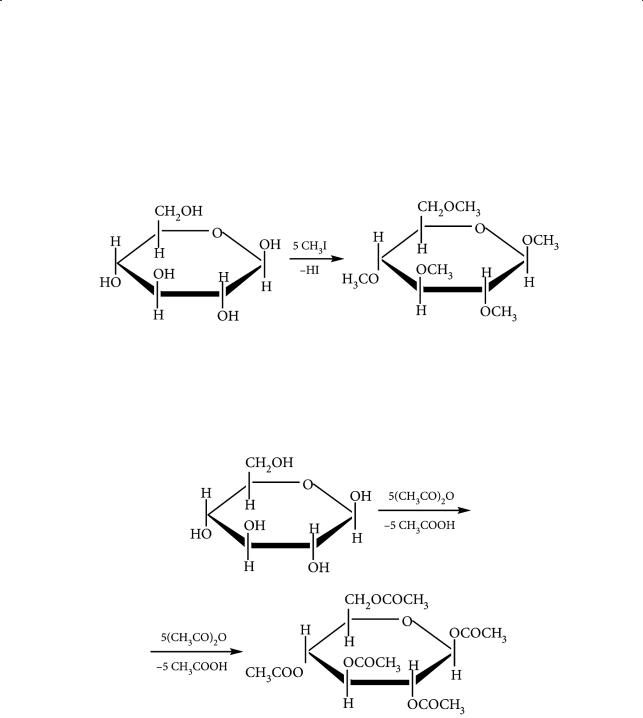
Взаимодействие с гидроксидом меди(II). Являясь многоатомным спиртом, глюкоза растворяет гидроксид меди(II) с образованием комплекса яр- ко-синего цвета (качественная реакция на многоатомные спирты):
282
§ 46. Химические свойства глюкозы и ее получение
3.Брожение глюкозы
Брожение — процесс разложения глюкозы под действием микроорганизмов или ферментов, сопровождающийся расщеплением углеродных связей с выделением углекислоты. Различают спиртовое, молочнокислое и маслянокислое брожение.
Спиртовое брожение глюкозы осуществляется под действием дрожжевых ферментов:
C6H12O6 ферменты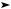 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
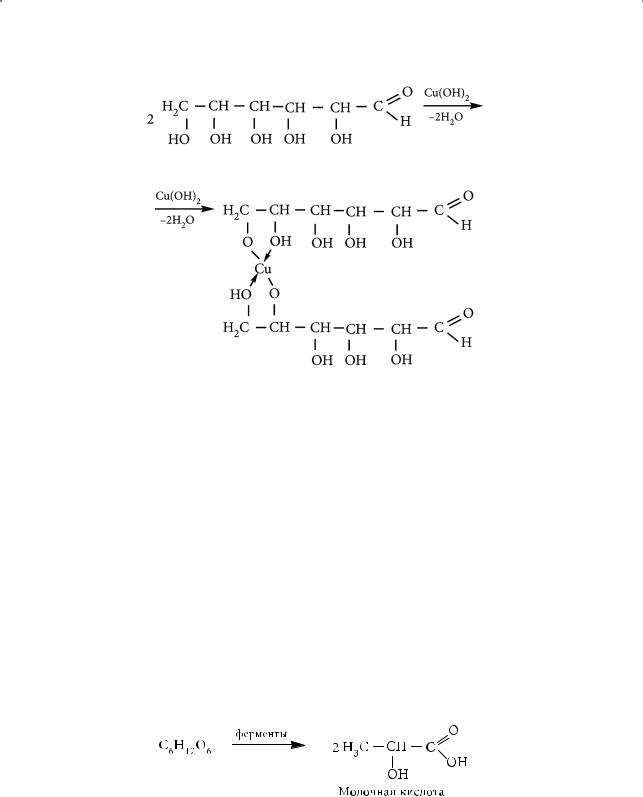
Молочнокислое брожение глюкозы с образованием молочной кислоты происходит под влиянием ферментов молочнокислых бактерий и используется в пищевой промышленности:
283
Глава 8. Углеводы
Маслянокислое брожение глюкозы приводит к образованию масляной кислоты:
Химические свойства фруктозы
Химические свойства фруктозы определяются типом функциональных групп, содержащихся в ее молекуле, — кетонной и спиртовых. Фруктоза вступает в реакции, характерные для кетонов (восстановление, взаимодействие с HCN, со спиртами, гидразином и его производными и т. д.) и многоатомных спиртов (с галогеноводородами, образует простые и сложные эфиры, взаимодействует с Cu(OH)2). По сравнению с глюкозой фруктоза труднее окисляется. Отличить фруктозу от глюкозы можно реакцией с бромной водой: фруктоза в эту реакцию не вступает.
Подобно глюкозе рибоза и дезоксирибоза могут окисляться и восстанавливаться, вступать в реакции с образованием простых и сложных эфиров.
Биологическое значение моносахаридов
Глюкоза — наиболее распространенный и важный моносахарид. Она обнаружена в соке винограда (отсюда еще одно название глюкозы — виноградный сахар), других ягод и фруктов, является структурным звеном ди- и полисахаридов, например сахарозы, клетчатки и крахмала. В крови взрослого человека содержится около 6 г глюкозы, которая полностью расходуется в течение 15 мин. Этот запас организм постоянно пополняет. Содержание глюкозы в крови регулирует гормон инсулин. При возрастании количества глюкозы увеличивается и выработка организмом инсулина. Если же такой механизм дает сбой, то говорят о серьезном заболевании — сахарном диабете. Из глюкозы в печени некоторых животных под действием ферментов синтезируется аскорбиновая кислота — первый из известных водорастворимых витаминов. Отсутствие в пище этого соединения вызывает цингу, с чем связано название указанной кислоты (греч. а — не + лат. scorbutus — цинга).
Во всех живых организмах углеводы выполняют роль «топлива», при окислении которого выделяется энергия, необходимая для осуществления жизненно важных функций. Так, при окислении глюкозы в организме выделяемая энергия расходуется на поддержание температуры тела, синтез белков и т. д.
284

§ 46. Химические свойства глюкозы и ее получение
С6Н12О6 + 6О2 → 6СО2 + 6Н2О + 2884 кДж/моль.
Глюкоза образуется в процессе фотосинтеза из углекислого газа и воды:
6СO2 + 6H2O + 2920 кДж hν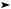 C6H12O6 + 6O2.
C6H12O6 + 6O2.
Фотосинтез — энергетическая основа биологических процессов. Запасание солнечной энергии происходит в удобной для биологического использования форме — молекулярной, в богатых энергией связях, в основном в сахарах
иих производных.
Впромышленности глюкозу получают гидролизом крахмала или целлюлозы:
(C6H10O5)n + nH2O H+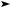 nC6H12O6.
nC6H12O6.
Фруктоза (плодовый сахар) — кристаллическое вещество, температура плавления которого составляет 102–104°С, сладкое на вкус, хорошо растворимое в воде, содержится в различных фруктах, плодах, пчелином меде, входит в состав ди- и полисахаридов, сока многих плодов, является ценным питательным продуктом. Фруктоза имеет более сладкий вкус, чем глюкоза и сахароза. По шкале «сладости» фруктозе соответствует 178 единиц, сахарозе — 100, глюкозе — 74.
Пентозы достаточно широко распространены в природе, где обычно существуют в циклической форме. Рибоза и дезоксирибоза в виде N-гликозидов с пуриновыми и пиримидиновыми основаниями входит в состав нуклеиновых кислот (ДНК и РНК).
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Почему глюкоза, являясь альдегидоспиртом, не вступает в реакцию с гидросульфитом натрия?
2.В трех склянках без этикеток находятся растворы глюкозы, глицерина и ацетальдегида. Как различить эти соединения с помощью одного реактива?
3.Как при помощи одного реактива распознать растворы следующих веществ: уксусной кислоты, пропаналя, глюкозы, глицерина, метанола? Напишите уравнения соответствующих реакций.
4.Шестиатомный спирт сорбит может быть получен восстановлением различных гексоз. Запишите уравнения соответствующих реакций и назовите исходные соединения.
5.Какой объем воды и какую массу 10%-ного раствора фруктозы необходимо взять для получения 2%-ного раствора фруктозы массой 200 г?
285
