
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
§ 2. Классификация органических соединений
8.Массовая доля углерода в некотором углеводороде составляет 84 %. Его пар в 3,125 раз тяжелее кислорода. Определите молекулярную формулу углеводорода и составьте структурные формулы соответствующих изомеров. Дайте им названия.
§ 2. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
При классификации органических соединений учитывают особенности углеродного скелета молекулы, выделяя две большие группы органических веществ: соединения с открытой цепью — алифатические (от греч. aleiphatos — масло, смола, жир) и соединения с замкнутыми (циклическими) структурами — циклические.
Циклические соединения подразделяются на карбоциклические (циклы построены только из атомов углерода) и гетероциклические (наряду с атомами углерода в циклах содержатся также атомы азота, кислорода или серы).
Карбоциклические подразделяют на алициклические (алифатические циклические) и ароматические, имеющие в составе молекул устойчивую циклическую группировку атомов с особым типом связей.
Классификация углеводородов
Углеводороды — вещества, молекулы которых образованы только атомами углерода и водорода СxHy. Они подразделяются на алифатические и циклические.
Валифатических углеводородах углеродные атомы в молекулах связаны
воткрытые (разветвленные и неразветвленные) цепи.
Углеводороды с открытой углеродной цепью называют еще ациклическими (греч. а — не).
Углеводороды с замкнутой в цикл цепью — циклические — могут быть алициклическими (алифатическими циклическими) и ароматическими (рис. 1.2).
Формулы циклических углеводородов можно записывать в виде правильных многоугольников. В вершине каждого угла подразумевается наличие атома углерода. Атомы водорода не обозначаются, но их столько, сколько требуется для полного насыщения четырех валентностей каждого углеродного атома.
Если молекулы углеводородов содержат только одинарные связи, их называют предельными или насыщенными. Если в составе молекул углеводородов имеются кратные связи (двойные или тройные), их называют непредельными
или ненасыщенными.
Основными классами алифатических углеводородов являются алканы,
алкены, алкины и алкадиены (рис. 1.3).
19

Глава 1. Введение в органическую химию |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Углеводороды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алифатические |
|
|
|
|
|
|
|
|
|
|
Алициклические |
|
|
|
|
|
|
|
|
|
|
|
Ароматические |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
CH |
|
|
|
CH |
|
|
|
|
CH3 |
|
|
|
|
CH3 |
H |
2C |
|
|
|
CH |
|
|
|
CH3 |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
||||||||||
H3C |
|
|
|
|
CH |
|
|
|
|
CH |
|
|
|
|
CH3 |
|
|
|
|
CH3 |
H2C |
|
|
|
|
CH |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH3 |
|
|
|
|
|
|
||||||||||||||||||||||||||||
HC |
|
|
|
|
|
C |
|
|
CH2 |
|
|
|
|
H2C |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
или |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
|
CH2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
H3C |
|
|
|
|
CH2 |
|
|
|
CH2 CH3 |
|
CH2 |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Рис. 1.2. Схема классификации углеводородов в зависимости от строения углеродной цепи
В молекулах алканов все связи одинарные (σ-связи); в молекулах алкенов присутствует одна двойная (σ + π) связь, остальные — одинарные; в молекулах алкинов — одна тройная (σ + 2π), остальные — одинарные; в молекулах диенов — две двойные связи (остальные — одинарные), приставка «ди-» указывает на наличие двух двойных связей.
Алифатические углеводороды
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРЕДЕЛЬНЫЕ |
|
|
|
|
|
|
|
|
|
|
НЕПРЕДЕЛЬНЫЕ |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алканы |
|
|
|
Алкены |
|
|
|
Алкины |
|
|
Алкадиены |
||||||||||||||||||||
H3C |
|
CH2 |
|
|
CH3 H2C |
|
CH |
|
CH3 |
|
HC |
|
C |
|
|
CH3 |
H2C |
|
C |
|
CH2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
Пропан |
|
|
|
|
Пропен |
|
|
Пропин |
|
Пропадиен |
||||||||||||||||||||
Рис. 1.3. Схема классификации углеводородов в зависимости от наличия одинарных или кратных связей
20

§ 2. Классификация органических соединений
Суффикс в названии углеводорода указывает на принадлежность к тому или иному классу углеводородов (алкан, алкен, алкин).
Молекулы циклических углеводородов также могут содержать кратные связи. Особый класс составляют ароматические углеводороды (арены).
Классификация кислородсодержащих органических соединений
Принадлежность к определенному классу органических соединений определяется наличием конкретной функциональной группы.
Функциональная группа — группа химически связанных атомов, определяющая свойства того или иного класса органических веществ.
Среди различных кислородсодержащих функциональных групп наиболее распространены следующие:
|
|
|
|
|
|
|
|
O |
|
|
OH |
C |
|
O |
|
|
C |
|
|
|
|
|
||||
|
|
|
|
|
OH |
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
Гидроксильная группа |
Карбонильная группа |
Карбоксильная группа |
||||||
(гидрокси-) |
(карбонил) |
|
(карбокси-) |
|||||
Основные классы кислородсодержащих органических веществ представлены в табл. 1.1.
Таблица
Функциональная группа
Класс
Пример
1.1. Основные классы кислородсодержащих органических веществ
|
|
|
|
Карбонил |
|
|
Карбоксил |
|
Гидроксил |
|
|
|
O |
|
|||
|
C O |
|
|
|
||||
|
— ОН |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
OH |
|
Спирты |
|
Альдегиды |
Кетоны |
|
Карбоновые |
|
||
|
|
кислоты |
|
|||||
|
|
Пропанол-1 |
|
Пропаналь |
|
Пропанон |
Пропановаякислота |
|
H |
OH |
H |
H |
H |
||||
2 |
|
|
|
|
3 |
|
|
|
CH |
|
|
|
|
CH |
|
|
|
2 |
|
|
2 |
|
C |
|
CH |
|
CH |
|
|
CH |
|
|
|
||
|
|
|
|
|
|
|
2 |
|
C |
|
|
C |
|
3 |
|
C |
|
3 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
21
Глава 1. Введение в органическую химию
Классификация азотсодержащих органических веществ
Среди азотсодержащих органических веществ можно выделить такие классы органических веществ, как амины, нитросоединения, нитрилы и т. д. (табл. 1.2).
В молекулах нитросоединений нитрогруппа –NO2 соединена непосредственно
суглеродным атомом, а в молекулах нитроэфиров эта группа соединена с атомом углерода через кислород.
Таблица 1.2. Некоторые классы азотсодержащих органических веществ
Функциональная группа
Класс
Пример
Аминогруппа |
|
|
Нитрогруппа |
|
|
Цианогруппа |
|||
— NH2 |
|
|
— NO2 |
|
|
— C |
N |
||
Амины |
Нитросоединения |
Нитроэфиры |
Нитрилы |
||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
2 |
ONO |
|
C N |
|
CH |
Аминопропан-1 |
CH |
2 |
Нитропропан-1 |
CH |
2 |
Нитроглицерин |
Пропионитрил |
|
CH |
3 |
NO |
2 |
NOONO |
CHC |
||||
2 |
|
|
|
|
|
|
|
|
|
2 |
|
CH |
|
|
CH |
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
C |
|
C |
|
|
C |
O |
|
H |
|
|
H |
|
|
H |
|
|
|||
|
|
|
|
|
|
2 |
|
3 |
|
3 |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
Кроме перечисленных классов органических веществ существуют и другие (серо- и фосфорсодержащие, металлорганические соединения и т. д.)
В молекулах органических соединений может находиться несколько функциональных групп. Если группы одинаковы, эти соединения относят к полифункциональным; если они различны — к гетерофункциональным.
Так, молочная кислота — гетерофункциональное производное: ее молекула содержит группы –СООН и –ОН. Она может проявлять свойства как карбоновых кислот, так и спиртов:
O
H3C CH C  OH OH
OH OH
Молочная кислота
22
§ 2. Классификация органических соединений
Различные функциональные группы могут взаимно влиять друг на друга, обусловливая появление новых свойств.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Составьте структурные формулы изомеров, отвечающих молекулярной формуле
С2Н4О и принадлежащих к разным классам органических веществ. Укажите эти
классы.
2.Какие из следующих органических соединений являются моно-, а какие — по-
лифункциональными соединениями: СН3СООН — уксусная кислота; СН2(ОН)– СН(ОН)–СН2(ОН) — глицерин; H2N–CH2–COOH — аминоуксусная кислота; CH3–CH2Cl — хлорэтан; СHCl3 — хлороформ; СН3–СН(ОН)–СООН — молочная кислота. Назовите функциональные группы, входящие в состав молекул этих соединений.
3.Известно, что молекулярная формула (брутто-формула) отражает только качественный и количественный состав молекул, но не дает информации о строении органического соединения, которое для одной и той же брутто-формулы может различаться. Запишите возможные структурные формулы для соединений состава С4Н6Cl2.
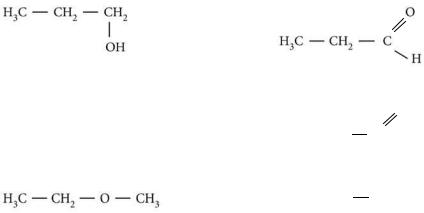
4.Найдите изомеры среди веществ, формулы которых приведены ниже. Укажите, к каким классам органических веществ они относятся:
а) |
г) |
б) H2C |
|
|
|
CH |
|
CH3 |
д) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
H3C |
|
|
CH2 |
|||
|
|
|
|
|
|
|
|
|
|||||
в) |
е) H3C |
|
|
|
C |
||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||
C
C
 OH
OH
CH3
5.При сгорании 3,6 мг некоторого углеводорода плотность паров по водороду которого равна 36, образовалось 11 мг углекислого газа и 5,4 мг воды. Установите молекулярную формулу углеводорода и составьте структурные формулы соответствующих изомеров.
23
