
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
§ 43. Сложные эфиры
Число возможных стереоизомеров (N) можно определить как N= 2n, где n — число асимметрических атомов углерода. Обратите внимание: D-, L-эритроза и D-, L-треоза соотносятся как предмет и его зеркальное изображение, вследствие чего являются энантиомерами. А вот пáры других соединений — D-эритроза и D-треоза, L-эритроза и L-треоза, D-эритроза и L-треоза, L-эритроза и D-треоза — энантиомерами не являются; их молекулы не соотносятся как предмет и его зеркальное отображение. Такие изомеры называют диастереомерами. Диастереомеры отличаются друг от друга по свойствам.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.На примере 2-гидроксипропановой кислоты обсудите явление оптической изомерии, используя понятия «энантиомеры» и «рацемическая смесь».
2.Из данного перечня выберите вещества, для которых возможна оптическая изомерия. Составьте стереохимические формулы соответствующих энантиомеров: этанола, пропанола-2, бутанола-2, 2-хлорпропионовой кислоты, 3-хлорпропио- новой кислоты, 2-фенилпропаналя.
3.Составьте проекционные формулы стереоизомеров, отвечающих следующей формуле:
Определите, к какому ряду (D- или L-) принадлежит каждый из изомеров.
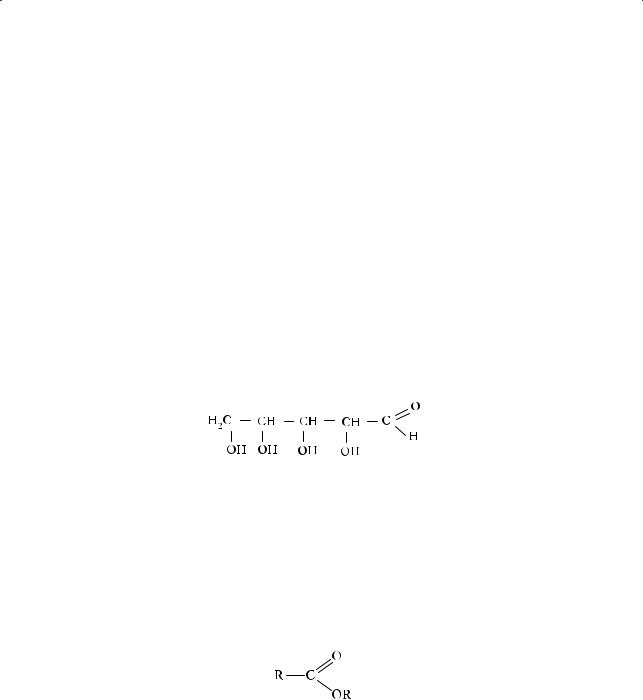
§ 43. СЛОЖНЫЕ ЭФИРЫ
Общие сведения о сложных эфирах
Сложные эфиры — функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа –ОН замещена на остаток спирта (алкоксил) –OR:
Эти вещества довольно широко распространены в природе. Они входят в состав эфирных масел растений, придавая им цветочный или фруктовый аромат. Сложные эфиры высших карбоновых кислот и высших спиртов называются восками. Пчелиный воск на 70 % состоит из сложных эфиров, главным образом пальмитиновой кислоты С15Н31СООН и миристинового спирта
257
Глава 7. Карбоновые кислоты
С14Н29ОН (нормальное строение углеродной цепи). Воск в природе является строительным материалом сотов пчелиных ульев, растительные воскоподобные вещества образуют защитную пленку на поверхности плодов и листьев.
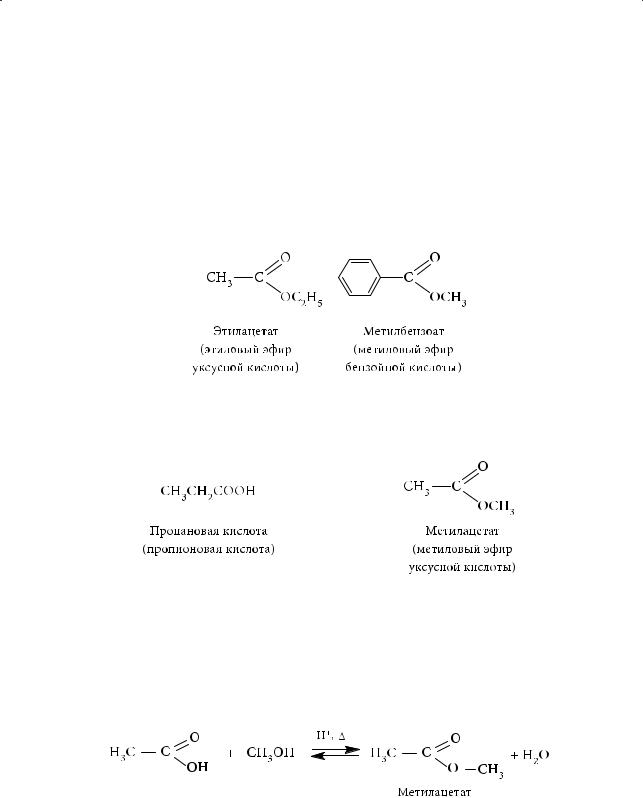
В названиях сложных эфиров указываются имена спирта и кислоты, которые участвовали в образовании данного сложного эфира. Например, этилацетат (или этиловый эфир уксусной кислоты) — сложный эфир, образованный этиловым спиртом (СН3СН2ОН) и уксусной кислотой (СН3СООН), а метилбензоат (или метиловый эфир бензойной кислоты) — эфир, образованный метиловым спиртом (СН3ОН) и бензойной кислотой (С6Н5СООН).
Для сложных эфиров характерна межклассовая изомерия: сложные эфиры изомерны карбоновым кислотам состава CnH2nO. Например, молекулярной формуле С3Н6О2 соответствуют пропановая кислота и метилацетат:
Получение сложных эфиров
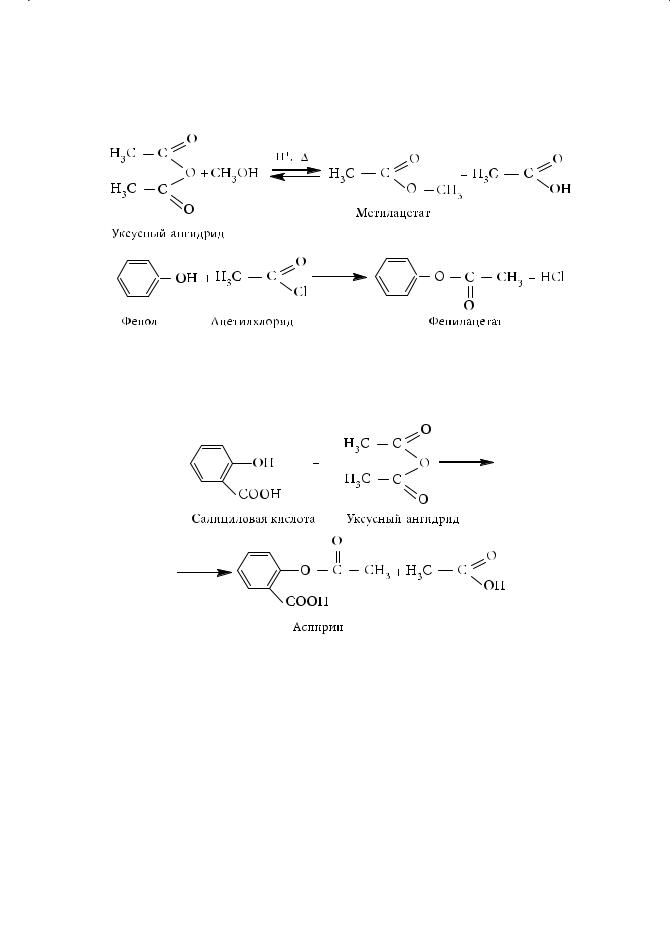
1.Реакция этерификации (взаимодействие карбоновых кислот со спир-
тами)
Поскольку данная реакция обратима, ее проводят в избытке одного из реагентов, либо равновесие смещается отгонкой образующегося эфира:
258
§ 43. Сложные эфиры
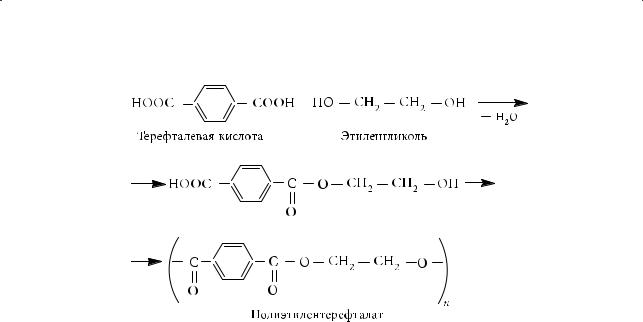
2.Взаимодействие функциональных производных карбоновых кислот
(ангидридов, амидов, галогенангидридов) со спиртами
Эта реакция — взаимодействие салициловой (2-гидроксибензойной) кислоты с уксусным ангидридом — лежит в основе получения аспирина (ацетилсалициловой кислоты):
Двухосновные кислоты и двухатомные спирты могут вступать в реакции поликонденсации. В качестве примера рассмотрим взаимодействие терефталевой (1,4-бензолдикарбоновой) кислоты с этиленгликолем. Сложный эфир, полученный из одной молекулы кислоты и одной молекулы спирта, содержит как гидроксильную, так и карбоксильную группы, следовательно он может вступать в подобную реакцию дальше. В результате получается полимерный продукт полиэтилентерефталат, который относится к группе сложных полиэфиров:
259
Глава 7. Карбоновые кислоты
Физические свойства сложных эфиров
Сложные эфиры представляют собой в основном достаточно летучие бесцветные жидкости, нерастворимые в воде и обладающие сравнительно невысокими температурами кипения. Два последних свойства обусловлены отсутствием у сложных эфиров межмолекулярных водородных связей, в отличие от спиртов и кислот, из которых они образованы. Они легко смешиваются с неполярными органическими растворителями. Сложные эфиры низших карбоновых кислот и низших спиртов имеют ароматные фруктовые запахи, например:
—метиловый эфир масляной кислоты имеет аромат яблок;
—этиловый эфир масляной кислоты — аромат ананасов;
—пентиловый эфир муравьиной кислоты — аромат вишни;
—изопентиловый эфир муравьиной кислоты — аромат слив;
—изопентиловый эфир уксусной кислоты — аромат груш;
—пентиловый эфир уксусной кислоты — аромат бананов.
Химические свойства сложных эфиров
1.Гидролиз
Наличие поляризованной карбонильной группы активирует связь C–O–R, и она легко разрывается. Расщепление сложных эфиров под действием воды называется гидролизом или омылением. Реакция кислотного гидролиза сложных эфиров обратима:
260
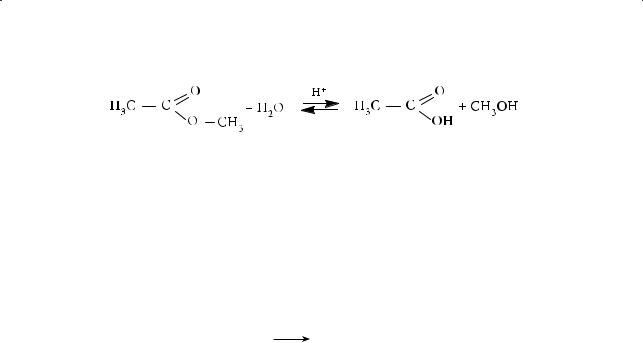
§ 43. Сложные эфиры
Реакция щелочного гидролиза необратима и протекает с образованием соли карбоновой кислоты и спирта:
СН3СООСН3 + NaOH → CH3COONa + CH3OH
метилацетат |
ацетат натрия метанол |
2.Реакция восстановления
Сложные эфиры могут быть восстановлены до соответствующих первич-
ных спиртов с использованием алюмогидрида лития или натрия в изопропиловом спирте:
С6Н5–СООСН3 LiAlH4 C6Н5СН2ОН + СН3ОН
метилбензоат |
бензиловый |
метанол |
|
спирт |
|
3.Реакция переэтерификации
Реакция переэтерификация заключается во взаимодействии сложного
эфира со спиртом. В реакции происходит обмен спиртовыми радикалами с образованием новых сложного эфира и спирта:
С6Н5СООСН3 + С2Н5ОН → С6Н5СООС2Н5 + СН3ОН
метилбензоат |
этанол |
этилбензоат |
метанол |
Сложные эфиры в быту и промышленности
Сложные эфиры малотоксичны, и это свойство определяет их применение в пищевой и парфюмерной промышленности в качестве отдушек и усилителей запаха.
Сложные эфиры (главным образом эфиры уксусной кислоты) являются прекрасными растворителями органических веществ и полимеров. В первой половине XX века практическое использование нашли полимеры метилового эфира метакриловой кислоты. В Германии был запатентован промышленный способ производства нового материала под названием «плексиглас». Этот материал стоек и прозрачен, хорошо окрашивается и проявляет устойчивость к ультрафиолетовому облучению. Из него изготавливают органическое стекло, которое легче обычного стекла и к тому же не бьется. Акриловая кислота была впервые синтезирована в 1843 году, а позднее нашли применение ее эфиры, способные полимеризоваться.
261

Глава 7. Карбоновые кислоты
Из винилацетата — сложного эфира уксусной кислоты и непредельного винилового спирта — в результате процесса полимеризации был получен поливинилацетат. Сложные эфиры двухосновных кислот используются в качестве пластификаторов, т. е. добавок, придающих полимерным материалам пластичность, морозостойкость, расширяющих интервал их высокоэластичного состояния. Пластификаторы применяют в производстве пластмасс, резины, искусственной кожи, лакокрасочных материалов.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Два изомерных органических вещества имеют состав С2Н4О. Одно из них реагирует
сраствором карбоната натрия с выделением углекислого газа, другое не взаимодействует с этим реагентом, но при нагревании с гидроксидом натрия образует спирт и соль. Что это за вещества? Напишите уравнения соответствующих реакций.
2.Уксусноэтиловый эфир и масляная кислота являются межклассовыми изомерами, следовательно имеют одинаковую молекулярную массу. У какого из веществ температура кипения выше? С чем это связано? (Температура кипения этилацетата составляет +77 °С, масляной кислоты +164 °С.)
3.Напишите структурные формулы нескольких изомеров состава: а) С4Н8О2; б) С4Н10О. Дайте им названия. Укажите классы соединений, к которым они относятся. Существуют ли водородные связи между молекулами предложенных вами изомеров? Чем различаются свойства изомеров, способных образовывать водородные связи, и тех, у которых эти связи отсутствуют?
4.Винтергриновое масло, используемое для согревающих растираний с целью снятия мышечных и ревматических болей, представляет собой метиловый эфир 2-ги- дроксибензойной кислоты (метилсалицилат). Напишите его структурную формулу и уравнения химических реакций, характеризующих свойства этого эфира.
5.Диметиловый эфир фталевой кислоты является репеллентом, т. е. обладает способностью отпугивать комаров, оводов, мух. Предложите схему его получения
сиспользованием в качестве исходного органического соединения ацетилена и любых неорганических реагентов.
6.С помощью каких химических реакций можно различить следующие соединения: метилформиат и этилацетат; пропилхлорид и хлорангидрид пропионовой кислоты; масляную кислоту и этилацетат; уксусный ангидрид и бутанол-1; пропаналь и хлорангидрид уксусной кислоты?
7.Установите структурную формулу вещества А, имеющего состав С5Н10Cl2. В результате гидролиза вещество А превращается в соединение Б состава С5Н10О. Продуктом окисления вещества Б при взаимодействии с раствором гидроксида натрия является соединение В, сплавление которого со щелочью приводит к образованию изобутана. Напишите химические реакции и укажите условия их проведения.
8.Органические соединения А и Б имеют общую формулу С4Н8О2. В результате щелочного гидролиза соединения А получаются два органических вещества: В и Г. При сплавлении В со щелочью образуется метан. Вещество Г реагирует с металлическим натрием с выделением водорода. Вещество Б вступает в реакцию
262
