
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
§36. Получение альдегидов и кетонов. Строение карбонильной группы
§36. ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ.
СТРОЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫ
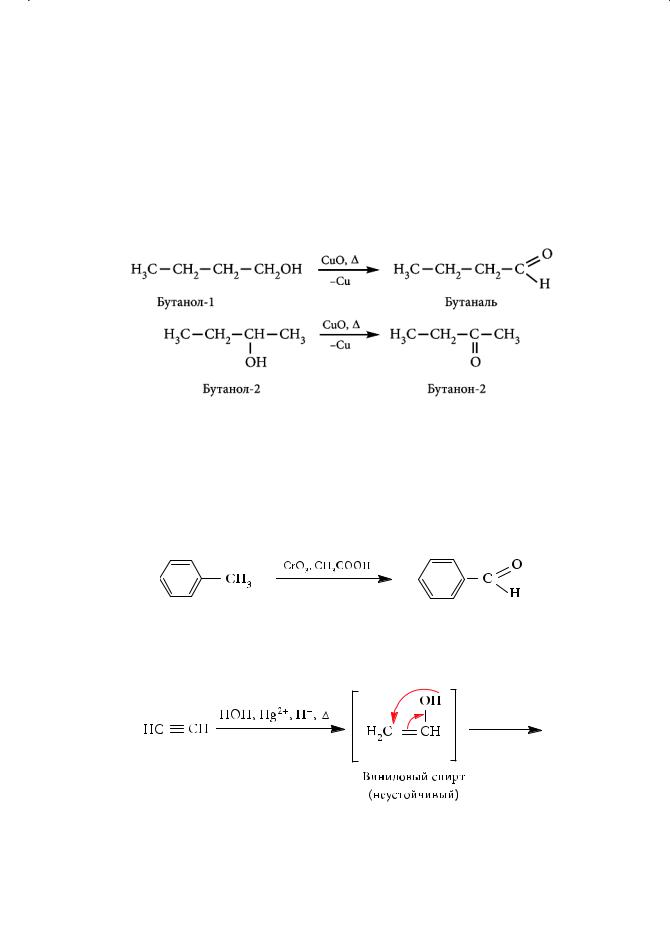
Получение альдегидов
1.Окисление спиртов
Первичные спирты при окислении образуют альдегиды, а вторичные —
кетоны. Так, при окислении бутанола-1 образуется бутаналь, а при окислении бутанола-2 — бутанон:
В качестве окислителей используют обычно оксид меди(II), дихромат калия в серной кислоте, оксид хрома(VI). При окислении первичных спиртов более сильными окислителями (перманганат калия в серной кислоте) образуются соответствующие карбоновые кислоты.
2.Окисление толуола оксидом хрома(VI)
Ароматический альдегид — бензальдегид — может быть получен окисле-
нием толуола оксидом хрома(VI) в уксусной кислоте:
3.Гидратация ацетилена и его гомологов (реакция Кучерова)
При гидратации ацетилена образуется уксусный альдегид, при гидрата-
ции гомологов ацетилена — кетоны:
211
Глава 6. Карбонильные соединения. Альдегиды и кетоны
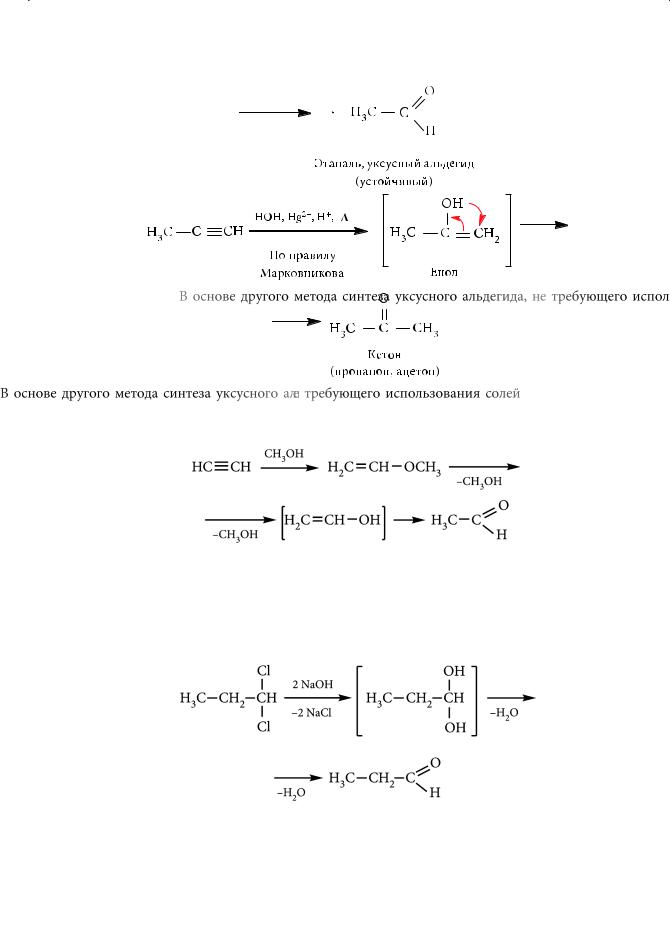
В основе другого метода синтеза уксусного альдегида, не требующего использования солей ртути, лежит следующая реакция:
. Гидролиз геминальных дигалогенопроизводных углеводородов
При гидролизе таких дигалогеналканов образуются неустойчивые диолы, претерпевающие самопроизвольную дегидратацию с образованием альдегидов, если группы ОН расположены у концевого углеродного атома:
212

§36. Получение альдегидов и кетонов. Строение карбонильной группы
икетонов — в остальных случаях:
Подобная реакция лежит в основе промышленного получения бензальдегида:
5.Оксосинтез (гидроформилирование)
Перспективным промышленным методом синтеза альдегидов является оксосинтез — взаимодействие алкенов с оксидом углерода(II) в атмосфере водорода в присутствии катализатора. В процессе реакции происходит наращивание углерод-углеродной цепи. Например, из пропена при 100–200 °С и давлении 100–200 атм в присутствии кобальтового или никелевого катализатора образуется с высоким выходом масляный альдегид:
6.Ацилирование бензольного кольца
Ароматические кетоны могут быть получены при ацилировании бензола
ангидридами или галогенангидридами карбоновых кислот:
+ H3C |
|
O |
AlCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
C Cl |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
C |
CH |
+ HCl |
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
O |
|
|
||||
ацетилхлорид |
|
|
|
|
|
|
|
|
|
||||||
|
метилфенилкетон |
|
|||||||||||||
Ацетилхлорид |
|
Метилфенилкетон |
|
||||||||||||
213
Глава 6. Карбонильные соединения. Альдегиды и кетоны
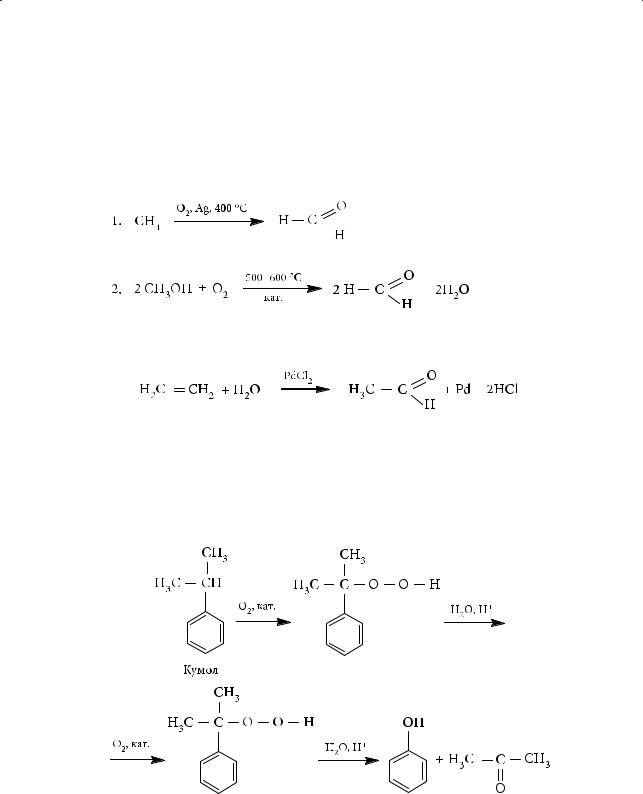
Получение важнейших карбонильных соединений
Формальдегид в промышленности получают окислением метана кислородом воздуха при высоких температурах с участием в качестве катализатора металлического серебра либо высокотемпературным окислением метанола с использованием железо-молибденовых катализаторов:
Уксусный альдегид в промышленности можно получить окислением этилена кислородом в присутствии водных растворов солей меди и палладия:
Для регенерации хлорида палладия используется хлорид меди(II):
Pd + 2CuCl2 → PdCl2 + 2CuCl; 4CuCl + 4HCl + O2 → 4CuCl2 + 2H2O.
Ацетон (наряду с фенолом) получается при окислении кумола (изопропилбензола) кислородом воздуха:
214

§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
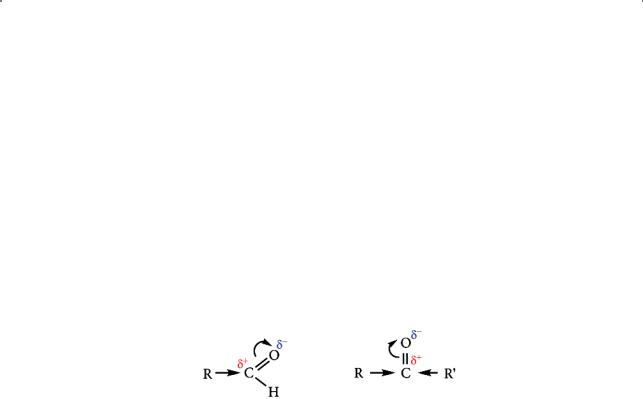
Строение карбонильной группы
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации. Он образует три σ-связи с тремя соседними атомами (кислородом, углеродом и водородом) в молекуле альдегида и три σ-связи (с двумя атомами углерода и атомом кислорода) в молекуле кетона; π-электронная плотность в карбонильной группе смещена от атома углерода к атому кислорода. За счет перекрывания негибридизованной р-орбитали атома углерода и р-орбитали кислородного атома между ними образуется π-связь:
В результате на атоме углерода образуется частичный положительный заряд (δ+), а на атоме кислорода — частичный отрицательный (δ–).
Таким образом, карбонильная группа в альдегидах и кетонах поляризована, что следует также из сравнения дипольных моментов связей С–О (1,6 D) и С=О (3,2 D). Это в значительной степени и определяет общие химические свойства альдегидов и кетонов — способность вступать в реакции присоединения по карбонильной группе.
Прогноз реакционной способности альдегидов и кетонов
Отличаются ли реакции присоединения по группе С=О от хорошо уже известных вам реакций электрофильного присоединения по группе С=С?
В отличие от кратной углерод-углеродной связи (С=С) двойная связь углерод — кислород (С=О) сильно поляризована. Электронная плотность смещена к атому кислорода. Положительный заряд на углеродном атоме обеспечивает атаку частиц с повышенной электронной плотностью (нуклеофильных реагентов). Следовательно, большинство реакций по карбонильной группе составят реакции нуклеофильного присоединения. Их обозначают AN (сокр. от англ. ad-
215
Глава 6. Карбонильные соединения. Альдегиды и кетоны
dition — присоединение). Реакции нуклеофильного присоединения общие для альдегидов и кетонов. Они могут быть использованы для группового анализа карбонильных соединений.
Зададимся вопросом, какой класс соединений — альдегиды или кетоны — имеет бóльшую склонность к таким реакциям. Чем более поляризована карбонильная группа, тем легче идут реакции нуклеофильного присоединения.
В молекулах альдегидов дефицит электронной плотности на карбонильном атоме углерода слегка «гасится» за счет положительного индуктивного эффекта алкильной группы; в молекулах кетонов эта тенденция выражена сильнее, поскольку по соседству с электронодефицитным углеродным атомом расположены два алкильных радикала. Таким образом, поляризация карбонильной группы в кетонах будет меньше, а значит, и реакции нуклеофильного присоединения идут труднее, чем в альдегидах:
Легче всего реакции этого типа будут идти для формальдегида, в молекуле которого нет алкильных заместителей.
Характерной особенностью альдегидов, отличающей их от кетонов, является легкость окисления. На этом свойстве основаны качественные реакции на альдегидную группу, позволяющие различить альдегиды и кетоны.
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Предложите альтернативные пути синтеза ацетофенона (метилфенилкетона) с использованием в качестве исходных соединений метана и любых неорганиче-
ских реагентов.
2.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) |
пропан → 2-хлорпропан → 2,2-дихлорпропан → пропанон; |
б) |
этан → этилхлорид → этилен → 1,2-дихлорэтан → ацетилен → этаналь; |
в) |
этан → этилбромид → этанол → этаналь. |
3.Из каких исходных органических соединений можно получить: а) метаналь; б) пропаналь; в) бензальдегид?
4.Энергия связи С=О (708 кДж/моль) больше, чем связи С=С (620 кДж/моль), а длина связи С=О (0,121 нм) меньше, чем длина связи С=С (0,134 нм). Как это можно объяснить?
5.Расположите следующие вещества в порядке возрастания склонности этих соединений к реакциям нуклеофильного присоединения: формальдегид, ацетон, уксусный альдегид.
216
