
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
§ 33. ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛА
Реакции за счет гидроксигруппы
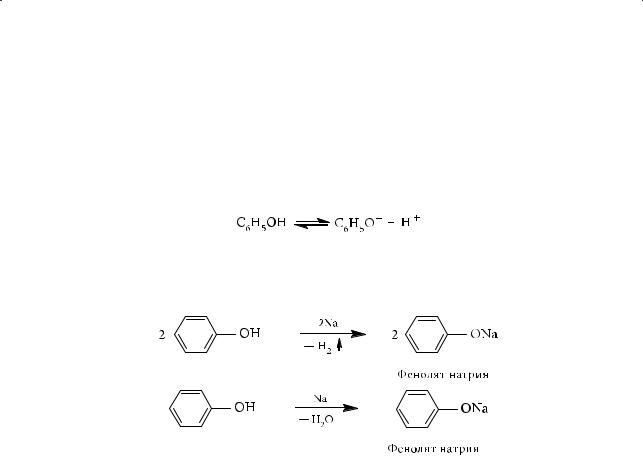
1.Кислотные свойства фенола
Вводном растворе молекула фенола, хоть и незначительно, но диссоциирует на фенолят-ион и катион водорода:
Кислотность фенола существенно выше, чем у алифатических и ароматических спиртов, и проявляется не только во взаимодействии с активными металлами с выделением водорода, но и в реакции со щелочью:
По кислотным свойствам фенол превосходит этанол в 106 раз.
Казалось бы, фенол — сильнейшая кислота. Однако во столько же раз фенол по кислотности уступает уксусной кислоте (подробнее о свойствах органических кислот мы узнаем позднее, однако хорошо известно, что карбоновые кислоты — слабые электролиты, значительно слабее серной, азотной и соляной кислот). В отличие от карбоновых кислот фенол не может вытеснить угольную кислоту из ее солей:
СН3СООН + NaHCO3 → CH3COONa + H2O + CO2↑ C6H5OH + NaHCO3 –/→.
Значит, фенол по кислотным свойствам уступает и угольной кислоте. Прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия. На этом основан метод отделения фенолов от карбоновых кислот.
Введение заместителей в ароматическое кольцо влияет на кислотные свойства фенолов: электронодонорные заместители их незначительно снижают, а акцепторные существенно увеличивают. Например, если в ароматическое кольцо в пара-положение по отношению к гидроксильной группе ввести ак-
192
§ 33. Химические свойства фенола
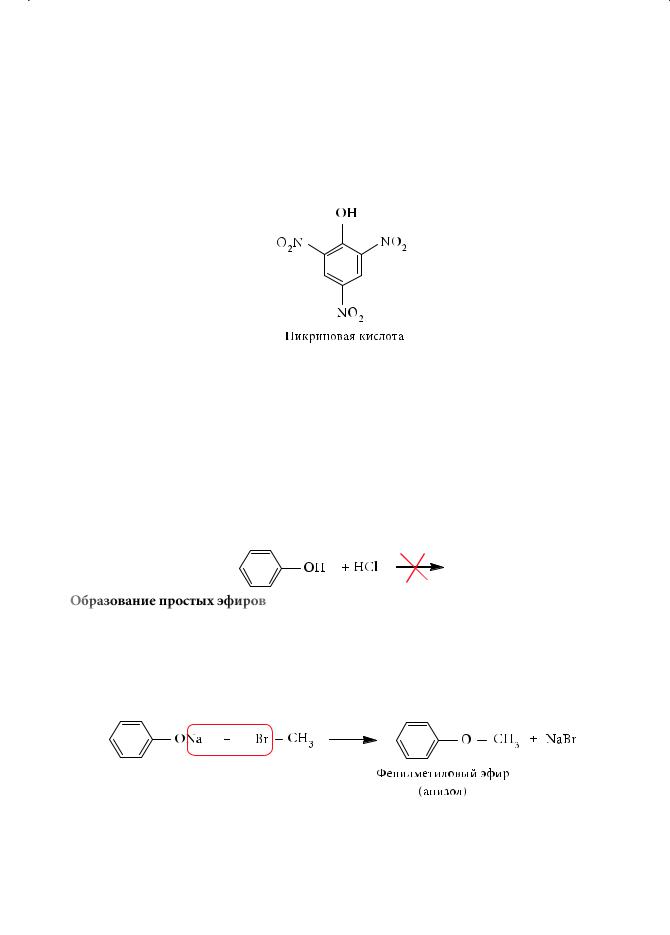
цепторный заместитель — нитрогруппу, то кислотность образующегося п-ни- трофенола в сравнении с незамещенным фенолом возрастет на два порядка. А 2,4,6-тринитрофенол (пикриновая кислота), в котором нитрогруппы занимают еще и оба орто-положения, является сильнейшей кислотой, константа кислотности которой на девять порядков превышает соответствующую величину для фенола:
Сравним кислотность фенола и енола — непредельного спирта, в молекуле которого группа ОН соединена так же, как и в случае фенола, с атомом углерода в sp2-гибридном состоянии. Кислотность атома водорода ОН-группы в еноле будет выражена слабее, чем в феноле, но сильнее, чем в алифатическом насыщенном спирте.
2.Оснóвные свойства фенолов
Вотличие от спиртов фенол фактически не реагирует с галогеноводородными кислотами:
3.Образование простых эфиров
Вщелочной среде фенолы превращаются в фенолят-ионы, обладающие высокой нуклеофильностью. Взаимодействие фенолятов с алкилгалогенидами позволяет синтезировать простые эфиры смешанного типа, молекулы которых содержат ароматический и алифатический радикалы:
193
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
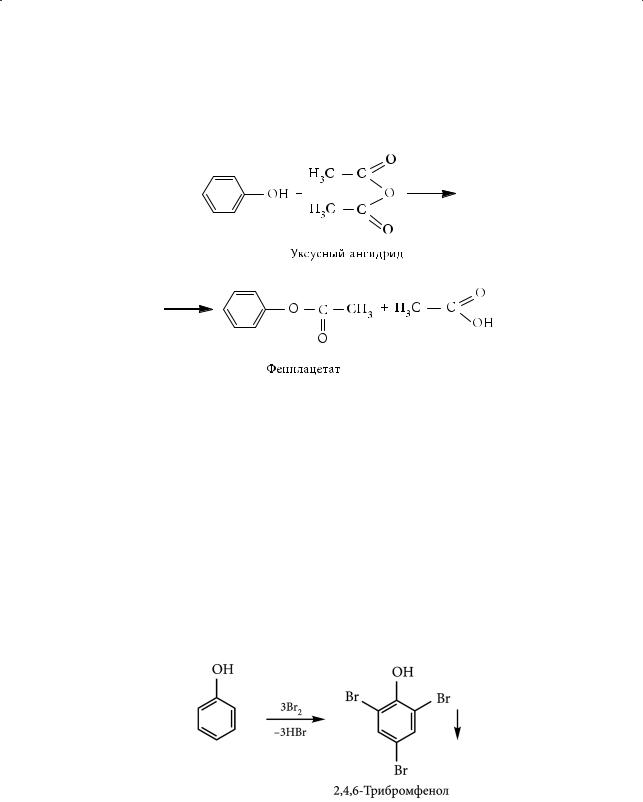
4.Образование сложных эфиров (ацилирование фенола)
Гидроксильная группа фенолов может ацилироваться с участием ангидри-
дов или галогенангидридов карбоновых кислот:
Реакция ускоряется как кислотами, так и основаниями.
Реакции фенола за счет бензольного кольца.
Теперь рассмотрим реакции электрофильного замещения SE.
Гидроксильная группа является донорным заместителем, активирующим бензольное кольцо в реакциях электрофильного замещения и ориентирующим новый заместитель сразу в орто- и пара-положения.
1.Бромирование фенола
Фенол значительно легче вступает в реакции электрофильного замещения, чем бензол. Бромирование фенола не требует наличия катализатора, идет с количественным выходом, в мягких условиях (взаимодействие с бромной водой при комнатной температуре) и образованием трибромпроизводного:
194
§ 33. Химические свойства фенола
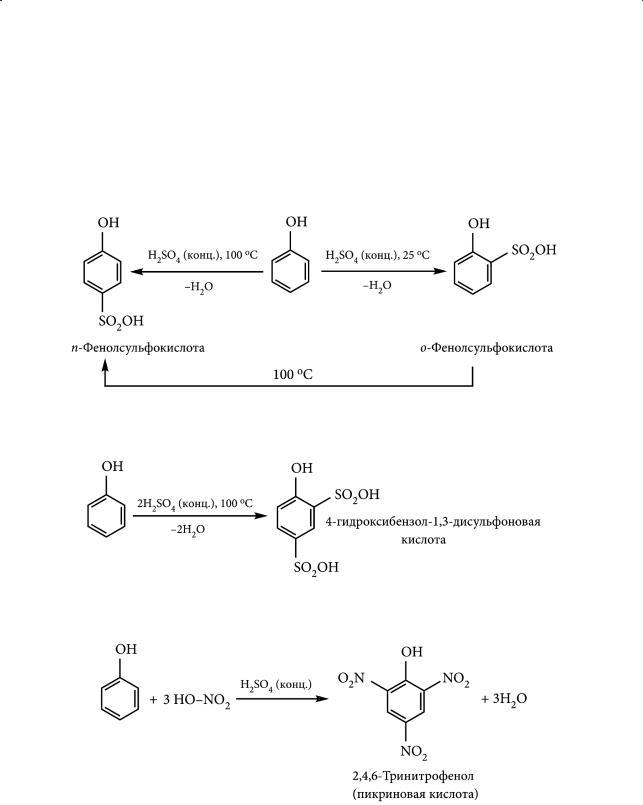
2.Сульфирование фенола
Строение и выход получающегося продукта сульфирования зависят от тем-
пературы реакции, времени ее проведения и количества сульфирующего реагента. Если фенол сульфировать при комнатной температуре, образуется преимущественно кинетически контролируемый продукт — 2-гидроксибензолсульфоновая кислота. Нагревание до 100°С приводит к получению термодинамически контролируемого продукта — пара-изомера — 4-гидроксибензолсульфоновой кислоты:
Сульфирование с использованием избытка концентрированной серной кислоты при нагревании приводит к образованию дизамещенного фенола — 4-гидроксибензол-1,3-дисульфоновой кислоты:
3.Нитрование фенола
Фенолы очень легко вступают в реакцию нитрования 20%-ной азотной кислотой:
195
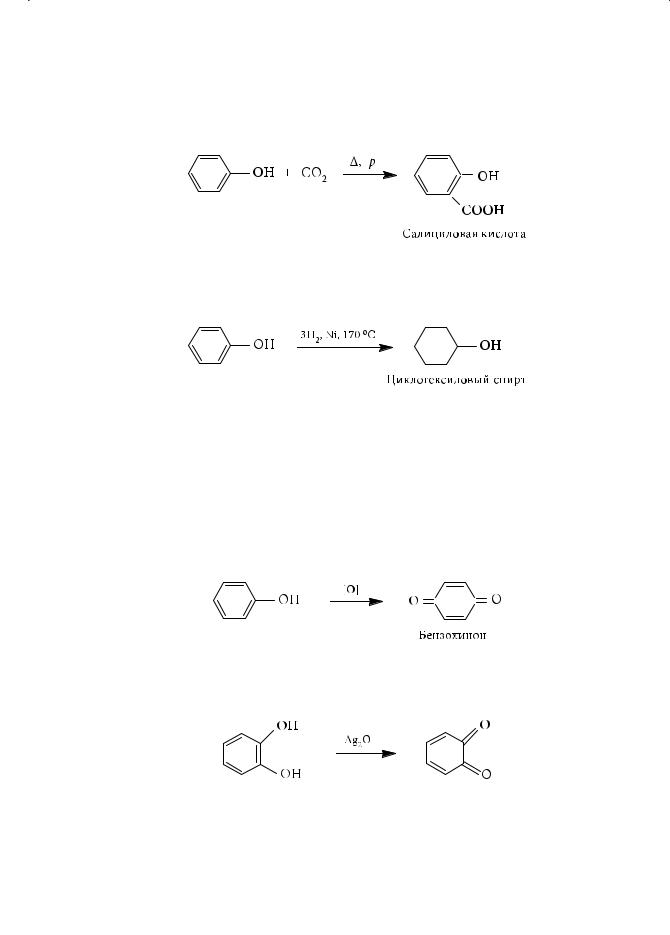
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
4.Получение салициловой кислоты
В1860 году Кольбе разработал метод получения салициловой кислоты под давлением при температуре 180–200 °С:
5.Гидрирование фенола
Продукт этой реакции является растворителем масел, восков, полимеров и красителей.
6.Окисление фенолов
Уже при стоянии на воздухе фенолы приобретают розовую или розово-бу-
рую окраску вследствие легкости их окисления. Если в качестве окислителя использовать хромовую смесь, наряду с другими продуктами образуется кристаллическое вещество желтого цвета — бензохинон:
Многоатомные фенолы с орто- и пара-расположением групп ОН окисляются легче, чем сам фенол, давая соответственно о- и п-бензохиноны, например:
о-Бензохинон
196
