
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

§ 31. Многоатомные спирты
7.В 50 мл технического этанола (плотность 0,8 г/см3) поместили 4,6 г натрия. Массовая доля воды в данном образце этанола составляет 4,43 %. Какой объем водорода выделится в результате реакции?
8.При гидролизе неопентилхлорида (1-хлор-2,2-диметилпропана) не удается получить спирт с таким же строением углеродного скелета, как и у исходного галогеноалкана. В качестве продукта гидролиза образуется 2-метилбутанол-2. Как вы можете объяснить причину образования этого продукта?
9.Вычислите массу эфира, который образуется при взаимодействии 34,5 г этилового спирта и 30 г уксусной кислоты, если его выход в данных условиях этерификации составляет 75 % от теоретически возможного.
§ 31. МНОГОАТОМНЫЕ СПИРТЫ
Общие сведения о многоатомных спиртах
Многоатомными спиртами называются органические соединения, в молекулах которых содержатся две или больщее число гидроксильных групп.
Основой названия многоатомных спиртов служит название предельного углеводорода с тем же числом углеродных атомов. После основы суффиксами «ди-», «три-» и т. д. указывают число групп ОН, а цифрами — их положение в углеродной цепи. Для простейших многоатомных спиртов распространены также тривиальные названия:
Соединения, молекулы которых содержат при одном углеродном атоме две или большее число гидроксильных групп, крайне неустойчивы и при обычных условиях не существуют.
Гликоли
Двухатомные спирты называются гликолями (от греч. glykos — сладкий и kolla — клей).
Типичным представителем двухатомных спиртов является этиленгликоль (этандиол-1,2):
181
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
При обычных условиях этиленгликоль — вязкая бесцветная жидкость, сладкая на вкус; его температура кипения составляет 198 °С. Этиленгликоль значительно понижает температуру замерзания воды. Так, например, 25%-ный водный раствор этиленгликоля замерзает при –12 °С, а 60%-ный раствор — при –49 °С. Это свойство этиленгликоля используют для приготовления антифриза (от греч. anti — против и англ. freeze — замерзать ) — низкозамерзающей жидкости, применяемой для охлаждения двигателей внутреннего сгорания и различных установок, работающих при температуре ниже 0 °С.
Получение этиленгликоля
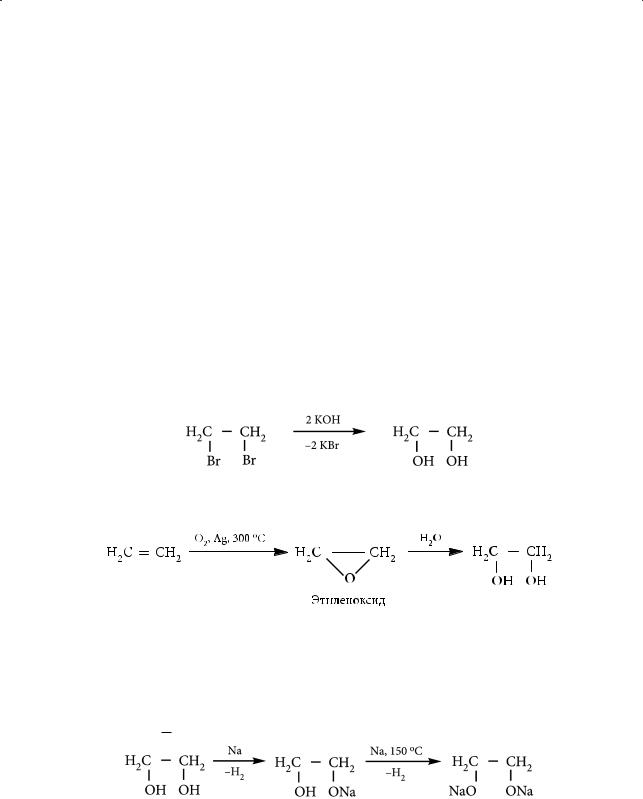
1. В результате окисления алкенов раствором перманганата калия при пониженной температуре в нейтральной и слабощелочной среде (реакция Вагнера) образуются двухатомные спирты — гликоли:
3СН2=СН2 + 2KMnO4 + 4H2O → 3HOCH2CH2OH + 2MnO2↓+ 2KOH.
2.Этиленгликоль может быть получен также щелочным гидролизом 1,2-дигалогенэтана, например:
3.Промышленным методом получения этиленгликоля является гидролиз этиленоксида, который, в свою очередь, образуется при каталитическом окислении этилена кислородом воздуха:
Гликоли обладают всеми основными свойствами спиртов: взаимодействуют со щелочными металлами, галогеноводородами, вступают в реакцию этерификации и т. д. Взаимодействие с металлическим натрием с участием первой гидроксильной группы этиленгликоля идет достаточно легко. Замещение на натрий атома водорода второй гидроксильной группы в молекуле гликоля происходит уже в жестких условиях из-за электронодонорного влияния гли- колят-аниона:
182
§ 31. Многоатомные спирты
Вотличие от одноатомных спиртов гликоли могут взаимодействовать
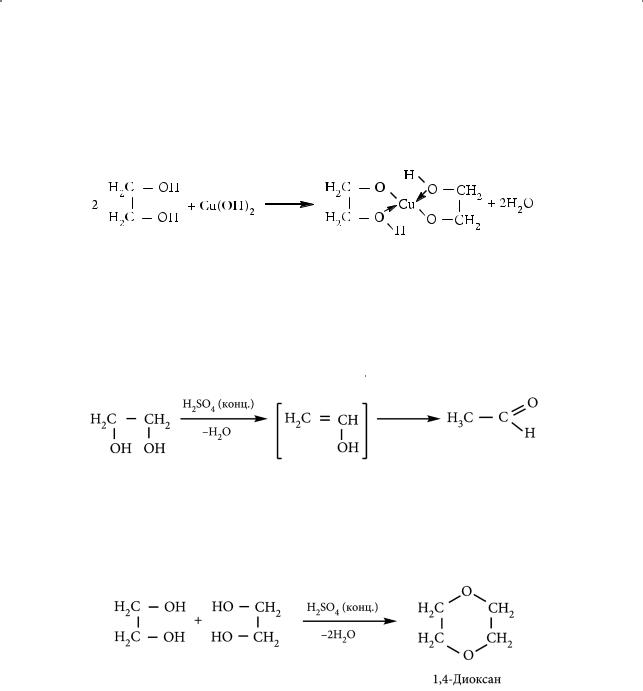
сгидроксидами металлов. Так, при взаимодействии этиленгликоля с гидроксидом меди(II) в щелочной среде образуется чернильно-синий раствор гликолята меди(II):
Эта реакция является качественной на двух- и многоатомные спирты. Подобно одноатомным спиртам, гликоли могут вступать в реакции внут-
ри- и межмолекулярной дегидратации в присутствии серной кислоты. Внутримолекулярная реакция сопровождается промежуточным образованием неустойчивого винилового спирта, который сразу же изомеризуется в более стабильную структуру — уксусный альдегид (такая изомеризация нам уже известна: она имеет место в реакции гидратации ацетилена — реакции Кучерова)
В результате межмолекулярной дегидратации этиленгликоля, которая идет в более мягких условиях и при наличии избытка гликоля по отношению к серной кислоте, образуется 1,4-диоксан — растворитель, обладающий ценными свойствами (он одинаково хорошо смешивается с водой и с неполярными органическими жидкостями):
Глицерин
Глицерин — простейший представитель трехатомных спиртов — при обычных условиях бесцветная вязкая сиропообразная гигроскопичная жидкость, сладкая на вкус, с температурой плавления 17 °С и температурой кипения 290 °С;
183
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
плотность глицерина равна 1,26 г/см3. Он смешивается с водой в любых соотношениях. Глицерин не ядовит, имеет важное биологическое и промышленное значение: применяется в пищевой промышленности (добавляется в кондитерские изделия, ликеры и т. д.), в парфюмерии, является исходным веществом для получения тринитроглицерина.
Получение глицерина. Глицерин впервые получил шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) в 1779 году. Нагревая оливковое масло с кислотой, он выделил маслянистую жидкость, сладкую на вкус. Новое вещество получило название глицерин (от греч. glykeros — сладкий).
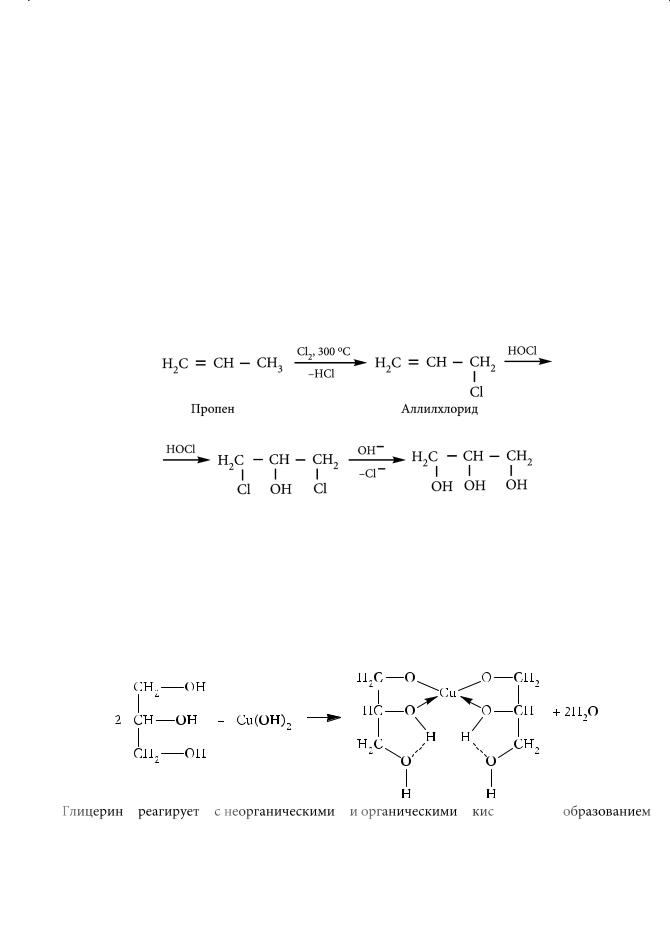
В настоящее время глицерин получают в основном синтетическим путем, используя в качестве исходного сырья пропен, образующийся в процессе крекинга нефти. Пропен подвергают аллильному хлорированию. Полная схема промышленного синтеза глицерина представлена ниже:
Химические свойства глицерина. Эти свойства глицерина обусловлены наличием гидроксильных групп: он так же, как гликоли и одноатомные спирты, реагирует с активными металлами и галогеноводородами.
Подобно этиленгликолю, глицерин взаимодействует со свежеосажденным гидроксидом меди(II) в щелочной среде (качественная реакция на многоатомные спирты) с образованием глицерата меди ярко-синего цвета:
184
§ 31. Многоатомные спирты
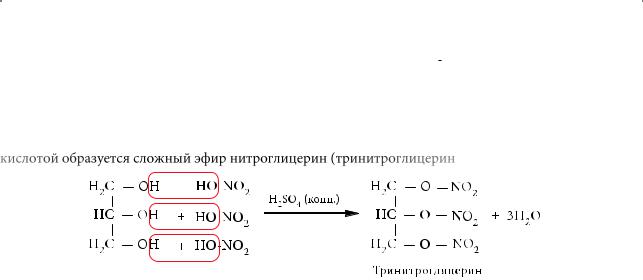
Глицерин реагирует с неорганическими и органическими кислотами с образованием сложных эфиров (реакция этерификации). Так, при взаимодействии этого спирта с азотной кислотой образуется сложный эфир нитроглицерин (тринитроглицерин):
Впервые нитроглицерин был получен в 1846 году итальянским химиком Асканьо Собреро (Ascanio Sobrero), который нагрел глицерин со смесью серной и азотной кислот. Новое вещество стали применять в военных целях. Однако при транспортировке оно взрывалось от сотрясения и удара. «Укротить» тринитрат глицерина удалось шведскому инженеру-химику, изобретателю и промышленнику Альфреду Нобелю (Alfred Bernhard Nobel). В 1866 году после многочисленных экспериментов ученый обнаружил, что пропитанная нитроглицерином инфузорная земля (кизельгур) безопасна при хранении и транспортировке, но сохраняет взрывчатые свойства. Так был изобретен динамит.
Тринитроглицерин нашел применение и в медицине: 1%-ный раствор нитроглицерина в масле расширяет сосуды, питающие сердечную мышцу.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Запишите структурные формулы изомерных соединений состава С3Н8О2. Какие из них устойчивы? Назовите их.
2.В каждой из четырех склянок без этикеток находится какое-то одно из перечисленных веществ: этиленгликоль, н-гексан, толуол, этанол. Как химическим путем определить, в какой склянке какое вещество находится? Составьте план распознавания этих веществ и напишите уравнения реакций.
3.Запишите уравнение лежащей в основе промышленного получения волокна лавсан реакции поликонденсации с участием этиленгликоля и терефталевой кислоты.
4.Напишите уравнения реакций, с помощью которых можно осуществить следующие синтезы: а) карбид кальция → 1,4-диоксан; б) пропан → тринитроглицерин; в) карбид алюминия → гликолят меди(II).
185
