
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

§16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
Вотличие от ненапряженных молекул перекрывание гибридных орбиталей в циклопропане не может осуществиться по прямой, соединяющей два углеродных атома.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Используя теорию Байера, рассчитайте угол напряжения в молекулах циклопентана и циклогексана. Почему циклогексан является устойчивым циклом, несмотря на существование напряжения (по Байеру) в этом цикле?
2.Одним из способов повышения октанового числа (улучшения качества топлива),
применяемых при переработке нефти, является риформинг — каталитическое высокотемпературное гидрирование углеводородов. При этом алканы превращаются в циклоалканы, а последние — в ароматические углеводороды. Приведите примеры подобных процессов для углеводородов, молекулы которых содержат 6, 7 и 8 углеродных атомов.
3.Хлоро- и бромоводороды присоединяются к циклопропану в водном растворе с разрывом цикла. Для алкилзамещенных циклопропанов реакция идет по правилу Марковникова. Напишите уравнение реакции метилциклопропана с бромоводородной кислотой.
4.Напишите уравнения реакции гидрирования и бромирования: а) 1,2-диметилциклопропана; б) циклопентана.
5.Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: 1,3-дибромпропан → циклопропан → пропан → 2–бром- пропан → 2,2–дибромпропан.
6.Циклопентан объемом 7,47 мл сожгли в избытке кислорода. После конденсации паров воды смесь газообразных продуктов реакции пропустили в 12%-ный раствор гидроксида натрия массой 200 г. Вычислите массовые доли солей в растворе после реакции. (Плотность циклопентана равна 0,75 г/см3, растворимостью кислорода в воде можно пренебречь.)
7.Для гидрирования порции бутана и циклобутана потребовалось 200 мл водорода. При сгорании продукта реакции образовалось 2 л углекислого газа (н.у.). Вычис-
лите объемные доли компонентов в исходной смеси углеводородов.
§16. АЛКИНЫ: ИЗОМЕРИЯ И НОМЕНКЛАТУРА. СТРОЕНИЕ МОЛЕКУЛЫ АЦЕТИЛЕНА
Общие сведения об алкинах и их номенклатура
Алкины — непредельные углеводороды с открытой цепью, в молекулах которых содержится одна тройная связь (остальные связи одинарные). Общая молекулярная формула алкинов СnH2n–2. Простейший представитель ряда алкинов — ацетилен (Н–С≡С–Н). Впервые ацетилен был выделен в 1836 году
103
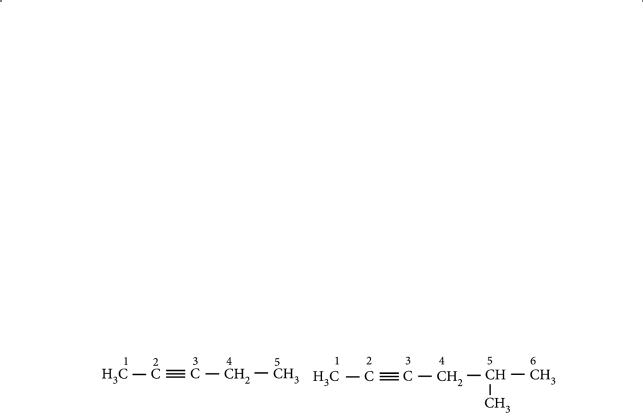
Глава 3. Непредельные углеводороды и циклоалканы
английским химиком Э. Дэви (Edmund Davy) при разложении карбида калия водой. Название этому веществу дал в 1860 году французский химик М. Бертло, получивший ацетилен в атмосфере водорода в разряде электрической дуги между угольными электродами. Он и высказал предположение, что ацетилен, подобно метану и этилену, является родоначальником гомологического ряда ацетиленовых углеводородов.
Название ацетилена по номенклатуре IUPAC — этин, т. е. суффикс «-ан» в названии предельного углеводорода (алкана) заменяется на суффикс «-ин» для соответствующего углеводорода, содержащего одну тройную связь (ал- кина). При составлении названия необходимо учесть следующее: главная углеродная цепь должна включать кратную (в данном случае тройную) связь; нумерация цепи идет с того конца, к которому ближе расположена тройная связь; ее местоположение указывается наименьшим из номеров двух углеродных атомов; предпочтение при нумерации главной цепи, так же как и в случае алкенов, отдается не положению заместителя, а кратной связи, например:
Пентин-2 |
-Метил-гексин-2 |
Если молекула углеводорода содержит наряду с тройной и двойную связь, такие углеводороды называются ениновыми: суффикс «-ен» указывает на наличие двойной, а «-ин» — на наличие тройной связи. При этом, если обе кратные связи равноотстоят от концов углеродной цепи, нумерацию определяет положение двойной связи, как, например, в данном случае:
Н — С  С — СН2 — СН2 — СН
С — СН2 — СН2 — СН  СН2
СН2
Гексен-1-ин-5
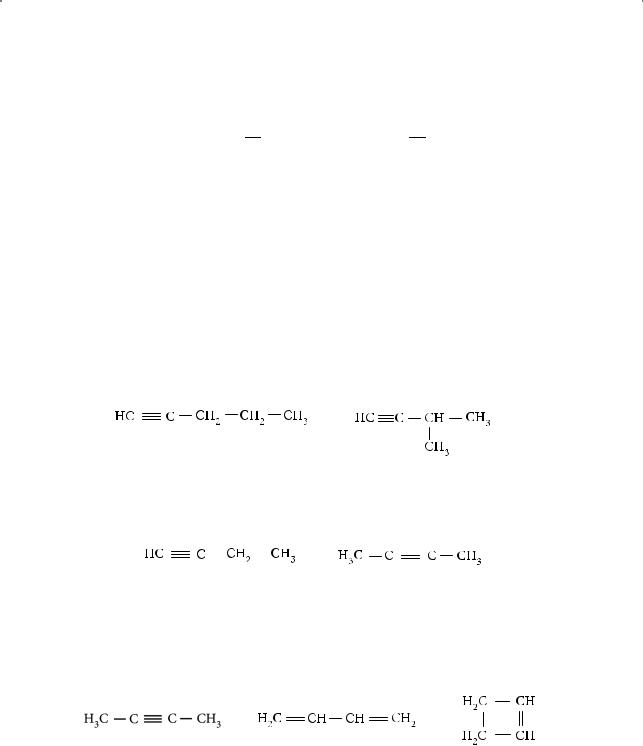
Кроме номенклатуры IUPAC иногда пользуются рациональной, в которой алкины рассматривают как производные простейшего члена ряда — ацетилена. Например, пропин по этой номенклатуре можно представить как производное ацетилена, в молекуле которого один водородный атом замещен на метильную группу. Его название по рациональной номенклатуре — метилацетилен, название бутина-2, где оба ацетиленовых водородных атомов замещены на метильные группы, — диметилацетилен и т. д.
СН3 — С  СН СН3 — С
СН СН3 — С  С — СН3
С — СН3
Пропин Бутин-2
Использование рациональной номенклатуры оправданно только для низкомолекулярных алкинов. Алкины с концевой тройной связью, т. е. сам ацети-
104
§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
лен, пропин, бутин-1, пентин-1 и др., называют терминальными ацетиленовыми углеводородами.
СН3 — С |
СН СН3 — СН2 — С СН |
Пропин |
Бутин-1 |
Такие алкины имеют особые химические свойства, отличающие их от ацетиленовых углеводородов, в молекулах которых тройная связь удалена от концевого углеродного атома, что будет рассмотрено позже.
Подобно классам алканов и алкенов каждый последующий член гомологического ряда алкинов отличается от предыдущего на гомологическую разность СН2. Гомологи сходны по физическим, химическим свойствам и строению.
Изомерия алкинов
Рассмотрим основные типы изомерии, характерные для класса алкинов.
1.Изомерия углеродного скелета
Например:
Пентин-1 |
3-Метилбутин-1 |
2.Изомерия положения кратной связи (в данном случае тройной)
Например:
Бутин-1 Бутин-2
3. Межклассовая изомерия
Состав СnH2n–2 имеют, кроме алкинов, углеводороды, молекулы которых содержат две двойные связи (алкадиены), или циклические углеводороды, содержащие в составе цикла одну двойную связь (циклоалкены), например:
Бутин-2 |
Бутадиен-1,3 |
Циклобутен |
В алкинах, в отличие от алкенов, отсутствует цис-транс-изомерия.
105

Глава 3. Непредельные углеводороды и циклоалканы
Строение молекулы ацетилена
Каждый атом углерода в молекуле ацетилена образует с двумя своими соседями (углеродным и водородным атомами) две σ-связи: С–Н и С–С. Для образования σ-связей атому углерода требуются две гибридные орбитали, которые могут образоваться при смешении одной s- и одной р-орбитали (sp-гибридиза- ция). Они располагаются под углом 180° (рис. 3.7, а), поэтому молекула ацетилена имеет линейное строение: два атома углерода и два атома водорода расположены на одной прямой; валентные углы равны 180° (рис. 3.7, б).
При этом у каждого из атомов углерода в молекуле ацетилена остается по одному неспаренному электрону на py- и pz-орбиталях, взаимодействие которых приводит к образованию двух π-связей (рис. 3.8). Распределение электронной плотности между атомами углерода в ацетилене обладает цилиндрической симметрией («π-электронный чулок»), в отличие от плоскостной симметрии электронного облака углерод-углеродной связи в молекуле этилена. За счет дополнительного перекрывания pz-орбиталей длина связи С≡С короче, чем в алкенах, и равна 0,120 нм. Энергия связи С≡С составляет 837 кДж/моль, что на 216 кДж/моль меньше суммы энергий трех одинарных связей.
Бóльшую полярность ацетиленовой ≡С–Н-связи по сравнению со связью =С–Н объясняют более заметным вкладом s-орбиталей в гибридную орбиталь атома углерода. Электроотрицательность (ЭО) атомов углерода падает
Рис. 3.7. Схема образования σ-связей в молекуле ацетилена (а) и шаростержневая модель этой молекулы (б)
Рис. 3.8. Схема образования π-связей в молекуле ацетилена
106
