
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

Глава 3. Непредельные углеводороды и циклоалканы
4.Изобразите конформации кресла и ванны для этилциклогексана. Какая из этих конформаций будет более стабильной?
5.К смеси циклобутана и циклопропана объемом 100 мл добавили 500 мл кислорода
исмесь взорвали. После конденсации паров воды и приведения полученной газовой смеси к исходным условиям ее объем составил 340 мл. Вычислите объемные
имассовые доли компонентов в исходной газовой смеси углеводородов (объемы газов приведены к одинаковым условиям).
6.При сгорании 21 г органического вещества образовалось 33,6 л (н. у.) углекислого газа и 27 г воды. Плотность этого органического вещества по водороду равна 35. Выведите молекулярную формулу органического вещества. Составьте формулы
трех изомеров, соответствующих условию задачи.
§15. СТРОЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ
Химические особенности циклоалканов
Малые циклы — циклопропан и циклобутан — по своему химическому поведению заметно отличаются от других членов ряда. Для них, как и для изомерных им алкенов, характерны в первую очередь реакции присоединения с разрывом цикла.
Циклопропан легко вступает в реакцию присоединения с бромом:
Таким образом, различить изомерные циклопропан и пропен с помощью бромной воды нельзя. Это возможно, если использовать водный раствор перманганата калия: пропен обесцвечивает водный раствор KMnO4 в мягких условиях, а циклопропан — лишь при нагревании.
Циклопентан и циклогексан ведут себя иначе, напоминая алканы. Наиболее характерны для них реакции радикального замещения. Так, при
бромировании циклогексана на свету или при высоких температурах образуется бромциклогексан:
98
§ 15. Строение и химические свойства циклоалканов
Циклоалканы горючи. Их горение происходит так же, как и горение алканов, например:
C4H8 + 8O2 → 4CO2 + 4H2O.
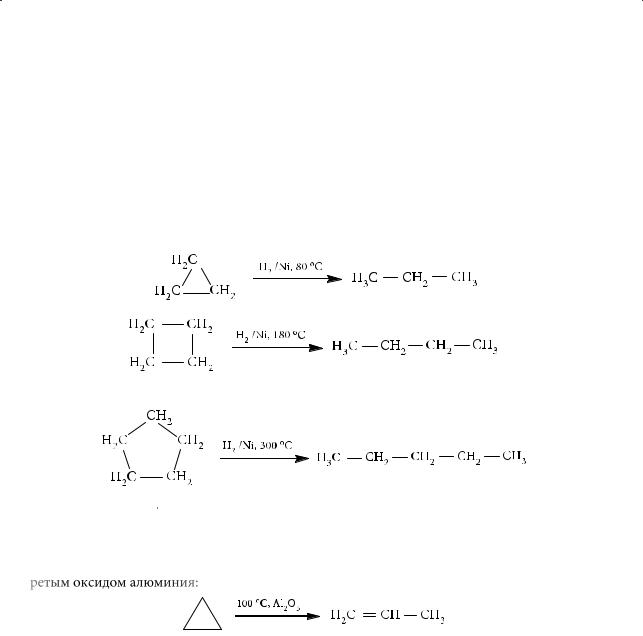
Гидрирование циклоалканов проводят в присутствии катализаторов с образованием соответствующих алканов.
При этом условия гидрирования для разных циклоалканов различаются: чем меньше цикл, тем легче он присоединяет водород. Циклопропан гидрируется при температуре 80 °С, а циклобутан — при 180 °С:
Для гидрирования циклопентана уже требуется температура свыше 300 °С:
Циклопропан и циклобутан термодинамически менее стабильны, чем соответствующие изомерные им алкены, а циклопентан и циклогексан, наоборот, более стабильны. Поэтому для циклопропана возможна, например, изомеризация с образованием пропена при пропускании его над нагретым оксидом алюминия:
Строение циклоалканов
В молекулах циклоалканов все связи одинарные, поэтому каждый из атомов углерода образует четыре σ-связи, для формирования которых требуется четыре гибридные орбитали. Таким образом, атомы углерода должны находиться в состоянии sp3-гибридизации.
Пытаясь объяснить аномальное поведение малых циклов и полагая, что молекулы всех циклоалканов имеют плоское строение, немецкий химик
99

Глава 3. Непредельные углеводороды и циклоалканы
Адольф Байер (1835–1917)
Немецкий химик-органик, профессор Страсбургского и Мюнхенского университетов. В 1885 году разработал теорию напряжения, объяснявшую, почему шести- и пятичленные углеродные кольца стабильнее колец из большего или меньшего числа углеродных атомов. Ввел понятие о цис-транс-изомерии в циклах. В 1905 году А.Байеру присуждена Нобелевская премия по химии за изучение структуры и синтез красителя индиго.
Адольф Байер (Johann Friedrich Wilhelm Adolf von Baeyer) в 1885 году выдвинул свою теорию напряжения. Основываясь на тетраэдрическом строении атома углерода, он утверждал, что любое изменение валентного угла в молекуле циклоалкана приводит к ее дестабилизации. Согласно этой теории, молекулы циклопропана и циклобутана должны быть напряжены, так как углы между связями С–С–С не могут принять нормальное тетраэдрическое значение 109°28′. В основе количественной оценки этого напряжения (α) лежит отклонение между реальным валентным углом в молекуле циклоалкана и тетраэдрическим (ненапряженным) углом алкана (рис. 3.3):
a = 109°28′ − 60° = 24°44′. 2
Таким образом, можно рассчитать угловое напряжение в различных циклоалканах.
Каковы же современные представления о строении молекул циклоалканов? Оказалось, что теория Байера справедлива, строго говоря, только для циклопропана. Напомним, что в основе этой теории лежало положение о плоском строении всех циклов. В 1890 году ассистент Высшей технической школы в Берлине Г. Заксе указал на то, что напряжение может быть устранено при нарушении плоского расположения атомов в циклах. Действительно, благодаря возможности вращения различных частей молекулы вдоль одинарных σ-свя- зей молекулы циклоалканов могут существовать в различных конформациях.
Рис. 3.3. Вычисление угла напряжения в циклопропане. Красным цветом выделен тетраэдрический угол 109,5°
100
§ 15. Строение и химические свойства циклоалканов
а |
б |
в |
г |
д |
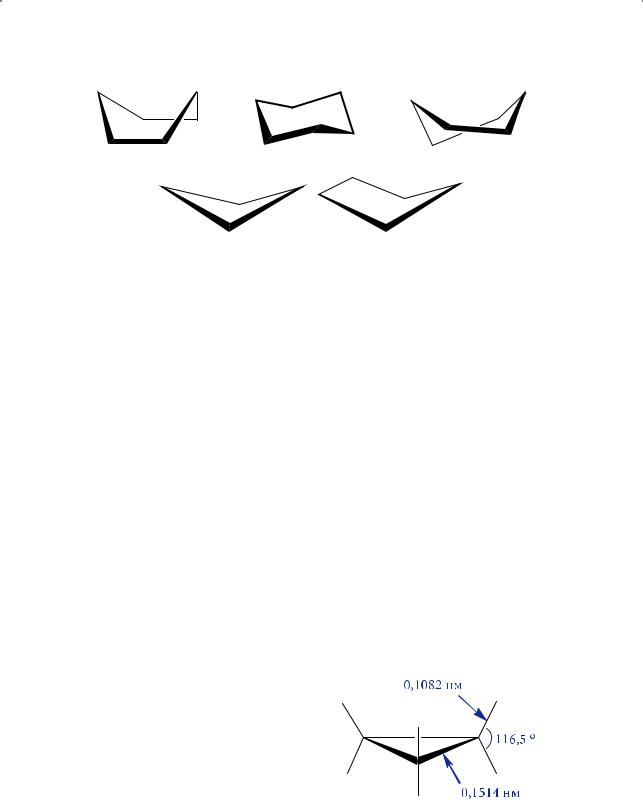
Рис. 3.4. Конформации: циклогексана (а — «ванна», б — «кресло», в — «твист»); циклобутана (г); циклопентана (д — «конверт»)
Например, для циклогексана существует несколько таких конформаций: «ванна», «кресло» и «твист» (рис. 3.4). Наиболее устойчивой является конформация кресла: разница в энергии образования конформаций «ванна» и «кресло» составляет ~28,8 кДж/моль.
Только циклопропан существует в единственно возможной плоской конформации, а уже циклобутан не является плоским циклом (см. рис. 3.4), не говоря уже о циклопентане и циклогексане.
Энергия напряжения молекулы может быть определена как различие в ее устойчивости, измеренной экспериментально, и ее теплоты образования, рассчитанной из стандартных вкладов групп, применимых к ненапряженным углеводородам. Сравните энергии напряжения (ккал/моль) для некоторых циклических углеводородов, представленных в табл. 3.1. В качестве эталона ненапряженного цикла принят циклогексан.
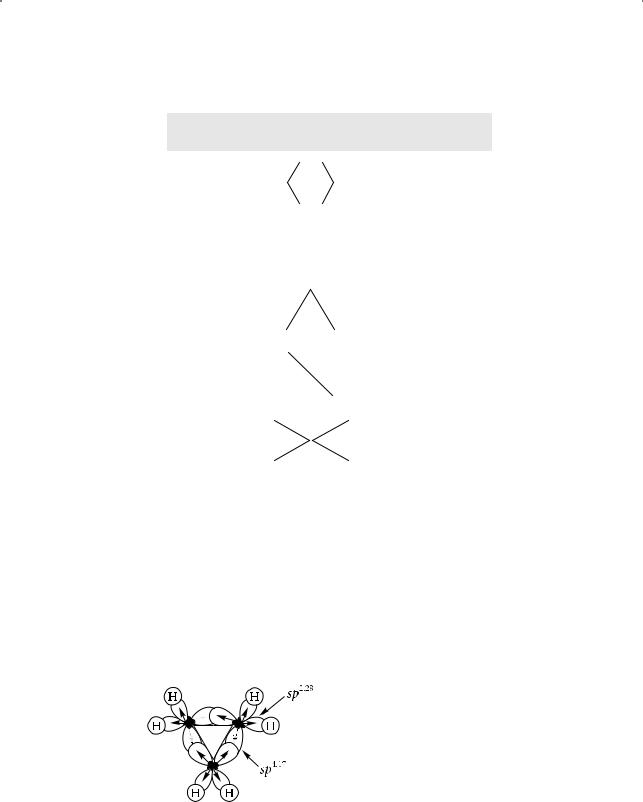
Длины связей С–С и С–Н в циклопропане меньше, а валентный угол НСН — больше, чем в этане (рис. 3.5).
Известно, что прочность связей определяется эффективностью перекрывания и типом атомных орбиталей. Так, если при образовании σ-связи гибридные орбитали перекрываются вдоль прямой, соединяющей два атома, то при
Рис. 3.5. Длины связей и валентные углы в молекуле циклопропана
101
Глава 3. Непредельные углеводороды и циклоалканы
Таблица 3.1. Значения энергий напряжения некоторых циклических углеводородов
Циклоалкан |
|
Структурная |
Энергия напряжения, |
|||||||
|
|
|
формула |
ккал/моль |
||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Циклогексан |
|
|
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Циклобутан |
|
|
|
|
|
|
|
|
|
26,0 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Циклопропан |
|
|
|
|
|
|
|
|
|
29,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Бициклобутан |
|
|
|
|
|
|
|
|
|
68,4 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Спиропентан |
|
|
|
|
|
|
|
|
|
63,6 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
образовании π-связи перекрывание р-орбиталей осуществляется вне этой линии. Отсюда очевидно, что σ-связи должны быть более прочными, чем π-связи. Кроме того, прочность σ-связи увеличивается с повышением доли s-орбитали в гибридной атомной орбитали.
Профессор Оксфордского университета Ч. Коулсон (Charles Alfred Coulson) предложил модель электронного строения циклопропана с участием изогнутых, или «банановых» связей в циклопропане (рис. 3.6).
Рис. 3.6. «Банановые» связи в молекуле циклопропана
102
