
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература
Глава 3. Непредельные углеводороды и циклоалканы
5.Какие соединения образуются при нагревании с концентрированной серной кислотой следующих спиртов: пропанола-1; 2-метилпропанола-2; 2,3-диметилбутанола-2?
6.Напишите уравнения химических реакций, обеспечивающих осуществление следующей цепочки превращений, и укажите условия, при которых они возможны: пропан → 2-бромпропан → пропен → 1-бромпропан → пропанол-1 → пропен.
7.Смесь бутена-2 и пропена массой 9,8 г занимает объем 4,48 л (н. у.). Вычислите массовые и объемные доли компонентов в смеси. Рассчитайте плотность этой смеси по кислороду.
§14. ЦИКЛОАЛКАНЫ: ИЗОМЕРИЯ, НОМЕНКЛАТУРА, ФИЗИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ
Общие сведения о циклоалканах
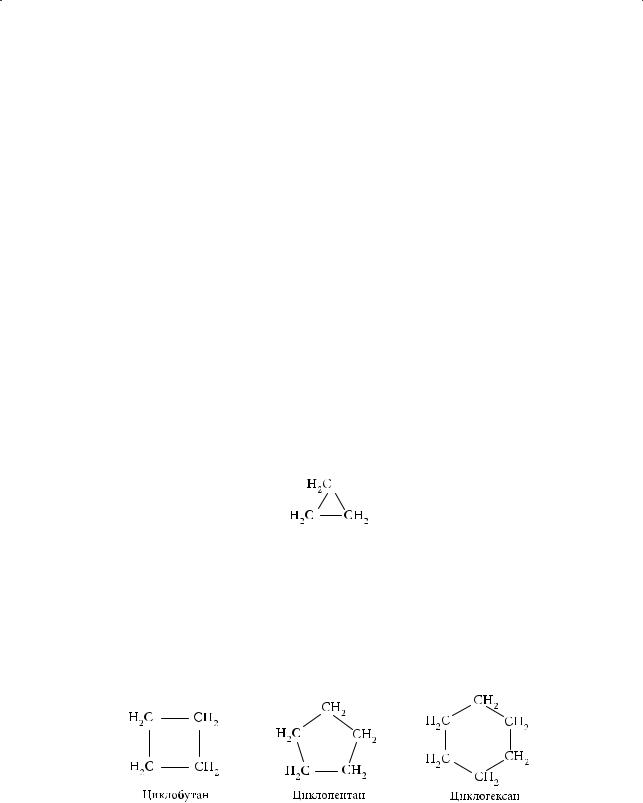
Особый класс соединений представляют собой углеводороды, в молекулах которых углеродная цепь замкнута в цикл. Они называются циклоалканами. По современной классификации циклоалканы подразделяются на малые циклы (3- и 4-членные); нормальные циклы (от 5- до 7-членных); средние циклы (от 8- до 11-членных); большие, или макроциклы (12-членные и более крупные).
Для того чтобы цепь углеродных атомов была замкнута в цикл, требуется как минимум три углеродных атома. Поэтому первым представителем класса циклоалканов является циклопропан:
Долгое время циклопропан использовался в анестезиологии для наркоза во время хирургических операций. Многие медико-биологические препараты и средства защиты растений (гербициды, фунгициды и пестициды) являются соединениями, молекулы которых содержат трехчленный углеродный цикл. Более сложные циклоалканы находят применение в качестве высокоэффективного топлива для космических ракет.
Следующим представителем этого класса является циклобутан — циклический углеводород, молекула которого содержит в составе цикла четыре углеродных атома, далее — циклопентан, циклогексан и т. д.
94
§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
Каждый последующий член ряда отличается от предыдущего на группу СН2. Если вывести молекулярные формулы перечисленных циклоалканов, получаем С3Н6, С4Н8, С5Н10, С6Н12. Образование цикла углеродных атомов из открытой цепи приводит к удалению двух атомов водорода. Следовательно, общая молекулярная формула для класса циклоалканов — СnH2n. Они относятся к алициклическим (алифатическим циклическим) углеводородам.
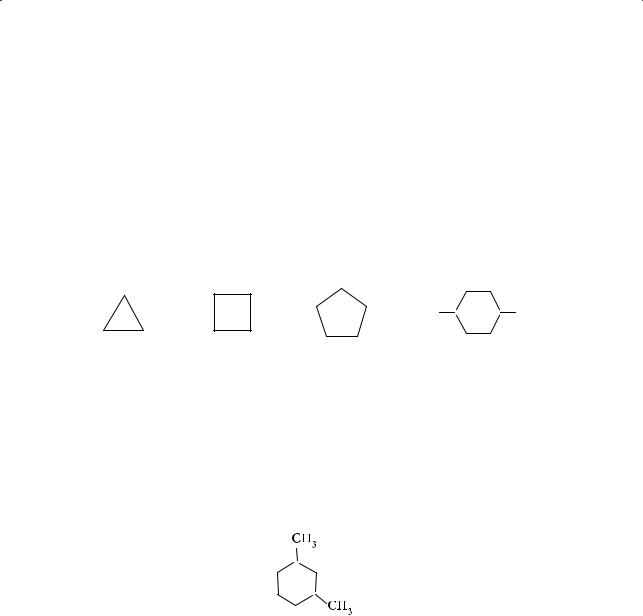
Алифатические кольца часто изображают в виде правильных многоугольников: треугольника (циклопропан), квадрата (циклобутан) и т. д., подразумевая, что в узлах цикла размещаются углеродные атомы, каждый из которых соединен с двумя атомами водорода (если в цикле нет иных заместителей):
H3C CH3
Циклопропан Циклобутан Циклопентан 1,4-Диметилциклогексан
Номенклатура и изомерия циклоалканов
Названия алициклических углеводородов образуются путем прибавления приставки «цикло-» к имени соответствующего алкана с тем же числом атомов углерода. Если в кольце имеются заместители, их положение обозначается цифрами таким образом, чтобы соответствующие числа были минимальными, например, 1,3-диметилциклогексан (а не 1,5-диметилциклогексан):
Если в кольце имеется один заместитель, то номер углеродного атома, при котором он расположен, не указывается, поскольку все атомы углерода цикла эквивалентны. Определенные сложности могут возникнуть при наличии в цикле боковой цепи. Проблема заключается в том, какой фрагмент взять в качестве основного названия: цикл или цепь. При этом руководствуются двумя принципами: максимальная замещенность фрагмента и размер фрагмента. В углеводороде, молекула которого содержит несколько цепочек, присоединенных к циклу, за основу берется цикл, например в следующей структуре (очередность перечисления заместителей обусловлена алфавитным порядком):
95
Глава 3. Непредельные углеводороды и циклоалканы
1-Бутил-2-метилциклопропан
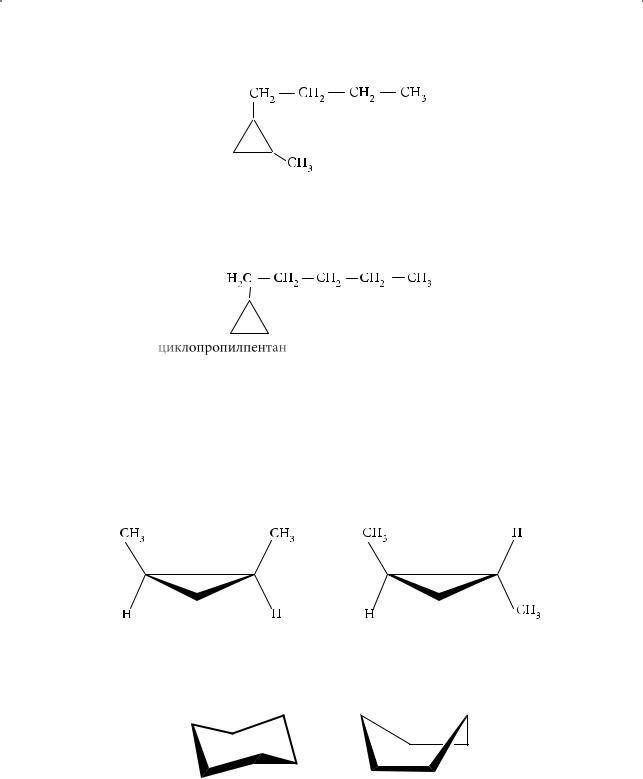
Если углеродная цепь по числу атомов углерода больше цикла, то за основу берется боковая цепь, например:
1-Циклопропилпентан
В ряду циклоалканов различают следующие виды структурной изомерии: изомерия взаимного положения заместителей; изомерия углеродного скелета заместителя, например пропилциклобутан и изопропилциклобутан; межклассовая изомерия (циклоалканы изомерны алкенам: например, циклопентан
и2-метилбутен-1).
Инаконец, два типа стереоизомерии, характерные для циклоалканов: геометрическая, или цис-транс-изомерия:
цис-1,2-Диметилциклопропан транс-1,2-Диметилциклопропан
иконформационная изомерия, например в случае циклогексана «кресло»
и«ванна»:
«кресло» |
«ванна» |
96
§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
Наиболее распространенными в природе циклоалканами являются циклопентан, циклогексан и их алкилзамещенные. Их также называют нафтенами, поскольку впервые они были обнаружены В. В. Марковниковым в составе нефти.
Физические свойства и получение циклоалканов
Циклопропан и циклобутан при обычных условиях — бесцветные газы, циклопентан и циклогексан — бесцветные жидкости с бензиновым запахом. Они легче воды и в воде не растворяются, их плотности равны соответственно 0,75 и 0,77 г/см3. Температуры плавления и кипения циклоалканов несколько выше, чем у алканов. Характерная способность углеводородов с открытой цепью «изгибаться» затрудняет их упаковку в кристаллической решетке (отсюда более низкие температуры плавления), а также понижает их тенденцию к взаимодействию с другими подобными себе молекулами (отсюда и более низкие температуры кипения).
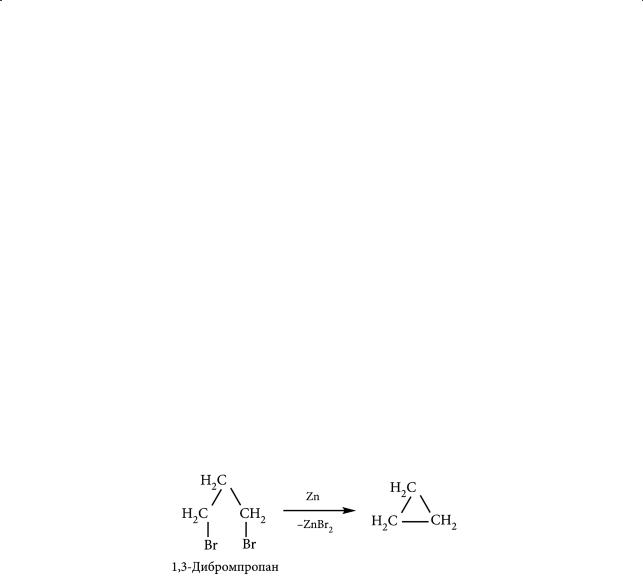
Циклопентан и циклогексан можно выделить из нефти. Циклопропан вследствие высокой реакционной способности не встречается в природе в свободном состоянии. Его можно получить действием цинковой пыли в этиловом спирте на 1,3-дибромиды, что представляет собой внутримолекулярный аналог реакции Вюрца:
Аналогичным образом можно получать и другие циклоалканы.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Составьте структурные формулы изомеров состава С4Н8 и назовите их по номенклатуре IUPAC.
2.Какие углеводороды получатся при действии цинка на следующие дигалогенопроизводные: 2,4-дибромпентан; 2,3-дибромгексан; 2,3-дибром-2,3-диметилбу- тан? Напишите уравнения реакций и назовите продукты.
3.Какие из приведенных далее названий веществ даны неверно: 1,6-диметилцик- логексан; пентилциклопропан; бромциклопентан; 1,2-диметилциклобутан? Исправьте ошибочные названия.
97
