
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

Глава 3. Непредельные углеводороды и циклоалканы
12.Напишите уравнения реакций получения следующих полимеров: а) полипропилена; б) поливинилхлорида; в) изобутилена.
13.Предложите метод синтеза полиэтилена, используя в качестве исходного сырья неорганические соединения.
14.При полимеризации 140 г изобутилена в присутствии серной кислоты был получен диизобутилен. Непрореагировавший изобутилен отогнали, а на диизобутилен подействовали бромом, причем было израсходовано 120 г брома. Вычислите выход диизобутилена.
§ 13. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЛКЕНОВ
Получение алкенов
Способы получения алкенов можно подразделить на промышленные и лабораторные.
Рассмотрим основные направления промышленного получения алкенов.
1.Промышленные способы
Кпромышленным способам относятся крекинг нефти и дегидрирование алканов.
Использование крекинг-газа. Крекинг-газ — побочный продукт перера-
ботки нефти. В его состав входят водород, низшие алканы (С1 — С4), а также этилен, пропен, изомерные бутены. Этилен обнаружен также в коксовом газе.
Термический или каталитический крекинг алканов:
.
Дегидрирование алканов:
.
2.Лабораторные способы
Все лабораторные способы получения алкенов основаны главным образом на реакциях отщепления.
Реакция дегидрогалогенирования (отщепление галогеноводорода). Отщепление галогеноводорода происходит при нагревании под действием спиртового раствора щелочи. Поскольку это сильное основание, оно и проявляет способность отщеплять кислоту (галогеноводород).
90

§ 13. Получение и применение алкенов
Использование же водного раствора щелочи приводит к образованию совсем другого продукта — спирта.
Если отщепление молекулы галогеноводорода происходит от несимметричного алкилгалогенида, то отщепление атома водорода происходит от наименее гидрогенизированного (с меньшим числом водородных атомов) атома углерода, т. е. в качестве главного продукта образуется алкен с бóльшим числом алкильных заместителей при двойной связи. Эта закономерность открыта в 1875 году русским химиком и учеником Бутлерова Александром Михайловичем Зайцевым и носит название правила Зайцева.
Бутен-1 получается в незначительных количествах.
Реакция дегидратации. В качестве катализатора и водоотнимающего агента используют обычно концентрированную серную кислоту:
Дегидратация спиртов происходит с участием серной, фосфорной кислот или оксида алюминия. Отщепление молекулы воды для вторичных и третичных спиртов также определяется правилом Зайцева.
91
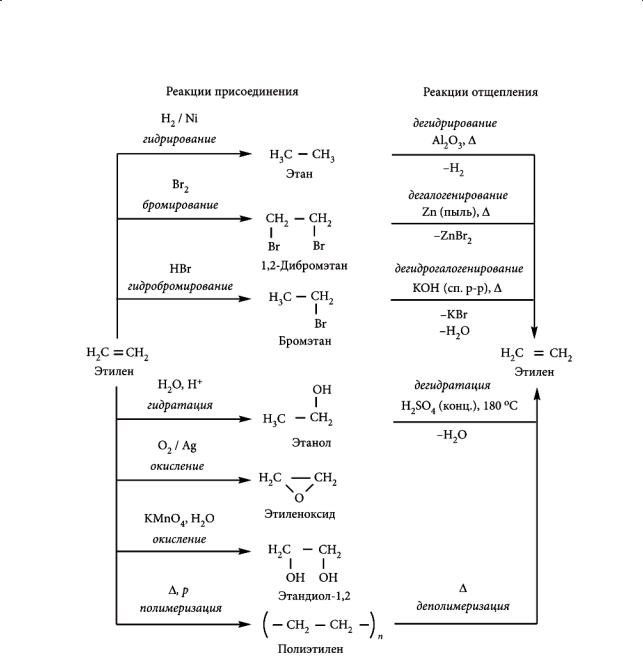
Глава 3. Непредельные углеводороды и циклоалканы
Рис. 3.2. Свойства и способы получения этилена
Обратим внимание на то, что алкены в этой реакции образуются в ходе внутримолекулярной дегидратации спиртов.
В более мягких условиях (t < 140 °С) происходит межмолекулярная дегидратация спиртов с образованием простых эфиров:
92
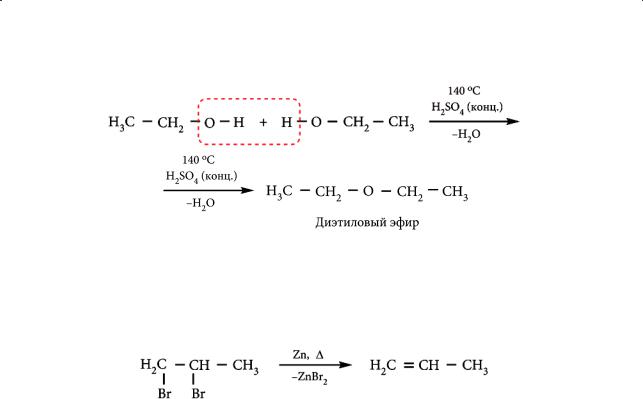
§ 13. Получение и применение алкенов
Дегалогенирование 1,2-дигалогеналканов. В качестве лабораторного способа получения алкенов используется и реакция дегалогенирования дигалогеналканов, в молекулах которых атомы галогенов размещаются у соседних углеродных атомов:
Основные химические свойства алкенов и методы их получения на примере этилена представлены на схеме (рис. 3.2).
Применение этилена
На основе этилена получают уксусный альдегид, этиловый спирт, ацетилен, этиленоксид и т. д. Значительные количества этилена идут на производство полиэтилена.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Напишите уравнения реакций получения пропена из: а) пропанола-1; б) пропано- ла-2; в) 1-хлорпропана; г) 2-хлорпропана; д) 1,2-дихлорпропана.
2.Предложите метод синтеза бутена-2 с использованием в качестве исходного соединения бутена-1.
3.Изооктан (2,2,4-триметилпентан) — антидетонационная добавка к бензину — может быть синтезирован из изобутилена и изобутана в присутствии минеральных кислот. Запишите уравнение химической реакции синтеза этого углеводорода и обсудите механизм реакции.
4.Укажите, из каких галогенопроизводных углеводородов при действии спиртового раствора КОН могут быть получены следующие алкены: 2-метилпентен-1; 3-ме- тилпентен-2; 4-метил-3-этилпентен-2; 3-этилгексен-2?
93
