
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

Глава 3
Непредельные
углеводороды и циклоалканы
Непредельные углеводороды содержат в своем составе кратные углерод-угле- родные связи: двойные С=С или тройные С≡С. Термин «непредельные» (ненасыщенные) объясняется способностью этих соединений вступать в реакции присоединения с разрывом кратных связей, превращаясь при этом в предельные (насыщенные) углеводороды или их производные.
§ 11. АЛКЕНЫ: ГОМОЛОГИЧЕСКИЙ РЯД, НОМЕНКЛАТУРА, ИЗОМЕРИЯ. СТРОЕНИЕ МОЛЕКУЛ АЛКЕНОВ
Гомологический ряд алкенов
Простейшими непредельными углеводородами являются соединения с одной двойной связью. Первый представитель этого класса углеводородов — этилен СН2=СН2.
Алкены — непредельные углеводороды с открытой цепью, в молекулах которых содержится одна двойная связь. Общая формула гомологического ряда
алкенов — СnH2n.
Этилен открывает гомологический ряд алкенов.
Подобно алканам в ряду алкенов ближайшие гомологи отличаются по составу друг от друга на гомологическую разность СН2. Ниже приведены назва-

§ 11. Алкены: гомологический ряд, номенклатура, изомерия
ния и структурные формулы некоторых углеводородов гомологического ряда этилена:
Этен |
H2C=CH2; |
Пропен |
H2C=CH–CH3; |
Бутен-1 |
H2C=CH–CH2–CH3; |
Пентен-1 |
H2C=CH–CH2–CH2–CH3; |
Гексен-1 |
H2C=CH–CH2–CH2–CH2–CH3; |
Гептен-1 |
H2C=CH–CH2–CH2–CH2–CH2–CH3 |
и т. д. |
|
Номенклатура алкенов
Названия алкенов образуются из названий соответствующих алканов с заменой суффикса «-ан» на «-ен» и указанием положения двойной связи в цепи с помощью локанта, записываемого через дефис после основы названия.
Выбирая длинную цепочку (а ведь это главное требование, которое надо выполнить при составлении названия по номенклатуре IUPAC), помните, что она должна включать в себя двойную связь, которая и определит порядок нумерации углеродной цепи. Нумерация цепи начинается с того конца, который ближе к двойной связи: углеродному атому при двойной связи присваивается наименьший из возможных номеров. Положение и названия заместителей указываются, как обычно, перед основой названия.
Например:
Если кратная связь равноудалена от концов углеродной цепи, нумерацию ведут от атома углерода, к которому ближе расположен заместитель.
Состав непредельных радикалов, получаемых при отщеплении одного атома водорода, отвечает формуле СnH2n–1. Для простейших из них, образованных молекулами этилена и пропена, часто используют тривиальные названия винил (СН2=СН–) и аллил (СН2=СН–СН2–) соответственно.
Для алкенов характерны два типа изомерии: структурная и пространственная. Структурная изомерия включает:
73

Глава 3. Непредельные углеводороды и циклоалканы
—изомерию углеродного скелета:
—изомерию положения двойной связи:
—межклассовую изомерию (алкены изомерны циклоалканам):
Строение молекул алкенов
Каждый из атомов углерода этилена образует три σ-связи: две с водородными атомами и одну с соседним атомом углерода:
Для образования σ-связей углеродному атому требуется три гибридные орбитали, следовательно атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. В гибридизации участвуют одна s-орбиталь и две р-орбитали углеродного атома в возбужденном состоянии. Остается одна р-орбиталь, которая участвует в образовании нового типа связи — π-связи.
Условный процесс sp2-гибридизации атомных орбиталей валентного слоя углеродного атома можно иллюстрировать следующей схемой:
|
|
→ |
|
s-орбиталь |
три |
три гибридные |
негибридизованная |
|
р-орбитали |
sp2-орбитали |
pz-орбиталь |
74

§ 11. Алкены: гомологический ряд, номенклатура, изомерия
Рис. 3.1. Схема образования связей в молекуле этилена: а — образование σ-связей; б — образование π-связей; в — распределение π-электронной плотности в молекуле этилена
Три гибридные орбитали находятся в одной плоскости. Перпендикулярно к ней ориентируются не затронутые гибридизацией р-орбитали. Взаимное перекрывание параллельных р-орбиталей приводит к образованию π-связи. Электронным строением молекулы этилена определяется ее пространственное строение. Центры ядер всех шести атомов молекулы этилена расположены в одной плоскости, перпендикулярной плоскости π-связи. Все валентные углы близки к 120°.
Длина двойной связи значительно меньше длины одинарной и составляет 0,133 нм.
На рис. 3.1 приведены схемы образования σ- и π-связей в молекуле этилена. Двойная связь представляет собой область повышенной электронной плотности, которая доступна для атаки частиц (заряженных или нейтральных) с дефицитом электронной плотности — электрофилов. Таким образом, алкены легко должны вступать в реакции электрофильного присоединения (АЕ)
по двойной связи, протекающих по ионному (электрофильному) механизму. Энергия связи С=С составляет 598 кДж/моль. Это меньше, чем удвоенное
значение энергии простой связи (700 кДж/моль), т. е. π-связь менее прочна и легче подвергается разрыву в процессе химических реакций.
75

Глава 3. Непредельные углеводороды и циклоалканы
Пространственная изомерия в ряду алкенов (цис-транс-изомерия)
В отличие от σ-связи π-связь не имеет цилиндрической симметрии. Поворот относительно двойной С=С связи привел бы к разрыву π-связи. Таким образом, свободное вращение вокруг двойной связи невозможно. Поэтому положение в пространстве заместителей при углеродных атомах, соединенных двойной связью, жестко фиксировано.
Следствием этого является наличие у алкенов одного из видов стереоизомерии — геометрической, или цис-транс-изомерии, отсутствующей в алканах. Если заместители расположены по одну сторону от двойной связи (например, атомы брома или алкильные группы) — это цис-изомер (от лат. cis — с одной стороны), если по разные стороны — это транс-изомер (от лат. trans — через). Изомеры 1,2-дибромэтена выглядят следующим образом:
Br |
Br |
H |
|
Br |
||
C |
|
C |
|
C |
|
C |
|
|
|||||
|
|
|
||||
|
|
|||||
|
|
|
||||
H |
H |
Br |
|
H |
||
цис-изомер транс-изомер
Цис-транс-изомеры отличаются друг от друга физическими и некоторыми химическими свойствами: транс-изомер обычно термодинамически более стабилен, поскольку объемные заместители удалены друг от друга на большее расстояние.
Если в молекуле этилена атомы водорода замещены на три или четыре различных заместителя, то для обозначения конфигурации двойных связей цис- и транс-изомеров используют Е,Z-систему, в основе которой лежит принцип старшинства заместителей. Старшим заместителем является тот, который имеет наибольший атомный номер. Например, бром старше хлора, а хлор, соответственно, старше углерода.
Аесли с атомами углерода при двойной связи соединены атомы одной
итой же природы, можно ли в этом случае ранжировать их по старшинству? Можно. Пусть эти одинаковые атомы — атомы углерода. Если один из них соединен, например, с водородом, а другой — с углеродом, последний и будет старшим.
Если старшие заместители каждой пары находятся по одну сторону от двойной связи, то конфигурацию обозначают префиксом Z- (сокр. от нем.
76
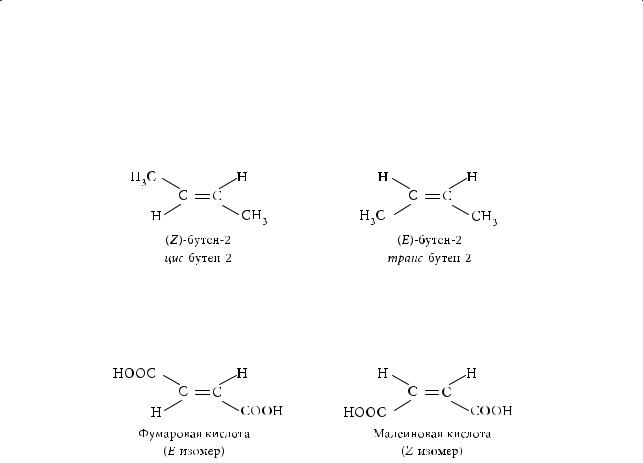
§ 11. Алкены: гомологический ряд, номенклатура, изомерия
zusammen — вместе), если по разные стороны, соответствующий стереоизомер обозначают префиксом Е- (сокр. от нем. entgegen — напротив).
E,Z-система однозначно указывает расположение заместителей, что при использовании префиксов цис- и транс- не всегда возможно.
Одним из первых примеров геометрической изомерии явились непредельные двухосновные карбоновые кислоты — фумаровая и малеиновая:
У цис-изомера (в малеиновой кислоте) карбоксильные группы расположены по одну сторону, а у транс-изомера (в фумаровой) — по разные стороны от двойной связи.
Для цис-изомеров характерны более высокие температуры кипения, тогда как транс-изомеры, будучи более симметричными, отличаются более высокими температурами плавления. Так, температура плавления малеиновой кислоты составляет 135 °С, а фумаровой — 287 °С. Цис- и транс-изомеры различаются даже по биологической активности: фумаровая кислота токсична, малеиновая — нет.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Запишите молекулярную и структурную формулы 2-метилбутена-2 и составьте формулы и названия возможных структурных изомеров этого соединения. Какие
из них могут существовать в виде цис-транс-изомеров?
2.Правильно ли утверждение: «Углеводород состава С7Н14 относится к классу алкенов»? Ответ обоснуйте.
77
