
- •Органическая химия для школьников
- •Оглавление
- •Предисловие
- •Глава 1. Введение в органическую химию
- •§ 1. Теория химического строения органических соединений А. М. Бутлерова
- •§ 2. Классификация органических соединений
- •§ 3. Строение атомов
- •§ 4. Типы и характеристики химической связи
- •§ 5. Первоначальные представления о типах и механизмах органических реакций
- •Глава 2. Алканы
- •§ 6. Изомерия и номенклатура алканов
- •§ 7. Гомологи. Гомологический ряд алканов
- •§ 8. Строение молекул алканов. Физические свойства алканов
- •§ 9. Химические свойства алканов
- •§ 10. Получение и применение алканов
- •§ 11. Алкены: гомологический ряд, номенклатура, изомерия. Строение молекул алкенов
- •§ 12. Физические и химические свойства алкенов
- •§ 13. Получение и применение алкенов
- •§ 14. Циклоалканы: изомерия, номенклатура, физические свойства и получение
- •§ 15. Строение и химические свойства циклоалканов
- •§ 16. Алкины: изомерия и номенклатура. Строение молекулы ацетилена
- •§ 17. Физические и химические свойства алкинов
- •§ 18. Получение и применение алкинов
- •§ 20. Строение и свойства дивинила
- •§ 21. Каучук. Резина
- •§ 23. Электронное и пространственное строение бензола. Изомерия и номенклатура аренов
- •§ 26. Конденсированные ароматические углеводороды
- •§ 27. Природные источники углеводородов. Нефть
- •Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
- •§ 28. Галогенопроизводные углеводородов
- •§ 29. Спирты: классификация, изомерия, номенклатура и методы получения
- •§ 30. Физические и химические свойства спиртов. Водородная связь
- •§ 31. Многоатомные спирты
- •§ 32. Фенолы: классификация, особенности строения, физические свойства. Получение и применение фенола
- •§ 33. Химические свойства фенола
- •§ 34. Простые эфиры
- •Глава 6. Карбонильные соединения. Альдегиды и кетоны
- •§ 35. Альдегиды и кетоны: классификация, номенклатура, изомерия и физические свойства
- •§ 36. Получение альдегидов и кетонов. Строение карбонильной группы
- •§ 37. Химические свойства альдегидов и кетонов
- •Глава 7. Карбоновые кислоты
- •§ 40. Строение карбоновых кислот, их физические и химические свойства
- •§ 41. Важнейшие представители карбоновых кислот
- •§ 42. Гидроксикислоты и кетокислоты. Оптическая изомерия
- •§ 43. Сложные эфиры
- •§ 44. Жиры: строение, свойства, применение и роль в природе
- •Глава 8. Углеводы
- •§ 45. Классификация углеводов. Глюкоза
- •§ 46. Химические свойства глюкозы и ее получение
- •§ 47. Дисахариды
- •§ 48. Полисахариды
- •Глава 9. Амины
- •§ 50. Электронное и пространственное строение аминов. Химические свойства аминов
- •Глава 10. Аминокислоты. Белки
- •§ 51. Классификация, изомерия, номенклатура аминокислот
- •§ 53. Белки
- •Глава 11. Гетероциклические соединения. Нуклеиновые кислоты
- •§ 54. Общая характеристика гетероциклических соединений
- •§ 55. Нуклеиновые кислоты
- •Глава 12. Обобщающие разделы курса органической химии
- •§ 56. Теория химического строения органических соединений как основа курса органической химии
- •§ 57. Полимеры
- •Литература

Глава 2. Алканы
§ 9. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Прогноз реакционной способности алканов
Все химические связи в молекулах алканов полностью насыщены, следовательно реакции присоединения для них невозможны, а происходят лишь реакции замещения или отщепления. В молекулах алканов содержатся только σ-связи, их прочность достаточно высока. Они будут разрываться только в жестких условиях при высоких температурах или при облучении. Поэтому алканы называют также парафинами (от лат. parum affinis — малое сродство). Чаще всего в реакциях с их участием происходит гомолитический разрыв ковалентной связи с промежуточным образованием свободных радикалов.
Таким образом, для алканов наиболее характерно свободнорадикальное замещение (SR). Важнейшими реакциями алканов являются реакции горения, полного разложения, галогенирования, нитрования, дегидрирования, крекинга и изомеризации.
Рассмотрим их подробнее.
Химические свойства алканов
Горение алканов. Алканы горят на воздухе и в кислороде некоптящим пламенем, что существенно при их идентификации в сравнении с непредельными и ароматическими углеводородами, где процентное содержание углерода больше.
Смесь метана с кислородом (в объемном соотношении 1 : 2) или воздухом при поджигании может взрываться:
CH4 (г.) + 2O2 (г.) → CO2 (г.) + 2H2O (г.) + 804,5 кДж.
Врезультате полного горения алканов образуются оксид углерода(IV) СО2
ивода. При недостатке кислорода получаются оксид углерода(II) СО и сажа — аморфная разновидность графита. В результате процессов горения выделяется большое количество тепла, что позволяет использовать алканы как топливо. С ростом углеродной цепи склонность алканов к неполному горению увеличивается:
С3Н8 |
+ 5О2 |
→ 3СО2 + 4Н2О |
(полное горение); |
С3Н8 |
+ 3,5О2 → 3СО + 4Н2О |
(неполное горение); |
|
С3Н8 |
+ 2О2 |
→ 3С + 4Н2О |
(неполное горение). |
При сильном нагревании без доступа воздуха происходит полное разложение алканов на простые вещества (полный пиролиз).
60

§ 9. Химические свойства алканов
Пиролиз — разложение вещества при высокой температуре (без доступа воздуха). Кроме полного пиролиза возможен и неполный. Например, неполный пиролиз метана является основным промышленным методом получения ацетилена:
2CH4 1500 °C CH  CH + 3H2.
CH + 3H2.
Ацетилен
Галогенирование алканов. Одной из важнейших реакций алканов является галогенирование, в результате которого происходит замещение атомов водорода в молекулах алканов атомами галогенов. Практическое значение имеют только хлорирование и бромирование.
Фторирование алканов происходит чрезвычайно интенсивно, даже при низких температурах, с выделением большого количества тепла и разрушением углеродной цепи:
С3Н8 + 10F2 → 3CF4 + 8HF.
Иодирование алканов, наоборот, эндотермическая реакция и поэтому фактически не происходит. Хлорирование предельных углеводородов обычно проводят при освещении, бромирование — при облучении и нагревании:
CH4 + Cl2 hν CH3Cl + HCl.
CH3Cl + HCl.
Хлорметан
Наряду с монозамещенным продуктом (хлорметаном) образуются и продукты с более высокой степенью замещенности: ди-, три- и тетрахлорметан:
CH4 |
Cl2, hν |
CH3Cl |
Cl2, hν |
CH2Cl2 |
Cl2, hν |
CHCl3 |
Cl2, hν |
CCl4 |
||||
–HCl |
|
–HCl |
–HCl |
|
–HCl |
|
||||||
|
|
|
|
|
||||||||
|
|
|
Хлорметан |
Дихлорметан Трихлорметан Тетрахлорметан |
||||||||
Механизм реакции галогенирования. Галогенирование алканов идет по
свободнорадикальному механизму. Напомним, что реакции свободнорадикального замещения принято обозначать SR (S — сокр. от англ. substitution — замещение; R — радикальное).
Любая радикальная реакция включает три этапа: инициирование цепи;
рост, или развитие, цепи; обрыв цепи.
1. Инициирование цепи. Свет инициирует гомолитическое расщепление молекулы хлора: ковалентная неполярная связь между атомами хлора разрывается и образуются свободные атомы хлора с неспаренным электроном. Они обладают свойствами радикала — избыточной энергией:
Cl : Cl hν  2 Cl˙
2 Cl˙
61

Глава 2. Алканы
Николай Николаевич Семёнов (1896–1986)
Закончил физико-математический факультет Санкт-Петер- бургского университета, ученик известнейшего физика А. Ф. Иоффе.
В 1956 году Н. Н. Семёнову совместно с английским физи- ко-химиком профессором С. Н. Хиншелвудом (Cyril Norman Hinshelwood) присуждена Нобелевская премия по химии «за исследования в области механизма химических реакций». Обладатель почетных степеней ряда европейских университетов.
При этом может возникнуть вопрос: почему гомолитическому расщеплению в первую очередь подвергаются молекулы хлора, а не метана? Причина такой избирательности заключается в различии в энергии связей С–Н и Cl–Cl: они равны соответственно 435 и 242 кДж/моль. Молекулы хлора легче образуют свободные радикалы.
2. Рост, или развитие, цепи. Радикалы хлора, обладая избытком энергии, атакуют нейтральные молекулы метана с образованием новых метильных радикалов (СН3.), которые далее атакуют не распавшиеся на первом этапе молекулы хлора с образованием первого продукта замещения, хлорметана, и новых радикалов хлора:
СН4 + Сl· → CH3·+ HCl CH3 ·+ Cl2 → CH3Cl + Сl·
.............................................
3. Обрыв цепи. На этой стадии происходит исчезновение свободных радикалов из реакционной смеси и, таким образом, прекращение реакции. Это возможно при столкновении радикалов со стенками сосуда, а также при соединении двух радикалов (димеризация радикалов):
СН3. + .СН3 → СН3–СН3.
Возможны и другие пути исчезновения радикальных частиц, например реакция радикального диспропорционирования, которая имеет место при высокотемпературном крекинге алканов, горении топлива:
CH3CH2·+ CH3CH2· → CH3–CH3 + CH2=CH2.
Введение специальных веществ — ингибиторов (от лат. inhebere — сдерживать, останавливать) — в количествах 0,01–0,001 % также тормозит ради-
62
§ 9. Химические свойства алканов
кальные процессы. В качестве ловушек для радикалов могут использоваться гидрохинон, иод, оксид азота(II), трифенилметан и т. д.
В изучение цепных реакций значительный вклад внесли академик Н. Н. Семёнов и английский химик С. Хиншельвуд. В 1956 году они были удостоены Нобелевской премии по химии «за исследования в области механизма химических реакций».
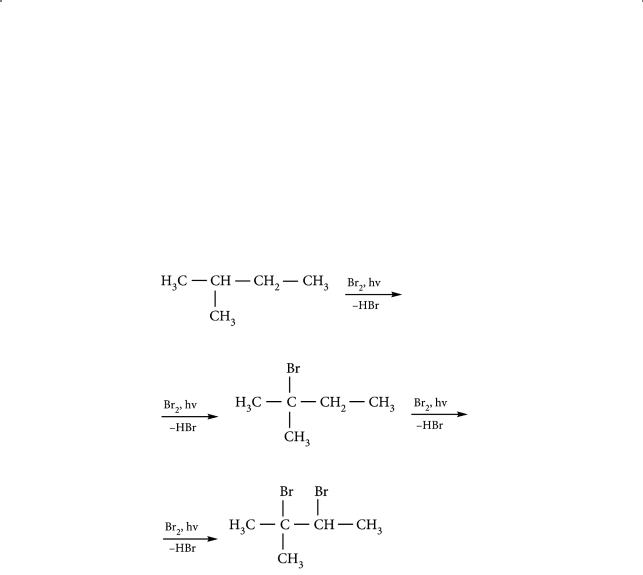
Бромирование, в отличие от хлорирования, происходит медленнее, а значит, селективнее. Рассмотрим процесс бромирования алканов на примере 2-метилбутана:
Основной монозамещенный продукт (> 90 %) — 2-бром-2-метилбутан, т. е. замещение происходит в первую очередь при третичном атоме углерода. Энергия связи С–Н для третичного атома углерода наименьшая.
Почему? Это объясняется тем, что третичные радикалы, образующиеся в ходе галогенирования алканов, стабильнее вторичных, а те, в свою очередь, стабильнее первичных. Хлорирование алканов происходит менее избирательно, так как хлор является более активным галогеном и скорость реакции довольно высока.
Нитрование алканов. Нитрование — это реакция, с помощью которой осуществляется введение в молекулу органического соединения нитрогруппы
63
Глава 2. Алканы
NO2. В качестве нитрующего агента часто используется разбавленная азотная кислота.
В общем виде нитрование алканов идет по следующей схеме:
R — H + HO — NO2  R — NO2 + H2O.
R — NO2 + H2O.
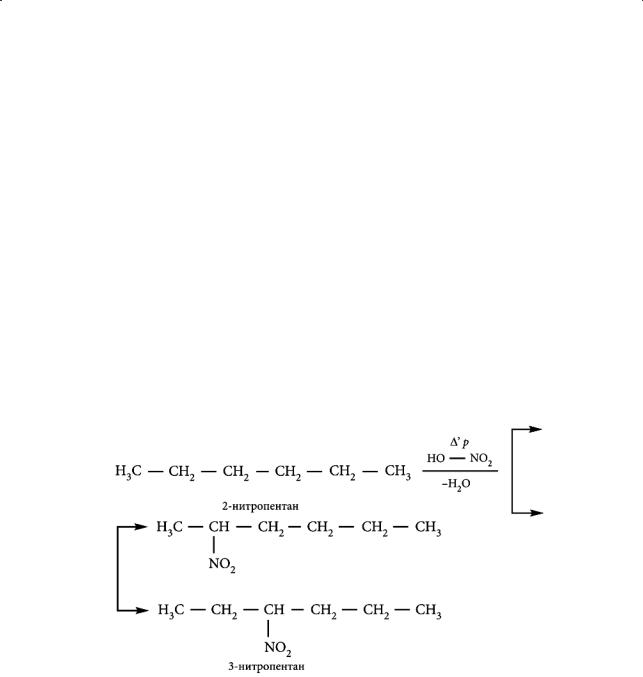
Впервые нитрование алканов было изучено в 1888–1893 годах М. И. Коноваловым в лаборатории профессора В. В. Марковникова. По образному выражению самого Коновалова, они осуществили оживление «химических мертвецов», заставив реагировать неактивные в химическом отношении парафины. Алканы нитруются разбавленной азотной кислотой при высоких температурах. Реакция идет по механизму свободнорадикального замещения, так же как и в случае галогенирования алканов. Начальной стадией является взаимодействие радикала NO2. с углеводородом, в результате чего образуются свободные радикалы.
Реакция Коновалова — нитрование жидких алканов (начиная с С5H12). Жидкие алканы запаивают в ампулы вместе с нитрующим реагентом — 25 %-ным раствором азотной кислоты и нагревают до 140–150 °С.
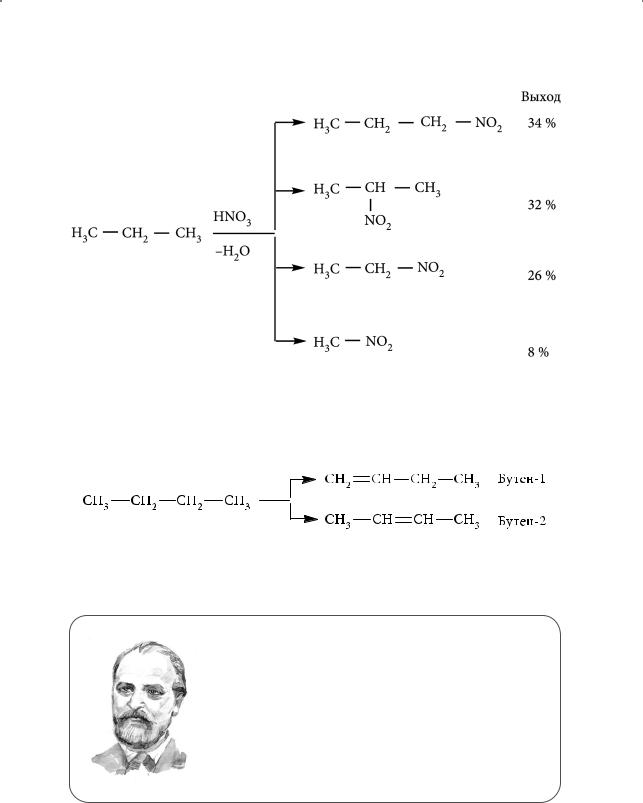
В реакцию вступают практически все алканы, но скорость реакции и выход нитросоединений невелики. В промышленности широкое применение нашло парофазное нитрование. Его осуществляют парами азотной кислоты при 250–500 °С. Реакция сопровождается крекингом (от англ. crack — расщеплять) — высокотемпературным расщеплением углеродных связей. Например, нитрование пропана происходит по следующей схеме:
64
§ 9. Химические свойства алканов
Дегидрирование алканов. Дегидрирование — процесс отщепления водорода. Реакция имеет большое практическое значение. В результате дегидрирования алканов образуются алкены. Например, продуктами дегидрирования н-бутана являются бутены:
Реакция осуществляется при нагревании с использованием катализаторов на основе никеля, платины, палладия.
Михаил Иванович Коновалов (1858–1906)
Научные исследования начал под руководством профессора В. В. Марковникова в области органической химии. В 1888 году открыл способность насыщенных углеводородов замещать водород на нитрогруппу под действием разбавленной 13 %-ной азотной кислоты при нормальном или повышенном давлении в интервале температур 90–140 °С. Реакция нитрования алканов получила название реакции Коновалова и нашла широкое применение в промышленном органическом синтезе.
65
Глава 2. Алканы
Крекинг алканов. При нагревании без доступа воздуха происходит разрушение углеродной цепочки алкана. Продукты крекинга — алканы и алкены.
Рассмотрим крекинг декана:
С10Н22  С5Н10 + С5Н12.
С5Н10 + С5Н12.
Существует несколько способов проведения крекинга: термический (700–650 °С), каталитический (450 °С, в качестве катализаторов используются оксиды алюминия, хрома, кремния) и гидрокрекинг (450–500 °С, в атмосфере водорода). При термическом и каталитическом крекинге образуются алканы и алкены; при гидрокрекинге — только алканы (образующиеся алкены в атмосфере водорода гидрируются до алканов). При термическом крекинге образуются низкомолекулярные алканы линейного строения, при каталитическом — разветвленного строения.
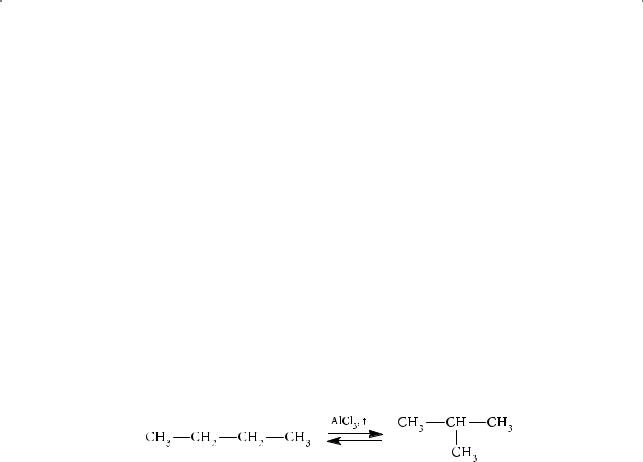
Изомеризация алканов. Изомеризация — превращение алканов нормального строения в изомерные им алканы с разветвленной углеродной цепочкой. Процесс осуществляется под действием катализатора хлорида алюминия. В качестве примера рассмотрим изомеризацию н-бутана:
Реакция обратима. В данной равновесной реакционной смеси примерно 60 % 2-метилпропана и 40 % н-бутана.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Как строение алканов определяет их химические свойства? Дайте аргументированный ответ.
2.Поясните смысл следующих терминов: «парафины», «ингибитор», «крекинг», «пиролиз».
3.Энергии связей Стрет.–Н, Свторичн.–Н и Спервичн.–Н равны соответственно 376, 390, 415 кДж/моль. Почему связь третичного углеродного атома с атомом водорода наименее прочная? Какой продукт образуется в наибольшем количестве, а какой — в наименьшем при радикальном бромировании 2-метилбутана?
4.Почему алканы горят некоптящим пламенем? Составьте химические уравнения
полного сгорания метана, гексана и метанола (СН3ОН) и ответьте на следующий вопрос: почему в случае метана изменение энтальпии по абсолютной величине намного меньше, чем для гексана, но больше, чем для метанола (∆Н, кДж/моль,
равна: для метана — 890, метанола — 726, гексана — 4163; углерода — 393; водорода — 286)? При ответе на вопрос учтите, что изменение энтальпии зависит от числа связей, которые разрываются или образуются.
66
